Dihydrolipoyl transacylase
La dihydrolipoyl transacylase est une acyltransférase qui fait partie du complexe 3-méthyl-2-oxobutanoate déshydrogénase, dont elle est l'enzyme E2, complexe qui réalise la conversion de l'α-cétovaline en Isobutyryl-CoA et CO2 :
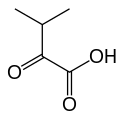
+ CoA-SH + NAD+ → NADH + H+ + CO2 + 
α-Cétovaline Isobutyryl-CoA
S-succinyltransférase
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Plus précisément, l'enzyme E2 catalyse le transfert du groupe isobutyryle sur la coenzyme A depuis le lipoamide sur laquelle elle a été fixée à l'étape précédente, catalysée par la 3-méthyl-2-oxobutanoate déshydrogénase.
Le mécanisme de cette réaction, qui fait intervenir successivement les enzymes E1, E2 et E3, chacune avec ses cofacteurs, est assez complexe, et peut être résumé par le schéma simplifié ci-dessous :
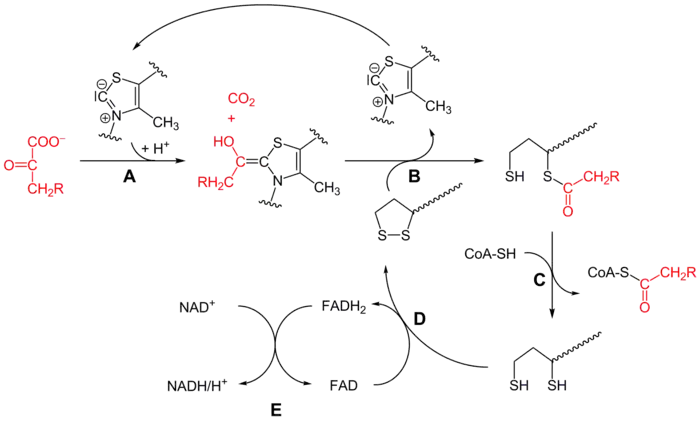 Mécanisme réactionnel du complexe 3-méthyl-2-oxobutanoate déshydrogénase (CH2R = CH(CH3)2 sur ce schéma) :
Mécanisme réactionnel du complexe 3-méthyl-2-oxobutanoate déshydrogénase (CH2R = CH(CH3)2 sur ce schéma) :
- la 3-méthyl-2-oxobutanoate déshydrogénase (E1) catalyse les étapes A et B avec la thiamine pyrophosphate (TPP),
- la dihydrolipoyl transacylase (E2) catalyse l'étape C avec le lipoamide et la coenzyme A (CoA-SH),
- la dihydrolipoyl déshydrogénase (E3) catalyse les étapes D et E avec le FAD et le NAD+.
La dihydrolipoyl transacylase
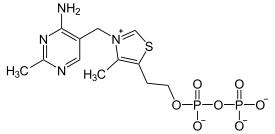
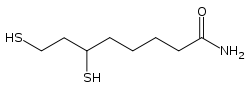
La dihydrolipoyl transacylase est une acyltransférase faisant intervenir successivement trois cofacteurs : la thiamine pyrophosphate (TPP, liée à l'α-cétoglutarate déshydrogénase), le dihydrolipoamide et la coenzyme A (CoA-SH), cette dernière étant convertie en acétyl-coenzyme A (acétyl-CoA).
 |
 |
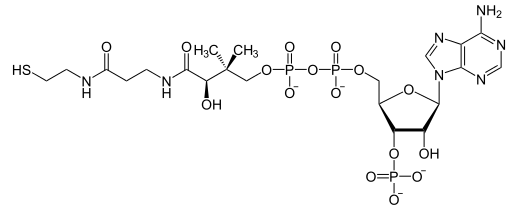 | ||
| Thiamine pyrophosphate (TPP) | Dihydrolipoamide | Coenzyme A (CoA-SH) |
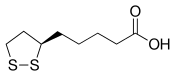
Le véritable cofacteur est en fait l'acide lipoïque davantage que le (dihydro)lipoamide, mais cet acide carboxylique est lié par covalence à la protéine E2 au moyen d'une liaison amide sur un résidu lysine, ce qui donne l'équivalent d'un résidu lipoamide.
 |
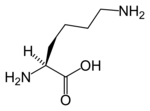 | |
| Acide lipoïque | L-Lysine |
Articles connexes
- Dihydrolipoamide S-acétyltransférase, enzyme E2 du complexe pyruvate déshydrogénase
- Dihydrolipoamide S-succinyltransférase, enzyme E2 du complexe α-cétoglutarate déshydrogénase
- Portail de la biochimie