Exosome (vésicule)
Les exosomes sont des vésicules de 30 à 90 nm[1], qui sont déversées par une cellule dans son environnement. À la différence des ectosomes, ils relarguent directement leur contenu intracellulaire dans le milieu extracellulaire (les ectosomes les relarguent empaquetés à l'intérieur de vésicules plus ou moins durables).
Pour les articles homonymes, voir Exosome (homonymie).
Ils ont été décrits pour la première fois en 1983[2].
Formation
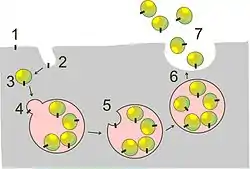
Ils peuvent être formés par tous les types cellulaires et notamment par les lymphocytes, les plaquettes, les mastocytes, les cellules dendritiques, les cellules souches, les astrocytes ou les cellules tumorales. Les exosomes sont formés à partir des endosomes tardifs : la membrane endosomale s'invagine et il y a formation de vésicules dans ce compartiment. Cette structure est appelée corps multivésiculaire[réf. nécessaire]. L'endosome peut ensuite aller fusionner avec le lysosome ce qui aboutira à sa dégradation; ou alors, l'endosome peut fusionner avec la membrane plasmique et cette fusion permet la libération des exosomes dans l'espace extracellulaire. Les exosomes contiennent différents constituants tels que des acides nucléiques et des protéines. Ces protéines se retrouvent dans le cytosol ou les compartiments endosomaux, jamais dans le réticulum endoplasmique, l'appareil de Golgi, les mitochondries ou le noyau[3].
Les exosomes peuvent circuler dans le sang et jouer ainsi un rôle à distance de leur lieu de production[4].
Rôles
Les exosomes servent de véhicules de transport et d'expulsion de composants cellulaires. Les exosomes assurent les mêmes fonctions que leur cellule parentale. En outre, ils servent à la communication cellulaire en transférant des ARN messagers et des microARN[5] et peuvent par exemple jouer un rôle dans l'immunité cellulaire, comme pour le relargage de CMH II[6]. Les virus, comme les VIH utilisent aussi les exosomes à des fins de transport et de camouflage. Ces derniers participent également à la croissance des tumeurs[7] et pourraient contribuer à la genèse de la maladie d'Alzheimer[8].
Utilisation expérimentale en thérapeutique
Des recherches envisagent l'utilisation d'exosomes contenant des molécules thérapeutiques pour soigner les maladies autoimmunes ou le cancer. Des essais ont été effectuées sur un modèle animal d'hypertension artérielle pulmonaire avec des exosomes issus de cellules stromales du mésenchyme, permettant une amélioration de la maladie[9]. Des essais cliniques sur la souris pour le traitement des cancers du pancréas ont montré des résultats prometteurs en améliorant le taux de survie des souris[10]. Ces recherches utilisent en 2017 des exosomes modifiés génétiquement pour introduire des ARN interférents dans les cellules cancéreuses[11]. En 2006, une expérience impliquant les exosomes mais réalisée par vaccination directe avec de l'ADN plasmidique a été tentée avec succès[12].
L'un des problèmes est l'obtention et l'isolement des exosomes. les techniques utilisées sont la centrifugation[13], l'ultrafiltration[14] ou l'immunoprécipitation[15].
Des études récentes ont montré que l'alcalinisation lysosomale par la chloroquine favorise la sécrétion d'exosomes hébergeant l'α-synucléine ainsi que le domaine intracellulaire de l'APP, mais pas les APP-CTF[réf. à confirmer][16], [17].
Notes et références
- Thébaud B, Stewart DJ, Exosomes: Cell garbage can, therapeutic carrier, or trojan horse?, Circulation, 2012;126:2553-2555
- Harding C, Heuser J, Stahl P, Receptor-mediated endocytosis of transferrin and recycling of the transferrin receptor in rat reticulocytes, J Cell Biol, 1983;97:329–339
- (en) Clotilde Théry, Laurence Zitvogel et Sebastian Amigorena, « Exosomes: composition, biogenesis and function », Nature Reviews Immunology, vol. 2, no 8, , p. 569–579 (ISSN 1474-1741, DOI 10.1038/nri855, lire en ligne, consulté le )
- Caby MP, Lankar D, Vincendeau-Scherrer C, Raposo G, Bonnerot C, Exosomal-like vesicles are present in human blood plasma, Int Immunol, 2005;17:879–887
- Valadi H, Ekström K, Bossios A, Sjöstrand M, Lee JJ, Lötvall JO, Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells, Nat Cell Biol, 2007;9:654–659
- Raposo G, Nijman HW, Stoorvogel W et al. B lymphocytes secrete antigen-presenting vesicles, J Exp Med, 1996;183:1161–1172
- Meckes DG Jr, Shair KH, Marquitz AR, Kung CP, Edwards RH, Raab-Traub N, Human tumor virus utilizes exosomes for intercellular communication, Proc Natl Acad Sci U S A, 2010;107:20370–20375
- Rajendran L, Honsho M, Zahn TR et al. Alzheimer's disease beta-amyloid peptides are released in association with exosomes, Proc Natl Acad Sci U S A, 2006;103:11172–11177
- Lee C, Mitsialis SA, Aslam M et al. Exosomes mediate the cytoprotective action of mesenchymal stromal cells on hypoxia-induced pulmonary hypertension, Circulation, 2012;126:2601–2611
- (en) Sushrut Kamerkar, Valerie S. LeBleu, Hikaru Sugimoto et Sujuan Yang, « Exosomes facilitate therapeutic targeting of oncogenic KRAS in pancreatic cancer », Nature, (ISSN 1476-4687, DOI 10.1038/nature22341, lire en ligne, consulté le )
- (en) Emily Mullin, « Scientists are genetically engineering the body’s natural nanoparticles to fight pancreatic cancer », MIT Technology Review, (lire en ligne, consulté le )
- Clotilde Théry, Matias Ostrowski et Ingrid S. Zeelenberg, « Des vésicules sécrétées in vivo permettent d’améliorer la réponse immune anti-tumorale », médecine/sciences, vol. 24, nos 6-7, , p. 581–583 (ISSN 0767-0974 et 1958-5381, DOI 10.1051/medsci/20082467581, lire en ligne, consulté le )
- Johnstone RM, Adam M, Hammond JR, Orr L, Turbide C, Vesical formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes), J Biol Chem, 1987;262:9412–9420
- Lamparski HG, Metha-Damani A, Yao JY et al. Production and characterization of clinical grade exosomes derived from dendritic cells, J Immunol Methods, 2002;270:211–226
- Clayton A, Court J, Navabi H et al. Analysis of antigen presenting cell derived exosomes, based on immune-magnetic isolation and flow cytometry, J Immunol Methods, 2001;247:163–174
- Miranda, A.M., Lasiecka, Z.M., Xu, Y. et al. Neuronal lysosomal dysfunction releases exosomes harboring APP C-terminal fragments and unique lipid signatures. Nat Commun 9, 291 (2018). https://doi.org/10.1038/s41467-017-02533-w
- Vingtdeux, V. et al. Alkalizing drugs induce accumulation of amyloid precursor protein by-products in luminal vesicles of multivesicular bodies. J. Biol. Chem. 282, 18197–18205 (2007) lire en ligne « We showed recently that the amyloid intracellular domain (AICD), which is released by γ-secretase cleavage of APP C-terminal fragments (CTFs), is strongly increased in cells treated with alkalizing drugs[…]We demonstrate that APP, APP-CTFs, and AICD are integrated and secreted within exosomes in differentiated neuroblastoma and primary neuronal culture cells. Together with recent data showing that amyloid- is also found in exosomes, our data show that multivesicular bodies are essential organelles for APP metabolism and that all APP metabolites can be secreted in the extracellular space ».
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Exosom (Vesikel) » (voir la liste des auteurs).
- Portail de la biologie cellulaire et moléculaire
- Portail de la médecine