FeMoco
Le FeMoco, ou cofacteur FeMo, est le principal cofacteur de la nitrogénase, enzyme qui catalyse la conversion des molécules d'azote atmosphérique N2 en ammoniac NH3 par le processus connu sous le nom de fixation de l'azote. Il a pour formule chimique Fe7MoS9C et contient du soufre, du fer, du molybdène et du carbone.
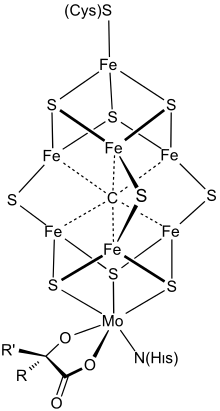
Structure
Le cofacteur FeMo est un cluster de composition Fe7MoS9C. Ce grand cluster peut être considéré comme composé d'une unité Fe4S3 (dérivée du sulfure de fer(III) Fe2S3) et d'une unité MoFe3S3. Les deux unités sont liées par trois ligands sulfure pontants. Un atome de fer est lié à l'apoprotéine par un résidu de cystéine. Il est également lié à trois ligands sulfure, d'où une géométrie moléculaire tétraédrique. Les six centres fer supplémentaires dans le cluster sont chacun liés à trois ligands sulfure et définissent une géométrie prismatique trigonale autour d'un carbure central. L'atome de molybdène est lié à trois ligands sulfure et à la protéine par le groupe imidazole d'un résidu d'histidine. Un cofacteur d'homocitrate bidentate est également lié à l'atome de molybdène, ce qui conduit à une géométrie octaédrique[1]. L'analyse cristallographique de la protéine MoFe avait permis de proposer une géométrie pour le FeMoco, qui a été confirmée par des études EXAFS[2],[3]. La longueur des liaisons Fe–S, Fe–Fe et Fe–Mo a été déterminée à 232 pm, 264 pm et 273 pm respectivement[3].
Propriétés électroniques
D'après l'analyse par résonance paramagnétique électronique (RPE), l'état de spin du cofacteur FeMo au repos est de S = 3⁄2. Lors d'une réduction par un électron, le cofacteur devient silencieux par RPE. Comprendre le processus dans lequel un électron est transféré dans l'adduit protéique permet d'affiner le modèle cinétique du cofacteur FeMo[4]. Les calculs par théorie de la fonctionnelle de la densité suggèrent que les états d'oxydation formels sont MoIV-2FeII-5FeIII-C4−-H+, tandis que les états d'oxydation réels n'ont pas été confirmés expérimentalement[5].
Biosynthèse
La biosynthèse du FeMoco est un processus compliqué qui nécessite plusieurs produits des gènes Nif (en), en particulier ceux de nifS, nifQ, nifB, nifE, nifN, nifV, nifH, nifD et nifK, exprimés sous forme des protéines NifS, NifU, etc. On pense que l'assemblage du FeMoco est amorcée par NifS et NifU qui mobilisent le fer et le sulfure en petits fragments Fe–S. Ces fragments sont transférés sur l'échafaudage NifB et disposés dans un cluster Fe7MoS9C avant le transfert vers la protéine NifEN, codée par les gènes nifE et nifN, et réarrangés avant d'être apportés à la protéine MoFe[6]. Plusieurs autres facteurs contribuent à la biosynthèse. Par exemple, NifV est l'homocitrate synthase qui fournit l'homocitrate au FeMoco. On pense que NifV est impliqué dans le stockage et/ou la mobilisation du molybdène. La protéine Fe est le donneur d'électrons de la protéine MoFe. Ces facteurs biosynthétiques ont été élucidés et caractérisés avec leurs fonctions et séquences exactes, confirmées par des analyses biochimiques, spectroscopiques et structurelles.
Isolation
L'isolation du FeMoco de la nitrogénase est réalisée par sédimentation centrifuge de la nitrogénase pour donner la protéine MoFe et la protéine Fe. Le FeMoco est extrait en traitant la protéine MoFe avec des acides. La première extraction est obtenue avec du N,N-diméthylformamide et la seconde par un mélange de N-méthylformamide et d'hydrogénophosphate de sodium Na2HPO4 avant sédimentation finale par centrifugation[7].
Nature et rôle de l'atome central du cofacteur
Les trois protéines qui jouent un rôle direct dans la synthèse du cluster sont NifH, NifEN et NifB. La protéine NifB est responsable de l'assemblage du complexe Fe-S du cofacteur, selon un processus qui implique d'emboîter deux centres [4Fe-4S]. Cette protéine appartient à la superfamille dite à radical SAM, c'est-à-dire qui utilisent un radical désoxyadénosyle (en) issu du clivage de la S-adénosylméthionine (SAM) comme intermédiaire réactionnel. Lors de la biosynthèse du cofacteur FeMo, NifB et son cofacteur SAM sont directement impliqués dans l'insertion d'un atome de carbone au centre du complexe Fe-S. Un équivalent de la SAM cède un groupe méthyle, qui donne le carbure interstitiel du cluster. Le groupe méthyle de la SAM est mobilisé par élimination radicalaire d'un atome d'hydrogène par un radical 5’-désoxyadénosine (5’-dA·). On pense qu'il se forme un radical transitoire CH2• qui est par la suite incorporé dans le cluster métallique pour former une espèce de carbure de Fe6. Cet atome de carbone interstitiel reste associé au FeMoco après insertion dans la nitrogénase[8]. La nature de l'élément chimique a été confirmée par marquage au carbone 13 par résonance paramagnétique électronique pulsée (en)[9]. La présence d'un atome central dans le FeMoco a été par ailleurs confirmée par diffactométrie aux rayons X, la nature de cet atome étant par ailleurs confirmée comme étant du carbone par l'observation de la transition électronique carbone-fer 2p→1s[10]. La cristallographie aux rayons X a montré que le carbone maintient la structure rigide du FeMoco lorsqu'il n'est pas sous forme catalytique, ce qui aide à comprendre la réactivité de la nitrogénase.
Notes et références
- (en) G. J. Leigh, Structure and Spectroscopic Properties of Metallo-sulfur Clusters Nitrogen Fixation at the Millennium, chapitre 5, Elsevier Science, Amsterdam, 2002, p. 209-210. (ISBN 978-0444509659)
- (en) Jongsun Kim et D. C. Rees, « Structural Models for the Metal Centers in the Nitrogenase Molybdenum-Iron Protein », Science, vol. 257, no 5077, , p. 1677-1682 (PMID 1529354, DOI 10.1126/science.1529354, Bibcode 1992Sci...257.1677K, lire en ligne)
- (en) R. M. Roat-Malone, « Chapitre 6 : MoFe Protein Structure », Bioinorganic Chemistry, John Wiley, Hoboken, New Jersey, 2002, p. 253-254. (ISBN 978-0471265337)
- (en) Barbara K. Burgess et David J. Lowe, « Mechanism of Molybdenum Nitrogenase », Chemical Reviews, vol. 96, no 7, , p. 2983-3012 (PMID 11848849, DOI 10.1021/cr950055x, lire en ligne)
- (en) Travis V. Harris et Robert K. Szilagyi, « Comparative Assessment of the Composition and Charge State of Nitrogenase FeMo-Cofactor », Inorganic Chemistry, vol. 50, no 11, , p. 4811-4824 (PMID 21545160, PMCID 3105220, DOI 10.1021/ic102446n, lire en ligne)
- (en) Yilin Hu et Markus W. Ribbe, « Biosynthesis of nitrogenase FeMoco », Coordination Chemistry Reviews, vol. 255, nos 9-10, , p. 1218-1224 (PMID 21503270, PMCID 3077758, DOI 10.1016/j.ccr.2010.11.018, lire en ligne)
- (en) Barbara K. Burgess, Deloria B. Jacobs et Edward I. Stiefel, « Large-scale purification of high activity Azotobacter vinelandii nitrogenase », Biochimica et Biophysica Acta (BBA) - Enzymology, vol. 614, no 1, , p. 196-209 (PMID 6930977, DOI 10.1016/0005-2744(80)90180-1, lire en ligne)
- (en) Amie K. Boal et Amy C. Rosenzweig, « A Radical Route for Nitrogenase Carbide Insertion », Science, vol. 337, no 6102, , p. 1617-1618 (PMID 23019640, DOI 10.1126/science.1229088, Bibcode 2012Sci...337.1617B, S2CID 98713038, lire en ligne)
- (en) S. Ramaswamy, « One Atom Makes All the Difference », Science, vol. 334, no 6058, , p. 914-915 (PMID 22096179, DOI 10.1126/science.1215283, Bibcode 2011Sci...334..914R, S2CID 206538126, lire en ligne)
- (en) Oliver Einsle, « Nitrogenase FeMo cofactor: an atomic structure in three simple steps », JBIC Journal of Biological Inorganic Chemistry, vol. 19, no 6, , p. 737-745 (PMID 24557709, DOI 10.1007/s00775-014-1116-7, S2CID 17069669, lire en ligne)
- Portail de la biochimie