Fructose-1,6-bisphosphate
Le fructose-1,6-bisphosphate (Fru-1,6-BP), souvent appelé fructose-1,6-diphosphate[2], est un composé organique présent dans de très nombreuses cellules vivantes sous forme de l'isomère β-D-fructose-1,6-bisphosphate, le seul qui soit biologiquement actif. L'essentiel du glucose et du fructose métabolisé par la cellule est converti, à un moment ou à un autre, en Fru-1,6-BP.
| β-D-fructose-1,6-bisphosphate | |
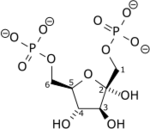  Structure du β-D-fructose-1,6-bisphosphate (à droite : en projection de Haworth) |
|
| Identification | |
|---|---|
| Nom UICPA | acide [(2R,3S,4R,5R)-2,3,4- trihydroxy-5-(phosphonooxyméthyl) oxolan-2-yl]méthoxyphosphonique |
| Synonymes |
Fru-1,6-BP, |
| No CAS | |
| No ECHA | 100.006.985 |
| No CE | 207-683-6 |
| PubChem | 10267 |
| ChEBI | 32966 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C6H14O12P2 [Isomères] |
| Masse molaire[1] | 340,115 7 ± 0,009 4 g/mol C 21,19 %, H 4,15 %, O 56,45 %, P 18,21 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Le β-D-fructose-1,6-bisphosphate est un métabolite situé au carrefour de plusieurs voies métaboliques, notamment la glycolyse et la gluconéogenèse ; c'est également un intermédiaire de la biosynthèse du fructose et du mannose.
Rôle dans la glycolyse
Biosynthèse

+ ATP ADP + H+ + 
Fru-6-P Fru-1,6-BP Phosphofructokinase-1 – EC
Le β-D-fructose-6-phosphate (Fru-6-P) produit au cours de la glycolyse est phosphorylé en β-D-fructose-1,6-bisphosphate (Fru-1,6-BP) par la phosphofructokinase-1 à partir d'une molécule d'ATP, convertie en ADP. Cette consommation d'énergie rend cette étape irréversible, et constitue un point de régulation majeur de la vitesse de la glycolyse. Un cation Mg2+ intervient comme cofacteur.
Il existe, essentiellement chez des organismes autres que les animaux, des enzymes différentes capables de phosphoryler le Fru-6-P à partir de pyrophosphate inorganique au lieu d'ATP. C'est le cas de la diphosphate fructose-6-phosphate 1-phosphotransférase (PFP), qu'on trouve chez de nombreux végétaux, certaines bactéries, des archées et des protistes. De rares archées possèdent une variante de la phosphofructokinase utilisant, cette fois, de l'ADP et non de l'ATP.
Dégradation

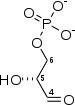
+ 
Fru-1,6-BP G3P DHAP Fructose-bisphosphate aldolase – EC
Le β-D-fructose-1,6-bisphosphate est clivé par une lyase, la fructose-bisphosphate aldolase, en D-glycéraldéhyde-3-phosphate (G3P) et dihydroxyacétone phosphate (DHAP) ; cette dernière molécule est alors isomérisée en G3P par la triose-phosphate isomérase. Ainsi, chaque molécule de Fru-1,6-BP donne en fin de compte deux molécules de G3P.
Il existe deux classes d'aldolases susceptibles de cliver le Fru-1,6-BP : la classe I chez les animaux et les végétaux, et la classe II chez les mycètes et les bactéries ; ces deux classes d'enzymes utilisent des mécanismes différents pour cliver ce cétose.
Régulation du flux glycolytique
Le β-D-fructose-1,6-bisphosphate est l'un des régulateurs allostériques de l'activité de la phosphofructokinase-1, l'enzyme qui catalyse sa production au cours de la glycolyse (inhibition par le produit de réaction). Il agit comme un régulateur cybernétique par rétroaction négative : l'accumulation de Fru-1,6-BP signifie qu'il n'est pas consommé par les étapes en aval de la voie, et que donc le besoin en énergie est moindre, qu'il faut donc en quelque sorte ralentir la glycolyse.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Résultat de la requête « fructose » sur le dictionnaire de l'académie nationale de médecine de France. Stricto sensu, « bisphosphate » fait référence à deux groupes phosphate –OPO32− distincts sur une même molécule, tandis que « diphosphate » se réfère à un groupe pyrophosphate –OP2O63− unique.
- Portail de la biochimie
- Portail de la chimie