Glandes segmentaires
Les glandes segmentaires des araignées sont des organes sécréteurs pairs et symétriques situés dans le prosome des araignées, à la base des appendices. La plus importante est la glande rétrognathocoxale. Il s'agit de glandules tégumentaires, décelables par les seules coupes histologiques (C.H.), retrouvées en microscopie électronique à transmission (M.E.T.) et en rapport avec la métamérisation originelle du céphalothorax ou prosoma des Araignées.
Introduction
Tout un ensemble de petits organes glandulaires exocrines apparemment métamérisés a été mis en évidence par l'histologie dans le prosoma (céphalothorax) des Araignées, initialement chez Metepeira incrassata et Leptoneta microphtalma [1] et observé plus tard chez d'autres familles de familles d'araignées différentes : Araneidae, Linyphiidae, Theridiidae, Oecobiidae[2],[3].
Ces organes sécréteurs tégumentaires, sont pairs, symétriques, se situant à la base de divers appendices, avérés ou présumés (chélicères, rostre, gnathocoxae), ainsi qu’au niveau des hanches de la première paire de pattes (Metepeira).
Cette dernière localisation, où elles s’associent étroitement avec les glandes coxales proprement dites, et leur emplacement basométamérique, plaidaient initialement en faveur de « glandes coxales sensu lato » ou « modifiées » [1],[3], conception d’autant plus justifiée qu’à première vue et au faible grossissement, elles se présentaient comme des groupes de « vésicules », régulières ou sinueuses, baignant dans un espace hémolymphatique sous le tégument ventral et donc très évocatrices de saccules coxaux.
Un peu plus tard[2], et faute de termes pouvant traduire leur(s) fonction(s), encore inconnue(s), elles ont été désignées sous le nom de « glandes épidermiques pluricellulaires segmentaires ». L’ultrastructure de leur forme rétrognathocoxale[4] permet de rapprocher la plupart d’entre elles des glandes épidermiques à adénocytes de classe 3.
Ces organes, en particulier le dernier, semblent bien exister chez la plupart des Araignées étudiées et y présenter, sur fond de structure commune, un développement d’une extrême variabilité, suivant les familles et même les genres.
Localisation et rapports anatomiques
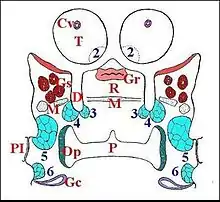
La présence des glandes segmentaires est seulement révélée par les coupes histologiques en série qui montrent leurs cellules constitutives, leurs canaux conducteurs traversant la cuticule, et confirmée par des orifices excréteurs visibles au microscope électronique à balayage (M.E.B.) dans les membranes d’insertion appendiculaire. Le genre américain Metepeira (Araneidae : Araneinae), en particulier son espèce Metepeira incrassata et, à un degré moindre, le taxon antillais Metepeira vaurieorum récolté en Guadeloupe[5] et Martinique[6], est un matériel de choix pour leur étude. Elles y sont en effet particulièrement bien développées[1],[3] et surtout apparentes dans les coupes histologiques horizontales (Schéma 1). L’araignée souterraine Leptoneta microphtalma (Leptonetidae), en possède également de fort bien visibles[1] ainsi qu' Uroctea durandi (Oecobiidae)[2]. Fondamentalement, elles sont au nombre de 5 paires, réparties dans les zones pré et post-orales du prosoma (Schéma 1).
La première paire (1), non visible dans le schéma 1, n’a été observée jusqu’ici que chez Metepeira incrassata. La plus antérieure et la plus discrète est placée devant les glandes venimeuses et siège au fond de la dépression séparant les paturons (tiges chélicériennes) du surplomb oculaire (Fig.2).
La deuxième (2), bien visible aussi chez Leptoneta microphtalma, se loge sous le sillon rostrochélicérien, au niveau de la base du paturon (Fig.3,4).
La troisième (3) est située dans la partie postéro-supérieure et latérale du rostre (Fig.5), près de son muscle transversal et s’ouvre sur le versant interne de la dépression rostrognathocoxale. Son bord postérieur entre en rapport avec le bord antérieur de l’ «organe pharyngien» auquel Millot (1936)[7] attribuait un rôle sensoriel gustatif.
La quatrième paire (4) , contiguë à la précédente, siège dans la partie postéro-interne de la lame maxillaire (gnathocoxa) (Fig.2) et s’ouvre sur le versant externe de la dépression rostrognathocoxale . Toutes deux peuvent contracter des rapports de voisinage étroit avec le pharynx, les glandes salivaires ou gnathocoxales, des nerfs et des fibres musculaires striées (Fig.5).
La cinquième paire (5) est la plus postérieure, celle qui atteint le plus grand volume et est presque toujours mieux visible que les autres chez la plupart des Araignées (Fig.2). Elle s’ouvre dans ou contre la membrane souple unissant la gnathocoxa au bord antérieur du sternum et à la hanche (coxa) de P I, première patte ambulatoire. Ce débouché n’a été observé au microscope électronique à balayage que chez Leptoneta microphthalma (Fig.6).
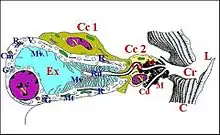
Il s’agit d’une formation anatomique paire, symétrique, logée dans la partie ventro-latérale du prosoma (Fig.7) immédiatement derrière la gnathocoxa, d'où son qualificatif de rétrognathocoxale. Baignant dans un sinus hémolymphatique, elle entre en rapport avec la masse nerveuse sous-œsophagienne (ganglions), des diverticules intestinaux, des muscles, du tissu réticulé (Fig. 4, 6 à 11), l’ «organe pharyngien» et les glandes gnathocoxales dites sexuelles chez les mâles de certaines Linyphiidae (Fig.10).
Une sixième paire (6) est présente chez Metepeira incrassata à la base de P I et s'y associe au canal et à l'ouverture de la glande coxale proprement dite (Schéma 1, Fig.8).
 Fig.1 - Couple de Metepeira incrassata sur une nacelle de soie de la toile communautaire. F, femelle - M, mâle. Fortin de las Flores, Mexique.
Fig.1 - Couple de Metepeira incrassata sur une nacelle de soie de la toile communautaire. F, femelle - M, mâle. Fortin de las Flores, Mexique. Fig.2 - Metepeira incrassata : première paire (1), au-dessous des yeux.C, cuticule ; Ed, épiderme pigmenté ; Ex, cavité extracellulaire (réservoir) contenant le canalicule récepteur (flèches rouges ) ; N, noyau d'adénocyte.
Fig.2 - Metepeira incrassata : première paire (1), au-dessous des yeux.C, cuticule ; Ed, épiderme pigmenté ; Ex, cavité extracellulaire (réservoir) contenant le canalicule récepteur (flèches rouges ) ; N, noyau d'adénocyte. Fig.3 - Metepeira incrassata : deuxième paire (2) à la, base d'une chélicère. C, cuticule ; Dc, cellule canaliculaire ; Ex, cavité extracellulaire (réservoir) N, noyau d'adénocyte. Flèches rouges : canalicules excréteurs.
Fig.3 - Metepeira incrassata : deuxième paire (2) à la, base d'une chélicère. C, cuticule ; Dc, cellule canaliculaire ; Ex, cavité extracellulaire (réservoir) N, noyau d'adénocyte. Flèches rouges : canalicules excréteurs. Fig.4 - Metepeira incrassata, deuxième paire (2), autre vue, détails. Dc, cellule canaliculaire ; Ex, cavité extracellulaire (réservoir) contenant le canalicule récepteur (flèches rouges ) et bordée de microvilli (Mv) ; N, noyau d'adénocyte.
Fig.4 - Metepeira incrassata, deuxième paire (2), autre vue, détails. Dc, cellule canaliculaire ; Ex, cavité extracellulaire (réservoir) contenant le canalicule récepteur (flèches rouges ) et bordée de microvilli (Mv) ; N, noyau d'adénocyte.
Structure
Leur structure d’ensemble paraît assez homogène en microscopie photonique, quelle que soit la localisation. Les glandes segmentaires, du moins 3, 4 et 5 se présentent comme de petits organes faisant partie de l’épiderme ventral qu’ils exhaussent en « grappe » ou « coussinet » plus ou moins saillant. D’aspect compact ou alvéolaire, en « nid d’abeille », ils mesurent jusqu’à 130 µm de diamètre et 80 µm d’épaisseur, surtout dans le cas de la paire rétrognathocoxale (5), et baignent dans un espace hémolymphatique (Fig.8 à 13).
Histologie
La structure histologique de ces organes exocrines paraît assez uniforme. En effet , chacun d’eux est constitué par un ensemble de grosses cellules glandulaires ou adénocytes, de cellules « satellites » et de canalicules excréteurs ayant toujours le même aspect, quelle que soit la localisation considérée. Les adénocytes sont des éléments réguliers, très allongés (jusqu’à 80 µm chez Uroctea durandi) plus ou moins prismatiques, en « palissade », ou ayant l’aspect de « vésicules » piriformes, ovoïdes, parfois sinueuses, dont les extrémité apicales s’effilent en convergeant vers la cuticule sus-jacente. Le quart basal renferme un gros noyau vésiculeux, à nucléole très apparent (Fig.13) et à chromatine marginale. Le cytoplasme est acidophile, vacuolisé et semble contenir, dans ses ¾ supérieurs, une cavité en « réservoir » oblong avec de vagues stries marginales ou dilaté, alors responsable de l’aspect « vésiculaire ». Dans cette cavité, qui est en fait extracellulaire et parfois très dilatée (Fig.12,13), se loge un grêle canalicule acidophile, plus ou moins pelotonné sur lui-même et se dirigeant vers la cuticule au-dessus de l'apex adénocytaire (Fig.14,20 ). Les cellules « satellites » ou canaliculaires sont logées entre les adénocytes qu’elles paraissent soutenir. Elles sont individualisées par un petit noyau oblong, à chromatine dense (Fig.13). Leur cytoplasme est très aplati et peu visible.Les canalicules excréteurs sont seulement perceptibles sous la cuticule, au point de convergence des apex adénocytaires dont ils se sont dégagés, et en groupe plus ou moins serré (Fig.13). Ces conduits traversent ensuite la cuticule . Elle s’invagine à leur niveau pour former une crypte au fond de laquelle s’ouvrent lespores excréteurs et que surplombe une languette en auvent masquant ces orifices (Fig.12,13).
Ultrastructure
La structure fine n’a pu être explorée que dans le seul cas de la paire rétrognathocoxale (5) car elle est la plus volumineuse, la plus accessible et, semble-t-il, la plus constante.Le matériel d'étude, Leptyphantes sanctivincentii (Simon) (Linyphiidae) (grotte de Cailhol, Minervois : Ouest de l’Hérault, France), a examiné en M.E.T. au Laboratoire souterrain de Moulis. Les recherches montrent que cellules et canaux sont réunis en unités anatomo- fonctionnelles toutes semblables. Chacune de ces unités se compose d’une cellule sécrétrice ou adénocyte et d’un appareil cuticulaire avec deux cellules satellites (canaliculaires) non sécrétrices (Schéma 2).
Adénocyte
Il s’agit d’une grosse cellule allongée, rétrécie dans sa partie apicale, nettement plus large dans la basale et longue d’environ 40 µm. Ses contours sont réguliers car elle ne s’engrène pas sur les autres adénocytes et les cellules satellites (Schéma 2). Son pôle basal est convexe, non indenté par des replis du plasmalemme et repose sur une lame fibrillaire très mince l’isolant du sinus hémolymphatique. En revanche, son pôle apical présente une grande invagination de l' espace extracellulaire en « cul de sac » occupant le grand axe de l'adénocyte (Schéma 2, Fig.), et renferme un canalicule récepteur en position centrale (Schéma 2 ; Fig.14). Cette cavité correspond bien à celle des coupes histologiques (Fig.14,24), est exiguë dans la partie rétrécie («réservoir») où se loge le canalicule (Schéma 2, Fig.12,13) mais s’élargit beaucoup dans la partie basale évasée («vésicule») (Fig.15). Elle est bordée par des microvillosités, responsables de la striation vue en microscopie photonique, longues, grêles, flexueuses et contenant des microfilaments longitudinaux disposés en couronne périphérique. Les microvilli de la partie basale sont assez peu nombreuses, irrégulières, dispersées, inégalement espacées et semblent flotter dans la cavité extracellulaire (Fig.15).
En revanche, les microvilli apicales sont beaucoup plus nombreuses, régulières, très serrées, souvent incurvées et adoptent alors une disposition « tourbillonnante» autour du canalicule. Elles prennent contact avec ce dernier par leur extrémité libre qu’occupe une densification osmiophile (hémidesmosome) due à la convergence des microfilaments qui s’y reploient et semblent en quelque sorte l’ « amarrer » au cytoplasme pour le maintenir en place (Schéma 2, Fig.). Le noyau (Fig.17,18,19) siège dans le pôle basal, est sphérique et d'assez grande taille (8 µm). Il renferme un nucléole d’aspect réticulé (Fig.19) et une chromatine finement granuleuse, condensée en rares blocs périphériques, tendant surtout à se disperser dans le nucléoplasme. Dans les coupes tangentielles à son enveloppe, il montre aussi des pores nucléaires de fréquence moyenne, avec un canal central parfois discernable (Fig.18,19). Le réticulum endoplasmique est abondant et granuleux. Il se compose de quelques groupes de cisternae aplaties, plus ou moins sinueuses et surtout, de vésicules de taille très variable, portant quelques ribosomes à leur surface et renfermant un matériel granuleux peu dense aux électrons qu’elles vont déverser par exocytose dans la cavité extracellulaire entre les pieds des microvilli (Fig.)
L’appareil de Golgi se compose d’un grand nombre de petits dictyosomes siégeant dans la région basale au voisinage du noyau. Chacun d’eux est formé par l’empilement de quelques saccules qu’entoure un essaim de petites vésicules (Fig.). Ces dernières ont un contenu osmiophile et paraissent fusionner en granules sphériques, migrant vers le pourtour de la cavité extracellulaire où ils se déchargent encore par exocytose, comme les vésicules du réticulum endoplasmique. Certains des saccules golgiens subissent une dilatation importante et renferment alors un matériel d’aspect lamellaire (Fig., flèches). Le chondriome est formé par des mitochondries allongées, légèrement flexueuses, pourvues de fines crêtes parallèles et se dispersant dans tout le cytoplasme. Ce dernier renferme aussi d’autres organites : ribosomes libres (polysomes), microfilaments parallèles au grand axe de la cellule, quelques lysosomes secondaires et surtout, des inclusions feuilletées particulières issues du matériel lamellaire des saccules golgiens. Ces inclusions sont des masses arrondies, compactes ou excavées, formées par un ensemble de lamelles onduleuses très fines, superposées concentriquement et présentant ainsi un aspect de corps « myéloïde » ainsi nommé car il évoque une gaine de myéline (Fig.16,17,18). Elles se retrouvent parfois dans la cavité extracellulaire après extrusion (Fig.17).
Appareil cuticulaire
Il comporte un canalicule récepteur plongeant dans la cavité extracellulaire de l’adénocyte (Schéma, Fig.16,21) et le canalicule conducteur entouré par ses cellules satellites (enveloppes ou canaliculaires) (Schéma 2, Fig.21,22), tous deux ainsi nommés d’après la terminologie que Quennedey et Brossut (1975) ont adoptée pour les glandes d’ Insectes.
Canalicule récepteur
Il est entièrement logé dans la cavité extra-cellulaire de l'adénocyte, présente quelques sinuosités et se termine en cul-de-sac.
Sa paroi est formée par deux couches vraisemblablement épicuticulaires : l’une externe, épaisse, ajourée, spongieuse, d’aspect réticulé ; l’autre interne, beaucoup plus mince, homogène, dense et presque entièrement fenestrée (Fig.20). Les microvillosités adénocytaires apicales viennent s' ancrer sur la couche externe par des hémidesmosomes (Fig.21 : flèches), l'amarrant ainsi à la cellule sécrétrice, tandis que celles de la partie basale en restent séparées (Schéma 2).
La lumière étroite peut contenir des vésicules ou des lamelles de corps myéloïdes en provenance de la cavité extracellulaire (Fig.20).
Canalicule conducteur
Prolongement du récepteur, il a une paroi homogène, fomée d’épicuticule continue et faisant suite à la couche interne du précédent dont l’épaisseur triple brusquement (Schéma, Fig.21,22).
Il est d’abord inclus dans un «manchon» que forme l’adénocyte en se rebroussant à l’apex de sa cavité extracellulaire, ainsi fermée de toutes parts (Schéma 2).
Il s’engage ensuite dans deux cellules-enveloppes en y décrivant un trajet sinueux. Sa lumière est ovalaire en section transversale et présente un calibre régulier (diamètre maximum : 0,3 µm).
En revanche, l’épaisseur de sa paroi, d’abord réduite au niveau de la première cellule canalaire, augmente considérablement dans la seconde. Cette paroi reste lisse autour de la lumière mais est remaniée du côté cytoplasmique par l’adjonction remarquable d’un matériel abondant, très dense, osmiophile, distribué en mottes arrondies, plus ou moins confluentes, conglobées et qui le bossellent irrégulièrement (Fig. 21, 22, Schéma 2). Ce matériel peut être assimilé à de la mésocuticule car il semble se colorer en rouge par la méthode de Mallory dans les coupes histologiques.
Le canalicule conducteur et ses homologues des unités adjacentes convergent tous au fond d’une dépression ou crypte cuticulaire que surplombe bien une languette en auvent de même nature. Le fond de cette crypte est réduit à de l’épicuticule, l’endocuticule s’interrompant brusquement sur ses parois latérales.La crypte et sa languette peuvent être repérées au microscope à balayage sur la surface tégumentaire (Fig. 5).
2.3 - Cellules canaliculaires ou cellules-enveloppes
Les deux cellules canaliculaires faisant partie de chaque unité fonctionnelle peuvent être qualifiées de proximale et distale. Elles accompagnent le canalicule conducteur depuis l'adénocyte jusqu'à sa terminaison.
La cellule proximale repose directement sur l'adénocyte, lui est unie par un desmosome zonaire et des jonctions septées mais le sépare d'une grande partie des autres cellules sécrétrices en émettant des expansions cytoplasmiques aplaties.
La cellule distale surmonte la précédente et englobe le conduit jusqu'à son ouverture dans la crypte cuticulaire (Schéma 2). Elle entre en rapport avec les cellules épidermiques voisines.
Ces deux cellules canaliculaires sont très allongées et ont des contours irréguliers.
Leur noyau, seul visible dans les coupes histologiques, se siitue près du canalicule conducteur (cellule distale) (Fig.22) ou, au contraire, s'en éloigne beaucoup (cellule proximale)(Schéma 2). Généralement ovoïde, il peut être aussi incurvé ou anguleux. Sa chromatine abondante forme des mottes périphériques compactes et son nucléole est également très dense.
Le cytoplasme est réduit, surtout dans le cas de la cellule distale, et dépourvu de toute activité sécrétoire. Il contient quelques vésicules de réticulum, des ribosomes libres, des microtubules et des microfilaments parallèles au grand axe cellulaire.
Chaque cellule entoure le conduit comme un manchon et se referme sur elle-même, déterminant ainsi l'apparition d'un méso. Ce dernier est complété par un desmosome qui se situe à un niveau variable entre les faces affrontées de la cellule canaliculaire (Fig. 22).
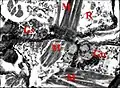 Fig.5 - Metepeira incrassata, glandes rostrognathocoxales des troisième et quatrième paires (3,4) . Gn, gnathocoxe, glandes salivaires ; Gs, glandes segmentaires contiguës 3 et 4 ; M, muscles striés ; R, rostre
Fig.5 - Metepeira incrassata, glandes rostrognathocoxales des troisième et quatrième paires (3,4) . Gn, gnathocoxe, glandes salivaires ; Gs, glandes segmentaires contiguës 3 et 4 ; M, muscles striés ; R, rostre Fig.6 - Leptoneta microphtalma, orifice de la glande rétrognathocoxale dans une crypte (Cy), surmontée d'une languette (flèche), entre le sternum (S), la gnathocoxa (Cn) et la hanche de PI (en bas et à gauche).
Fig.6 - Leptoneta microphtalma, orifice de la glande rétrognathocoxale dans une crypte (Cy), surmontée d'une languette (flèche), entre le sternum (S), la gnathocoxa (Cn) et la hanche de PI (en bas et à gauche).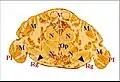 Fig.7 - Leptyphantes sanctivincentii, femelle : coupe transversale du prosoma. Localisation de la 5e paire. M, muscles ; N, masse nerveuse ; Op, œsophage ; PI, coxae premières pattes ; Rg et flèches, glandes rétrognathocoxales (5) ; V, glandes à venin
Fig.7 - Leptyphantes sanctivincentii, femelle : coupe transversale du prosoma. Localisation de la 5e paire. M, muscles ; N, masse nerveuse ; Op, œsophage ; PI, coxae premières pattes ; Rg et flèches, glandes rétrognathocoxales (5) ; V, glandes à venin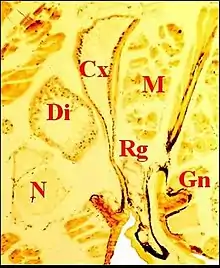 Fig. 8 - Metepeira incrassata : 6e paire (6). Cx, glande coxale proprement dite ; D, son canal ; Di, diverticule intestinal ; Gn, gnathocoxa ; M, muscles
Fig. 8 - Metepeira incrassata : 6e paire (6). Cx, glande coxale proprement dite ; D, son canal ; Di, diverticule intestinal ; Gn, gnathocoxa ; M, muscles Fig.9 - Metepeira incrassata, glande rétrognathocoxale 1
Fig.9 - Metepeira incrassata, glande rétrognathocoxale 1 Fig.10 - Metepeira incrassata, glande rétrognathocoxale 2
Fig.10 - Metepeira incrassata, glande rétrognathocoxale 2 Fig.11 - Leptyphantes sanctivincentii, mâle, glande rétrognathocoxale
Fig.11 - Leptyphantes sanctivincentii, mâle, glande rétrognathocoxale
Variations
Recherchée seule dans un grand nombre de familles, la glande segmentaire rétrognathocoxale peut être très réduite (Agelenidae, Pisauridae). Ses adénocytes sont alors logés entièrement dans l’épaisseur de l’épiderme qu’ils ne bossellent pas et tendent à se disperser entre les cellules épithéliales.
Commentaires
Point de vue anatomique
Les organes segmentaires du céphalothorax sont des glandes exocrines pluricellulaires fondamentalement semblables malgré des différences de taille, de nombre et, plus accessoirement, de forme.
Elles entrent dans le cadre des glandes tégumentaires anatomiquement définies au sens de Noirot et Quennedey (1974,1991) et constituées, si l’on en juge par l’ultrastructure de l’organe rétrognathocoxal, d’unités fonctionnelles identiques dont l’adénocyte se rattache à la classe 3 telle que les deux précédents auteurs l’ont conçue pour les insectes.
Selon toute vraisemblance, l’ultrastructure des autres glandes segmentaires prosomatiques doit être semblable à celle de l’organe rétrognathocoxal car leur aspect histologique est strictement identique.
Il est à noter que l’ «organe pharyngien » de Millot (1936)[7], voisin de la paire basirostrale (3), lui ressemble étrangement par son aspect histologique, surtout chez les Oecobiidae (Uroctea durandi) (Fig. 20, 21), et probablement aussi par sa structure fine. Cet organe, que l’on ne peut plus considérer comme sensoriel, présente en effet dans les coupes un même aspect de glande épidermique anatomiquement définie comportant des adénocytes de classe 3 avec appareil terminal, canalicules récepteur, conducteur et cellules-enveloppes ou canalaires . Certains des caractères ultrastructuraux sont particulièrement frappants dans la localisation rétrognathocoxale (5) :
- Très grande taille possible de la cavité extracellulaire en réservoir, ce qui pourrait traduire un état fonctionnel particulier et correspondrait à un stade donné du cycle sécrétoire, la même cavité devenant presque virtuelle dans d’autres étapes.
- rapports très étroits entre certaines des microvilli et le canalicule récepteur, cette cohésion pouvant empêcher des déplacements excessifs du canalicule lorsque le réservoir change de volume, et faciliter aussi un transfert de substances à partir du cytoplasme.
- richesse de l’adénocyte en reticulum endoplasmique et surtout en dictyosomes témoignant d’une activité sécrétoire intense. Ce Golgi présente un aspect particulier qui rappelle celui de la glande mandibulaire de Blaberus (Insectes Dictyoptères) (Quennedey & Brossut, 1975)[8].
- présence remarquable de corps myéloïdes (Fig.16,17,18), ici d’origine golgienne. Ces inclusions paraissent absents dans toutes les autres glandes d’ Araignées mais ont été souvent décrits chez les Insectes, dans des organes tégumentaires aussi variés que les taxons zoologiques auxquels ils appartiennent :
- la spermathèque du Thysanoure Thermobia domestica (Bitsch, 1981)[9]
- la glande labrale de l ‘Isoptère Schedorhinotermes (Quennedey, 1975)[10]
- les glandes mandibulaires et tergales des Dictyoptères Blattaria (Quennedey & Brossut, 1975 ; Brossut & al., 1975 )[8],[11]
- les glandes à phéromones du Névroptère Chrysopa perla (Wattebled & al., 1978)[12]
- les glandes défensives pygidiales des Coléoptères Carabides Brachinus crepitans (Schnepf & al., 1969[13]) et Pterostichus madidus (Forsyth, 1970[14]), du Ténébrionide Eleodes longicollis (Eisner & al., 1964)[15].
- les glandes mandibulaires de l’Hyménoptère Bombus (Stein, 1962)
- les glandes de Dufour et les glandes de marquage territorial des Hyménoptères Formicoidea (Bazire-Benazet & Zylberberg, 1979 ; Billen, 1986)[16],[17]
Ces corps (inclusions) myéloïdes ou multilamellaires pourraient avoir une fonction lysosomale et être ainsi impliqués dans l’autophagie cellulaire, mais représenter également des figures de sécrétion. Leur passage vers les canalicules récepteurs rappelle d’ailleurs l’observation de Sreng (1979) sur les glandes tergales de Blatella.
Les images particulières que crée le dépôt localisé d’un matériel dense au contact des canalicules conducteurs n’ont été observées chez aucune autre Araignée ou Insecte adulte. Tout au plus évoquent-elles certains aspects de la spermathèque en formation chez la nymphe du Coléoptère Tenebrio molitor ( Happ & Happ, 1970)[18].
La nature chimique de la sécrétion rétrognathocoxale, et donc segmentaire, est encore inconnue, l’étude ultrastructurale ne fournissant pas de renseignement décisif sur la compétence biosynthétique des adénocytes, et n’ayant d’ailleurs pas concerné.
Il s’agit vraisemblablement d’un produit complexe, peut être comme dans certaines glandes exocrines de Blattes (Brossut & Sreng, 1985)[19]. La sécrétion rétrognathocoxale de Leptyphantes paraît consister en un mélange du contenu des vésicules du réticulum, de celui – plus dense- des petites vésicules golgiennes, de vésicules réticulaires libérées in toto et de corps myéloïdes. Ces derniers, de nature lipidique ou glycoproteinique comme Noirot et Quennedey (1974, 1991)[20],[21] l’ont envisagé chez les Insectes, pourraient être beaucoup plus nombreux encore à un autre stade sécrétoire et correspondre alors à une phase de «stockage» comme dans les vésicules à phéromones du mâle de Chrysopa (Wattebled & al., 1978)[12].
Point de vue fonctionnel
Le rôle joué par la sécrétion rétrognathocoxale ne peut donner lieu qu’à des conjectures car la région prosomatique où elle est émise n’a jamais attiré l’attention des éthologistes par un trait comportemental qui la mettrait en jeu. Il en est de même pour les autres glandes segmentaires céphalothoraciques, enfouies dans des replis peu accessibles. Une fonction lubrificatrice paraît peu plausible à ce niveau. En revanche, si l’on tient compte des seuls caractères ultrastructuraux, il paraît logique d’envisager une élaboration de sémiochimiques par comparaison avec les glandes tégumentaires des Insectes : allomones ou, plus vraisemblablement, substances à action phéromonale.
Le fait que les glandes segmentaires existent déjà chez les immatures et sont semblables chez le mâle et la femelle adultes .n’est pas en faveur de leur intervention dans la vie sexuelle.
Nous pourrions plutôt admettre qu’elles entrent en jeu dans la reconnaissance intra-spécifique.
Point de vue ontogénique
Les glandes segmentaires présentent un intérêt majeur car du fait de leur emplacement, elles confirment et précisent la segmentation originelle fondamentale du prosoma, surtout dans sa partie céphalique. On sait en effet que la métamérisation et les appendices de la région antérieure du céphalothorax aranéidien suscitent des problèmes ardus, déjà abordés par l’étude du développement embryonnaire, des sacs coelomiques, de l’innervation et de la musculature (Legendre, 1959)[22] mais non définitivement résolus.
Une approche nouvelle peut en être tentée par le biais des glandes « coxales sensu lato » qui apparaissent comme le rappel d’une segmentation primitive dont elles sont les témoins fidèles.
Comme dans le cas de la glande acronale (ex clypéale), il est encore prématuré d’émettre une hypothèse sur les rapports de la paire 1 avec l’acron tant sa réduction en rend l’étude délicate.
En revanche la paire 2 assurent un statut d’appendices « complets » aux chélicères dont le somite est ainsi mieux individualisé par ses glandes basales métamériques.
L’existence de la paire 3 à la base du rostre confirme la dualité de cet organe, déjà évoquée à propos de sa glande rostrale fondamentalement paire, ainsi que la nature appendiculaire des ébauches parabuccales se rejoignant en avant de la bouche pour lui donner naissance. L’organe pharyngien adjacent pourrait lui aussi en être un témoignage.
Les deux derniers couples de glandes, 4 et 5, appartiennent au somite du pédipalpe, territoire censé résulter de la fusion de deux ébauches : le segment pédipalpaire proprement dit et le « segment fugace » de Legendre (1959,1971). Cette interprétation se trouve donc sérieusement corroborée par les rapports que chaque lame maxillaire contracte avec les deux glandes « coxales sensu lato » qui lui sont rattachées.
Il est intéressant de rappeler enfin ici que d’autres glandes tégumentaires présentant un aspect histologique voisin et les mêmes composants ultrastructuraux unitaires (adénocytes de classe 3, appareil cuticulaire) siègent ailleurs dans le corps de l’Araignée : plastron céphalothoracique, avec la glande labiosternale des Theridiosomatidae, mais surtout dans l’abdomen donc cette fois à distance du prosoma.
En effet, et comme souligné lors d’un congrés (Lopez, 1986), elles se rencontrent dans la région pédiculaire, partie la plus antérieure de l’opisthosoma, dans les atria respiratoires (trachées et poumons), dans la région épigastrique ou génitale des deux sexes (épigyne femelle, « épiandre » du mâle avec son appareil épigastrique) et jusque dans la base des filières où débouchent les glandes séricigènes.
Toutes ces glandes ne sont pas dispersées au hasard dans l’épiderme mais ont une localisation caractéristique bien particulière : ventrale, généralement bilatérale, donc paire et symétrique qui n’est pas sans rappeler certaines structures des Palpigrades (« glandes latérales » : Millot, 1942) et des Pseudoscorpions (Heurtault, com.pers.). Comme les organes segmentaires prosomatiques, elles sont, à l’évidence métamériques, probablement aussi appendiculaires et pourraient donc se rattacher aux précédents en un seul et même ensemble anatomique.
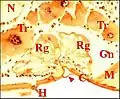 Fig.12 - Argyrodes sp., glande rétrognathocoxale . C, cuticule ; Gn, gnathocoxa; H, poil ; M, muscle ; N, ganglion nerveux; Rg, glande rétrognathocoxale (5) ; Tr, tissu réticulé. Flèches : languette (en auvent)
Fig.12 - Argyrodes sp., glande rétrognathocoxale . C, cuticule ; Gn, gnathocoxa; H, poil ; M, muscle ; N, ganglion nerveux; Rg, glande rétrognathocoxale (5) ; Tr, tissu réticulé. Flèches : languette (en auvent) Fig.13 - Argyrodes sp., glande rétrognathocoxale, autre coupe. C, cuticule ; Dc, cellules canaliculaires ; Ex, cavité extracellulaire dilatée; N, noyau adénocytaire ; Tr, tissu réticulé. Flèche : languette en auvent
Fig.13 - Argyrodes sp., glande rétrognathocoxale, autre coupe. C, cuticule ; Dc, cellules canaliculaires ; Ex, cavité extracellulaire dilatée; N, noyau adénocytaire ; Tr, tissu réticulé. Flèche : languette en auvent Fig.14 - Glande segmentaire rétrognathocoxale, cytologie.Dc, cellules satellites ; Ex, cavités extracellulaires ("vésicules") ; N, noyaux. Flèches : canalicules récepteurs
Fig.14 - Glande segmentaire rétrognathocoxale, cytologie.Dc, cellules satellites ; Ex, cavités extracellulaires ("vésicules") ; N, noyaux. Flèches : canalicules récepteurs Fig.15 - Leptyphantes sancti-vincentii, glande segmentaire rétrognathocoxale : adénocyte. Ex, cavité extracellulaire ; Mv, microvillosités ; P, plasmalemmes accolés ; V, vésicules dans l'hyaloplasme
Fig.15 - Leptyphantes sancti-vincentii, glande segmentaire rétrognathocoxale : adénocyte. Ex, cavité extracellulaire ; Mv, microvillosités ; P, plasmalemmes accolés ; V, vésicules dans l'hyaloplasme Fig.16 - Leptyphantes sanctivincentii - Organites d'un adénocyte, autre vue. Cm, corps myéloïde ; D, appareil de Golgi (dictyosome) ; Ex, cavité extracellulaire ; Mt, mitochondrie ; N, noyau ; P, plasmalemmes accolés ; V, vésicules. Flèches rouges : matériel lamellaire dans le Golgi
Fig.16 - Leptyphantes sanctivincentii - Organites d'un adénocyte, autre vue. Cm, corps myéloïde ; D, appareil de Golgi (dictyosome) ; Ex, cavité extracellulaire ; Mt, mitochondrie ; N, noyau ; P, plasmalemmes accolés ; V, vésicules. Flèches rouges : matériel lamellaire dans le Golgi Fig.17- Leptyphantes sanctivincentii : Organites d'un adénocyte. Cm, corps myéloïde ; Ex, cavité extracellulaire ; G, appareil de Golgi (dictyosome) ; Mt, mitochondrie ; Mv, microvillosités ; N, noyau ; P, plasmalemmes accolés ; V, vésicules
Fig.17- Leptyphantes sanctivincentii : Organites d'un adénocyte. Cm, corps myéloïde ; Ex, cavité extracellulaire ; G, appareil de Golgi (dictyosome) ; Mt, mitochondrie ; Mv, microvillosités ; N, noyau ; P, plasmalemmes accolés ; V, vésicules Fig.18 - Leptyphantes sanctivincentii, glande segmentaire rétrognathocoxale, adénocyte, microscope électronique à transmission.Cm, corps myéloïde ; En, enveloppe nucléaire ; Ex, cavité extracellulaire ; G, appareil de Golgi (dictyosome) ; N, noyau ; Nu, nucléole ; V, vésicules . Flèches jaunes : pores nucléaires. Flèches rouges : matériel lamellaire dans le Golgi
Fig.18 - Leptyphantes sanctivincentii, glande segmentaire rétrognathocoxale, adénocyte, microscope électronique à transmission.Cm, corps myéloïde ; En, enveloppe nucléaire ; Ex, cavité extracellulaire ; G, appareil de Golgi (dictyosome) ; N, noyau ; Nu, nucléole ; V, vésicules . Flèches jaunes : pores nucléaires. Flèches rouges : matériel lamellaire dans le Golgi Fig.19 - Leptyphantes sanctivincentii, glande segmentaire rétrognathocoxale, adénocyte. En, enveloppe nucléaire ; G, appareil de Golgi (dictyosome) ; L, lysosome ; N, noyau ; Nu, nucléole ; P, plasmalemmes accolés ; V, vésicules . Flèches jaunes : pores nucléaires. Flèches rouges : matériel lamellaire dans le Golgi
Fig.19 - Leptyphantes sanctivincentii, glande segmentaire rétrognathocoxale, adénocyte. En, enveloppe nucléaire ; G, appareil de Golgi (dictyosome) ; L, lysosome ; N, noyau ; Nu, nucléole ; P, plasmalemmes accolés ; V, vésicules . Flèches jaunes : pores nucléaires. Flèches rouges : matériel lamellaire dans le Golgi Fig. 21 - Leptyphantes sanctivincentii, glande segmentaire rétrognathocoxale, canalicules récepteur et conducteur. Cd, canalicule conducteur ; Ex, cavité extracellulaire ; M, matériel osmiophile ; Mt, mitochondrie ; Mv, microvilli ; Rd, canalicule récepteur ;V, vésicules
Fig. 21 - Leptyphantes sanctivincentii, glande segmentaire rétrognathocoxale, canalicules récepteur et conducteur. Cd, canalicule conducteur ; Ex, cavité extracellulaire ; M, matériel osmiophile ; Mt, mitochondrie ; Mv, microvilli ; Rd, canalicule récepteur ;V, vésicules Fig.22 - Leptyphantes sanctivincentii, glande segmentaire rétrognathocoxale : canalicules conducteurs et cellules-enveloppes. Cc1, cellule canaliculaire proximale ; Cc2, cellule distale ; Cd, canalicule conducteur ; J, méso et desmosome ; M, matériel dense ; Mt, mitochondrie; N, noyau.
Fig.22 - Leptyphantes sanctivincentii, glande segmentaire rétrognathocoxale : canalicules conducteurs et cellules-enveloppes. Cc1, cellule canaliculaire proximale ; Cc2, cellule distale ; Cd, canalicule conducteur ; J, méso et desmosome ; M, matériel dense ; Mt, mitochondrie; N, noyau. Fig.23 - Uroctea durandi, organe pharyngien de Millot, dit organe du goût, en fait glande segmentaire. Coupe frontale. A, adénocytes ; C, cuticule du pharynx ; Cc1, cellule canaliculaire proximale ; Cc2, cellule canaliculaire distale ; N, noyau adénocytaire ; O, orifices excréteurs ; P, cavité du pharynx. Flèches : canalicules récepteurs et appareils terminaux.
Fig.23 - Uroctea durandi, organe pharyngien de Millot, dit organe du goût, en fait glande segmentaire. Coupe frontale. A, adénocytes ; C, cuticule du pharynx ; Cc1, cellule canaliculaire proximale ; Cc2, cellule canaliculaire distale ; N, noyau adénocytaire ; O, orifices excréteurs ; P, cavité du pharynx. Flèches : canalicules récepteurs et appareils terminaux. Fig.24 - Uroctea durandi , organe pharyngien, coupe oblique. A, adénocytes ; C, cuticule du pharynx ; Cc1, cellule canaliculaire proximale ; N, noyau adénocytaire ; O, orifices excréteurs ; Flèches : canalicules récepteurs et appareils terminaux.
Fig.24 - Uroctea durandi , organe pharyngien, coupe oblique. A, adénocytes ; C, cuticule du pharynx ; Cc1, cellule canaliculaire proximale ; N, noyau adénocytaire ; O, orifices excréteurs ; Flèches : canalicules récepteurs et appareils terminaux.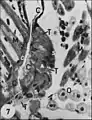 Fig.26 - Uroctea durandi, glande segmentaire du rostre(T) . A, adénocyte ; C, cuticule ; M, muscle strié ; O, néphrocyte ; S, cellule satellite (noyau).
Fig.26 - Uroctea durandi, glande segmentaire du rostre(T) . A, adénocyte ; C, cuticule ; M, muscle strié ; O, néphrocyte ; S, cellule satellite (noyau).
Notes et références
- Lopez,A., « Présence de glandes coxales céphaliques chez les Aranéomorphes. », C.R.Acad.Sci.Paris, 286, p.407-409.,
- Lopez,A., « Quelques points d’histologie comparée prosomatique chez les Oecobiidae et les Hersiliidae (Araneae). », Rev. Arachnol., 5 (4), p. 343-354.,
- Lopez,A., « Coxal glands of the genus Metepeira (Araneae, Araneidae). », J. Arachnol. (USA),11, p. 97-98.,
- Lopez,A., avec L. Juberthie-Jupeau, « Les glandes segmentaires rétro-gnathocoxales de Leptyphantes sanctivincentii (Simon, 1872)(Araneae : Linyphiidae) : structure et ultrastructure). », C.R. X e Coll. Europ. Arachnol., Bull. Soc. Sci. Bretagne, 59, (n° hors série I) , p. 115-129,
- Lopez,A., « Les Araignées de la Guadeloupe : genres Metepeira, Cyclosa et Argiope (Araneidae). », Bull.Soc.Sciences nat., 77, p. 9-16,
- Lopez,A., « Ogulnius hayoti n.sp. (Theridiosomatidae) et autres Araignées de la Martinique. », Bull.Soc.Sciences nat., 81, p. 7-15,
- Millot,J., « Le sens du goût chez les Araignées. », Bull.Soc.zool.France, 61, p.27-38.,
- Quennedey,A. & R.Brossut, « Les glandes mandibulaires de Blaberus Burm. (Dictyoptera, Blaberidae). Développement, structure et fonctionnement. », Tissue Cell, 7 (3), p. 503-517,
- Bitsch, J, « Ultrastructure de l'épithélium glandulaire du réceptacle séminal chezThermobia domestica (Thysanura Lepismatidae).. », Int.J. Insect Mophol. and Embryol., 10 (3), p. 247-263,
- (en) Quennedey, A, « The labrum of Schedorhinotermes minor soldier (Isoptera, Rhinotermitida) Morphology, innervation and fine structure. », Cell.Tiss.Res.,160, p.81-98.,
- Brossut,R.,Dubois,P.,Rigaud,J. & L.Sreng, « Etude biochimique de la sécretion des glandes tergales des Blattaria. », Insect Biochem., 5, p. 719-732,
- Wattebled,S.,Bitsch.,J. & A.Rousset, « Ultrastructure des vésicules éversibles produisant des phéromones chez les mâles de Chrysopa perla L. (Insecta, Neuroptera). », Cell.Tiss.Res., 194 (3), p. 481-496,
- (de) Schnepf,E., Wenneis,W. & H. Schildknecht, « Arthropoden-Abwehrstoff , XLI. Zur Explosionschemie der Bombardier käfer (Coleoptera, Carabidae). . », Zellforsch.mikrosk.Anat.,96, p.582-599,
- (en) Forsyth,D.J., « The ultrastructure o1 the pygidial defence glands of the Carabid Pterostichus madidus F. », J.Morph., 131, p. 397-417.,
- (en) Eisner, T., Mc Henry,F. & M.M. Salpeter,, « Defense Mechanisms of Arthropods. XV. Morphology of the quinone-producing glands of a Tenebrionid beetle (Eleodes longicollis Lee.). », J.Morph., 115 (3), p.355-368.,
- (en) Bazire-Benazet, M. & L.Zylberberg, « An integumentary gland secreting a territorial marking pheromone in Atta sp.: detailed structure and histochemistry. », J. Insect Physiol., 25, p. 751-765.,
- (en) Billen, J.P.J., « Comparative Morphology and Ultrastructure of the Dufour Gland in Ants (Hymenoptera: Formicidae). », Entomol.Gener., 11 (3/4), p. 165-181., 1986.
- (en) Happ, G.M. & C.M. Happ, « Fine structure and histochemistry of the spermathecal gland in the mealworm beetle, Tenebrio molitor », Tissue & Cell, 2 (1970), p. 443-466,
- Brossut,L. & L.Sreng, « L' Univers chimique des Blattes », Bull.Soc.ent.France,90, p. 1266-1280,
- (en) Noirot,C. & A. Quennedey, « Glands, gland cells, glandular units: some comments on terminology and classification. », Annls Soc.ent.Fr. (N.S.), 1991, 27 (2), p. 123-128,
- (en) Noirot,C. & A. Quennedey, « Fine structure of insect epidermal glands. . », Ann.Rev.Ent., 19, p. 61-80,
- Legendre,R., « Contribution à l’étude du système nerveux des Aranéides. », Ann Sci Nat Zool (12) 1:339–473,
- Portail de la biologie cellulaire et moléculaire
- Portail de l’arachnologie