Fauvette des jardins
Sylvia borin
.jpg.webp)
| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Classe | Aves |
| Ordre | Passeriformes |
| Famille | Sylviidae |
| Genre | Sylvia |

LC : Préoccupation mineure
La Fauvette des jardins (Sylvia borin) est une espèce de passereaux appartenant à la famille des Sylviidae, qui niche dans la plus grande partie de l'Europe et dans l'Ouest de l'Asie. Son plumage n'a aucun contraste ou caractéristique notable et lui confère un aspect « quelconque ». C'est une fauvette typique du genre Sylvia, robuste, avec les ailes et la queue longues, aux parties supérieures gris-brun olive et les parties inférieures plus claires. Il n'y a pas de dimorphisme sexuel, et les jeunes ressemblent aux adultes. Deux sous-espèces sont distinguées, ne différant que légèrement et s'hybridant dans les zones de sympatrie. En raison du manque de traits distinctifs, cette espèce peut être confondue avec un certain nombre de passereaux de la famille des Acrocephalidae et d'autres Sylviidae. Son chant est beau, montant ou descendant sans mélodie définie, et ressemble à celui de la Fauvette à tête noire (Sylvia atricapilla), mais sans le motif final flûté propre à cette espèce.
Seul un quart des jeunes passent la première année. La Fauvette des jardins est migratrice, hivernant en Afrique subsaharienne. Sur ce continent, elle peut être observée dans une grande diversité d'habitats, évitant toutefois les forêts fermées et les zones sans arbres du Sahel.
Les populations déclinent légèrement dans une grande partie de l'Europe mais l'espèce est en expansion vers le Nord en Scandinavie. Ses effectifs importants sont donc relativement stables et cette fauvette jouit de surcroît d'une aire de répartition extrêmement vaste ; l'Union internationale pour la conservation de la nature considère donc cet oiseau comme de « préoccupation mineure ».
Description
Apparence externe
.jpg.webp)
La Fauvette des jardins a une apparence relativement robuste, et mesure environ 14 cm de longueur, pour une aile pliée de 7,6 à 8,4 cm[1] et une envergure de 22 cm. Le poids est généralement compris entre 16 et 22 grammes, mais peut aller jusqu'à 35,5 g pour les oiseaux qui se préparent à migrer[2]. Cette fauvette a de longues ailes et une longue queue, un plumage uni sans contraste ni caractéristiques notables[3]. Les parties supérieures sont brun-gris, teintées d'olive surtout la calotte, le manteau et les scapulaires, et les parties inférieures sont plus claires et plus ternes, teintées de chamois sur le côté de la poitrine et les flancs, le milieu de la gorge et du ventre étant un peu plus clair que le reste[4]. Les côtés du cou sont souvent teintés de gris plus pur[3]. L'œil est sombre, entouré d'un vague cercle oculaire blanchâtre et surmonté d'un sourcil gris blanchâtre encore plus indistinct. Le bec est assez fort, chamois gris bleuté, la mandibule inférieure étant légèrement plus pâles que l'inférieure, et les pattes sont gris-bleu et assez fortes[1],[3]. En automne, le plumage est globalement identique mais légèrement usé, le rendant plus gris encore. Chez les individus au plumage très usé, la teinte olive du plumage est totalement perdue, ainsi que les taches gris pur sur le côté du cou et les légers contrastes de la tête[4].
Il n'y a aucun dimorphisme sexuel apparent, pas même au niveau de la taille, mais les juvéniles ont le plumage plus lâche, avec les parties supérieures plus pâles et plus grises, les parties inférieures plus chamoisées[1]. La sous-espèce orientale S. b. woodwardi est légèrement plus grande et plus pâle que la sous-espèce nominale, avec les parties supérieures plus grisâtres et les parties inférieures plus blanches[1]. Les deux sous-espèces sont difficiles à distinguer visuellement et coexistent dans leurs quartiers d'hivernage en Afrique ; S. b woodwardi se distingue de S. b. borin par son aile pliée supérieure à 80 mm[4].
- Comparaison des deux sous-espèces de Sylvia borin
_-_Sylviidae_-_bird_skin_specimen.jpeg.webp)
_-_Sylviidae_-_bird_skin_specimen.jpeg.webp) S. b. borin - Parties inférieures du même spécimen que précédemment (RMNH.AVES.138188).
S. b. borin - Parties inférieures du même spécimen que précédemment (RMNH.AVES.138188)._-_Sylviidae_-_bird_skin_specimen.jpeg.webp)
_-_Sylviidae_-_bird_skin_specimen.jpeg.webp) S. b. borin - Parties inférieures du même spécimen que précédemment (RMNH.AVES.9153).
S. b. borin - Parties inférieures du même spécimen que précédemment (RMNH.AVES.9153).
_-_Sylviidae_-_bird_skin_specimen.jpeg.webp)
_-_Sylviidae_-_bird_skin_specimen.jpeg.webp) S. b. woodwardi - Parties inférieures du même spécimen que précédemment (RMNH.AVES.94935).
S. b. woodwardi - Parties inférieures du même spécimen que précédemment (RMNH.AVES.94935)._-_Sylviidae_-_bird_skin_specimen.jpeg.webp)
_-_Sylviidae_-_bird_skin_specimen.jpeg.webp) S. b. woodwardi - Parties inférieures du même spécimen que précédemment (RMNH.AVES.94938).
S. b. woodwardi - Parties inférieures du même spécimen que précédemment (RMNH.AVES.94938).
Les juvéniles de la Fauvette des jardins connaissent une mue partielle impliquant principalement le plumage du corps, entre juin et septembre, avant la migration. Une mue partielle similaire a aussi lieu chez les adultes vers la fin de l'été, mais parfois plus étendue, et une mue complète prend place dans les quartiers d'hiver, en Afrique, avant la migration de retour[4].
Voix
Le mâle de la Fauvette des jardins chante généralement bien à l'abri du feuillage, souvent assez bas[4]. Le chant est un gazouillis fluctuant, montant et descendant la gamme sans ordre et sans constituer de mélodie, constitué en strophes de 3 à 8 secondes[3]. Comme les autres fauvettes, la Fauvette des jardins peut chanter en sourdine (un chant appelé « subsong » dans la littérature anglophone), et la distinction avec la Fauvette à tête noire est alors compliquée. Ces chants en sourdine peuvent être entendus dans les zones d'hivernage en Afrique, se développant en un chant véritable en avril-mai, avant la migration de retour vers l'Europe et l'Asie[5]. La Fauvette des jardins peut parfois imiter les cris d'autres oiseaux, tels que le Guêpier d'Europe (Merops apiaster), la Pie-grièche à tête rousse (Lanius senator), ou même communément le chant complet du Pinson des arbres (Fringilla coelebs)[6]. La Fauvette des jardins peut être elle-même imitée par la Fauvette à tête noire (Sylvia atricapilla), dont le chant est extrêmement proche (voir le paragraphe Espèces similaires) et encore plus quand émis en sourdine[5] ou par d'autres oiseaux comme la Rousserolle verderolle (Acrocephalus palustris)[7]. Un chant aberrant peut être entendu dans une grande partie de l'Europe, mais sporadiquement, consistant en un trille roulé rappelant le cri du Martinet à ventre blanc (Tachymarptis melba) ou au Serin des Canaries (Serinus canaria), et parfois pris à tort pour l'Hypolaïs polyglotte (Hippolais polyglotta) ou l'Hypolaïs bottée (Iduna caligata)[6].
Le cri de contact de la Fauvette des jardins est une série caquetante de cliquètements pleins et nasillards, en tchèc, tchèc, tchèc…, répété plus rapidement quand l'oiseau est inquiété[8],[3]. Il est aussi décrit dans la littérature anglophone comme un vit vit vit vit vit vit vit… profond, appuyé mais calme, rappelant la Fauvette grisette (Sylvia communis)[9]. Un grinsement en tchurr-r-r-r, rappelant aussi la Fauvette grisette, est parfois émis[1]. Les jeunes au nid émettent un cri d'alarme en quia[4].
Espèces similaires

L'apparence neutre de la Fauvette des jardins fait qu'elle peut facilement être confondue avec d'autres espèces, comme certaines hypolaïs dans la famille des Acrocephalidae (genres Hippolais et Iduna), et évidemment avec d'autres fauvettes dans la famille des Sylviidae (genre Sylvia). Comme la Fauvette des jardins, l'Hypolaïs polyglotte (Hippolais polyglotta) et l'Hypolaïs ictérine (H. icterina) ont un plumage uniforme, mais avec les parties inférieures nettement teintées de jaune et les parties supérieures de verdâtre, et ont également un bec bien plus long[1],[3]. Les juvéniles de ces deux espèces d'hypolaïs sont plus grisâtres, mais ont le bec large à sa base et la mandibule inférieure souvent teintée d'orange, alors que le bec de la Fauvette des jardins est gris, d'apparence plus court et massif par comparaison[10]. L'Hypolaïs bottée (Iduna caligata) est de couleur similaire, mais est bien plus petite, d'apparence moins robuste, avec un sourcil plus marqué et un bec de couleur chair. L'Hypolaïs pâle (I. pallida) et l'Hypolaïs obscure (I. opaca) — dont les cris ressemblent à ceux de la Fauvette des jardins en plus d'un ressemblance morphologique superficielle — sont aussi relativement petites, ont un sourcil plus marqué, un bec rosâtre ainsi que le bout des rectrices latérales blanc-gris[1],[3].
_(34406940671)_(cropped).jpg.webp)
Les jeunes de la Fauvette épervière (Sylvia nisoria), qui n'ont pas les parties inférieures densément barrées comme chez les adultes, peuvent se distinguer de la Fauvette des jardins par leur plus grande taille et par leurs barres alaires pâles[1], et par les parties inférieures légèrement barrées à l'arrière des flancs. Les femelles et les jeunes de la Fauvette à tête noire (S. atricapilla) se distinguent de la Fauvette des jardins par leur calotte rousse ; ceux de la Fauvette grisette (S. communis) présentent quant à eux de larges liserés roux dans les plumes de l'aile, une gorge bien plus blanche et les côtés de la queue blancs[3].
Le chant de la Fauvette à tête noire peut être très semblable à celui de la Fauvette des jardins, et les deux espèces peuvent s'imiter, mais la première termine son gazouillis par des sons flûtés, clairs et forts, absent chez la seconde, qui a une voix légèrement plus grave et un ton plus mélancolique[3]. La Fauvette des jardins a également un chant plus constant en intensité, quand la Fauvette à tête noire a un chant plus onduleux, devenant de plus en plus fort sur la fin. Les phrases des deux espèces sont de longueurs similaires, mais les pauses sont plus courtes chez la Fauvette des jardins[5]. Un aide-mémoire proposé pour la distinction de ces deux espèces veut que la Fauvette des jardins évoque quelqu'un essayant de parler trop vite, quand la Fauvette à tête noire fait plutôt penser à un fou essayant de siffler[9].
Écologie et comportement
Alimentation
La fauvette des jardins a un régime mixte, passant de principalement insectivore pendant la période de reproduction à majoritairement frugivore le reste de l'année (notamment lors de sa migration).
Ses proies incluent une large variété d'invertébrés, avec une majorité de pucerons et de larves d'hyménoptères et de lépidoptères. Elle capture généralement ses proies directement sur les feuilles ou les branches, mais peut également chasser des insectes volants.
Concernant les fruits, elle favorise les figues et les ronces durant sa migration ; en Afrique, elle peut aussi se nourrir des fruits des genres Solanum, Lantana ou Salvadora, entre autres[11].
Reproduction
La saison de la reproduction a lieu entre avril et juin. La fauvette est généralement monogame bien que des cas de polygamie aient été rapportés. Territoriale, le mâle construit généralement plusieurs nids en bol, dont l'un sera sélectionné et complété par la femelle ; il est composé d'herbes, de feuilles et de racines, doublées d'herbes plus douces et de poils ; on le trouve généralement plutôt bas et caché dans un arbre ou un buisson.
La couvée contient entre 4 et 5 œufs, de couleur blanche ou crème et tâchetés de brun, qui sont couvés par les deux sexes pour une durée de 11 à 12 jours. Les petits restent au nid pendant 10 jours, et deviennent indépendants entre 10 et 14 jours après leur premier vol[11].
Prédateurs et parasites

La fauvette des jardins peut subir le parasitisme de couvée du coucou gris[12].
A l'âge adulte, la fauvette peut être la cible de l'épervier d'Europe et du chat domestique. Durant sa migration, elle peut également être la victime du faucon d'Éléonore[13]. Le geai des chênes et la pie bavarde sont susceptibles de détruire les œufs de la fauvette, tout comme certains mammifères comme l'hermine, le blaireau ou les écureuils[14].
Répartition et habitat
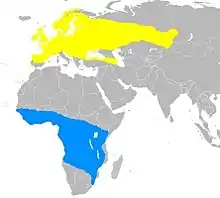
- Zone de nidification
- Zone d'hivernage
La fauvette des jardins niche dans l'essentiel de l'Europe entre les isothermes de 12 et 28 °C, et plus à l'est à travers l'Asie tempérée, jusqu'au fleuve Ienisseï, en Sibérie. Son aire de répartition s'étend plus au nord que toute autre fauvette du genre Sylvia. Toutes les populations sont migratrices et hivernent en Afrique subsaharienne, au sud jusqu'en Afrique du Sud[2]. Les oiseaux d'Europe centrale migrent d'abord vers le sud-ouest, se réorientant vers le sud ou le sud-est une fois arrivés en Afrique, alors que les migrants scandinaves peuvent se diriger vers le sud à travers les Alpes puis traversent la mer Méditerranée. La sous-espèce S. b. woodwardi gagne l'Afrique par une route plus orientale, de nombreux oiseaux traversant la péninsule arabique. La Fauvettes des jardins traverse le Sahara en volant de nuit, ne se nourrissant pas et restant immobile posée à l'ombre durant la journée[15]. Au cours de ce voyage, cette fauvette peut non seulement métaboliser sa graisse corporelle, mais également jusqu'à 19 % des muscles pectoraux et de ceux de ses pattes et 39 % de son tube digestif. Après la traversée du désert, de nombreux individus font une halte de quelques jours afin de se nourrir avant de continuer plus au sud[16].
Taxinomie
La Fauvette des jardins est décrite en 1783 par le naturaliste hollandais Pieter Boddaert, dans les Table des planches enluminées accompagnant le travail d'Edme-Louis Daubenton, et la décrit sous le protonyme de Motacilla borin[17]. Du genre Motacilla, qui regroupe les bergeronnettes, la Fauvette des jardins est ensuite déplacée vers le genre Sylvia, qui appartient à la vaste famille des Sylviidae et qui est apparu depuis 20 millions d'années au moins[18]. Le nom de genre provient du latin moderne silvia, une nymphe des bois, et apparenté à silva pour « bois, forêt »[19]. La dénomination spécifique, borin, provient d'un nom local pour l'oiseau dans la région de Gênes en Italie ; ce dernier dérive du latin bos pour « bœuf », animaux que la fauvette était pensée accompagner[20].
La Fauvette des jardins et son parent le plus proche, la Fauvette à tête noire (S. atricapilla), forment une lignée ayant divergé très tôt des autres membres du genre, il y a de cela 12 à 16 millions d'années. Au fil du temps, elles ont cependant divergé suffisamment l'une de l'autre pour être placée dans des sous-genres différents, S. atricapilla dans le sous-genre Sylvia et S. borin dans le sous-genre Epilais[21]. Ces deux espèces sœurs nichent plus loin au Nord-Est que toutes les autres fauvettes du genre Sylvia sauf la Fauvette babillarde (S. curruca) et la Fauvette grisette (S. communis)[22]. Les plus proches parents de ces deux espèces semblent être les deux espèces du genre Pseudoalcippe — le Pseudalcippe d'Abyssinie (P. abyssinica) et le Pseudalcippe du Ruwenzori (P. atriceps) — et le Horizorin de Dohrn (Horizorhinus dohrni), qui devraient donc possiblement être placés dans le genre Sylvia[23],[24].
Selon le Congrès ornithologique international (version 9.2, 2019)[25] et Alan P. Peterson[26], deux sous-espèces sont distinguées :
- Sylvia borin borin (Boddaert, 1783), la sous-espèce nominale, niche dans l'Ouest, le centre et le Nord de l'Europe[25]. Son aire de nidification s'étend jusqu'en Finlande, au centre de la Pologne, l'Ouest de la Hongrie et la Bosnie[1].
- Sylvia borin woodwardi (Sharpe, 1877), nommée par Richard Bowdler Sharpe en l'honneur de son collaborateur Bernard Barham Woodward[27], niche en Pologne, en Ukraine et à l'Est en Asie jusque dans le centre de la Sibérie[25].
Des oiseaux de morphologie intermédiaire sont observés là où les deux sous-espèces coexistent et s'hybrident, et ont parfois été décrites comme des sous-espèces distinctes, comme S. b. kreczmeri en Pologne ou S. b. pateffi Jordans, 1940 en Bulgarie, mais elles ne sont généralement pas reconnues comme des taxons valides[1].
La Fauvette des jardins et l'homme
Dans l'art
Olivier Messiaen a consacré une pièce à cet oiseau, La Fauvette des jardins[28].
Annexes
Références taxinomiques
- (en) Référence Congrès ornithologique international : (consulté le )
- (en) Référence Zoonomen Nomenclature Resource (Alan P. Peterson) : Sylvia borin dans Sylviidae (consulté le )
- (en) Référence Catalogue of Life : Sylvia borin (Boddaert, 1783) (consulté le )
- (fr+en) Référence ITIS : Sylvia borin (Boddaert, 1783) (consulté le )
- (en) Référence Animal Diversity Web : Sylvia borin (consulté le )
- (en) Référence NCBI : Sylvia borin (Boddaert, 1783) (taxons inclus) (consulté le )
- (fr+en) Référence Avibase : Sylvia borin (Boddaert, 1783) (+ répartition) (consulté le )
Liens externes
- (fr) Référence Oiseaux.net : Sylvia borin (+ répartition) (consulté le )
- (fr) Référence INPN : Sylvia borin (Boddaert, 1783) (consulté le )
- (en) Référence Fauna Europaea : Sylvia borin (Boddaert, 1783) (consulté le )
- (en) Référence uBio : Sylvia borin (Boddaert, 1783) (consulté le )
- (en) Référence BioLib : Sylvia borin (Boddaert, 1783) (consulté le )
- (fr) Référence CITES : taxon Sylvia borin (sur le site du ministère français de l'Écologie) (consulté le )
- (en) Référence UICN : espèce Sylvia borin (consulté le )
Bibliographie
- (en) Kevin Baker, Warblers of Europe, Asia and North Africa (Helm Identification Guides), Londres, Helm, , 400 p. (ISBN 978-0-7136-3971-1)
- Stanley Cramp, Duncan J. Brooks, Euan K. Dunn, Robert Gillmor, Joan Hall-Craggs, Philip Hollom, E. M. Nicholson, M. A. Ogilvie, C. S. Roselaar, P. J. Sellar, Ken Simmons, D. W. Snow, Dorothy Vincent, Karel Voous, D. I. M. Wallace, M. G. Wilson, Handbook of the Birds of Europe, the Middle East and North Africa. Volume VI. Warblers, (œuvre littéraire), OUP, New York,
- (en) D.W. Gibbons, A. Amar, G.Q.A. Anderson, M. Bolton, R.B. Bradbury, M.A. Eaton, A.D. Evans, M.C. Grant, R.D. Gregory, G.M. Hilton, G.J.M. Hirons, J. Hughes, I. Johnstone, P. Newbery, W.J. Peach, N. Ratcliffe, K.W. Smith, R.W. Summers, P. Walton et al., The predation of wild birds in the UK : a review of its conservation impact and management, Sandy, Bedfordshire, Royal Society for the Protection of Birds, (ISBN 978-1-905601-02-8, lire en ligne)
- (en) C.F. Mason, The Blackcap (Hamlyn Species Guides), Londres, Hamlyn, , 126 p. (ISBN 978-0-600-58006-5)
- (en) Hadoram Shirihai, Gabriel Gargallo et Andreas Helbig (ill. Alan Harris et David Cottridge), Sylvia Warblers : Identification, taxonomy and phylogeny of the genus Sylvia, Singapour, Christopher Helm, (ISBN 0-7136-3984-9), p. 576
- Eric Simms, British Warblers, (œuvre littéraire), William Collins, Sons, Londres,
- (en) David Snow et Christopher M. Perrins, The Birds of the Western Palearctic concise edition (2 volumes), Oxford, Oxford University Press, , 732 p. (ISBN 978-0-19-854099-1)
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Garden warbler » (voir la liste des auteurs).
- Baker (1997), p. 339-340
- Snow & Perrins (1998), p. 1314-1316
- Lars Svensson, Le guide ornitho, (œuvre littéraire), Delachaux et Niestlé,
- Shirihai et al. (2001), p. 73-80
- Simms (1985), p. 56-67
- Euan K. Dunn in Cramp et al. (1992), p. 489-492, « Voice »
- (en) John Walpole-Bond, « The Marsh-Warbler as a Sussex species », British Birds, Londres, vol. 27, , p. 58-65 (ISSN 0007-0335, lire en ligne)
- Simms (1985), p. 68-80
- (en) Keith Vinicombe, Alan Harris et Laurel Tucker, The Helm Guide to Bird Identification, Christopher Helm, , 400 p. (ISBN 978-1-4081-3035-3, lire en ligne), p. 318-319
- (en) Hadoram Shirihai, David A. Christie et Alan Harris, « Identification of Hippolais warblers », British Birds, Londres, vol. 89, no 3, , p. 114-138 (ISSN 0007-0335, lire en ligne)
- (en) Raül Aymí et Gabriel Gargallo, « Garden Warbler (Sylvia borin), version 1.0 », Birds of the World, (DOI 10.2173/bow.garwar1.01, lire en ligne, consulté le )
- Johannes Erritzoe, Cuckoos of the World, Christopher Helm, (ISBN 978-1-4081-4267-7, 1-4081-4267-8 et 0-7136-6034-1, OCLC 785336604, lire en ligne)
- Hartmut Walter, Eleonora's falcon : adaptations to prey and habitat in a social raptor, University of Chicago Press, (ISBN 0-226-87229-7 et 978-0-226-87229-2, OCLC 4114675, lire en ligne)
- D. W. Gibbons et Royal Society for the Protection of Birds, The predation of wild birds in the UK : a review of its conservation impact and management, RSPB, (ISBN 978-1-905601-02-8 et 1-905601-02-6, OCLC 186414103, lire en ligne)
- (en) Ian Newton, Bird Migration (Collins New Naturalist Library 113), Londres, Collins, , 598 p. (ISBN 978-0-00-730732-6), p. 158
- Shirihai et al. (2001), p. 84-88
- Pieter Boddaert, Table des planches enluminéez d'histoire naturelle de M. D'Aubenton : avec les denominations de M.M. de Buffon, Brisson, Edwards, Linnaeus et Latham, precedé d'une notice des principaux ouvrages zoologiques enluminés, (œuvre littéraire), , [lire en ligne]
- Mason (1995), p. 11
- (en) James A. Jobling, The Helm Dictionary of Scientific Bird Names, Londres, Christopher Helm, , 432 p. (ISBN 978-1-4081-2501-4, lire en ligne), p. 59
- Jobling (2010), p. 75
- Shirihai et al. (2001), p. 25-27
- (en) Knud A. Jønsson et Jon Fjeldså, « A phylogenetic supertree of oscine passerine birds (Aves: Passeri) », Zoologica Scripta, Wiley-Blackwell, vol. 35, no 2, , p. 149-186 (ISSN 0300-3256 et 1463-6409, DOI 10.1111/J.1463-6409.2006.00221.X)
- (en) Javier Pérez-Tris, Olof Hellgren, Asta Krizanauskiene, Jonas Waldenström, Jean Secondi, Camille Bonneaud, Jon Fjeldså, Dennis Hasselquist et Staffan Bensch, « Within-host speciation of malaria parasites », PLOS ONE, PLoS, vol. 2, no 2, , e235 (ISSN 1932-6203, OCLC 228234657, PMID 17311104, PMCID 1794596, DOI 10.1371/JOURNAL.PONE.0000235)
- (en) Gary Voelker et Jessica E. Light, « Palaeoclimatic events, dispersal and migratory losses along the Afro-European axis as drivers of biogeographic distribution in Sylvia warblers », BMC Evolutionary Biology, BMC et Springer Science+Business Media, vol. 11, no 1, , p. 163 (ISSN 1471-2148, OCLC 47657384, PMID 21672229, PMCID 3123607, DOI 10.1186/1471-2148-11-163)
- Congrès ornithologique international
- Alan P. Peterson
- Richard Bowdler Sharpe, Catalogue of the birds in the British Museum. Volume III. Passeriformes Coliomorphæ, (œuvre littéraire), Musée d'histoire naturelle de Londres, Londres, , [lire en ligne]
- Interprétation par Yvonne Loriod ; interprétation par Anatol Ugorski.
- Portail de l'ornithologie