Hémorragie méningée
Une hémorragie méningée, appelée aussi hémorragie subarachnoïdienne (HSA), correspond à l'irruption de sang dans l'espace sous-arachnoïdien (entre l'arachnoïde et la pie-mère), le plus souvent après une rupture d'anévrisme. C'est un accident grave, parfois mortel, qui impose un transfert urgent en neurochirurgie lorsqu'il est diagnostiqué à temps. Elle est la cause d'un certain nombre de morts subites de l'adulte (10 % environ des hémorragies méningées).
Pour les articles homonymes, voir HSA.
Mécanisme
Le saignement responsable peut être de plusieurs origines, la plus fréquente (85 % des cas) étant représentée par la rupture d'anévrisme d'une artère du cerveau. Les conséquences de la maladie sont liées à l'hyperpression intracrânienne qui comprime le cerveau dans son logement inextensible (osseux) et peut entraîner un engagement cérébral fatal (par compression des parties basses du cerveau, cervelet et tronc cérébral à travers le trou occipital).
- Rupture d'anévrisme cérébral : les anévrismes sont multiples dans près de 20 % des cas. Les localisations les plus fréquentes de ces anévrismes sont : l'artère communicante antérieure (30 %), l'artère communicante postérieure (25 %) et l'artère cérébrale moyenne (20 %). Ces anévrismes se forment durant la vie et la plupart n'entraînent jamais de complications. Le risque de rupture augmente avec la taille de l'anévrisme, mais l'hémorragie méningée survient fréquemment sur de petits anévrismes du fait de leur bien plus grande fréquence. La rupture de ces derniers est favorisée par l'hypertension artérielle, et l'alcoolisme[1]. Des formes héréditaires existent mais sont rares.
- Rupture de malformation artérioveineuse.
- Dans 20 % des cas, et malgré un bilan complet, aucune cause ne peut être trouvée à l'hémorragie méningée. On parle alors d'hémorragie cryptogénique.
Le déclenchement de l'hémorragie est parfois rapporté à un évènement particulier (effort par exemple), mais cela reste inconstant.
Épidémiologie
Cette maladie est rare : 8 pour 100 000 par an, mais semble plus fréquente dans certains pays (dont le Japon où il peut atteindre près de 20 pour 100 000 par an)[2].
Près de la moitié des cas sont des sujets de moins de 55 ans et la cause est, dans 85 % des cas, une rupture d'anévrisme intracérébrale[3].
Près de 10 % des personnes victimes d'hémorragie méningée décèdent avant d'avoir pu être prises en charge dans un milieu hospitalier[4].
Diagnostic
Les maux de tête (céphalées) en dominent la présentation : elles apparaissent brutalement (« comme un coup de tonnerre » ou en anglais « thunderclap headache »), sont maximales d'emblée, extrêmement intenses[5]. Ils peuvent survenir après une miction ou un effort de défécation ou sans circonstance déclenchante particulière[6]. Elles s'associent à des nausées, des vomissements, photophobie (intolérance à la lumière) et phonophobie (intolérance aux sons). Ils s'accompagnent rarement de convulsions. Il existe des formes foudroyantes, avec coma d'emblée ou mort subite par hémorragie massive. L'attaque peut être précédée pendant quelques semaines de maux de tête dans 10 à 40 % des cas[7].
À noter que les céphalées d'apparition brutales ont très souvent d'autres causes, une hémorragie méningée n'étant retrouvée que dans 10 % de ces dernières[8].
L'examen clinique retrouve le syndrome méningé associant une raideur de la nuque (ce dernier pouvant être absent à son début ou si le patient est en coma profond), un signe de Kernig et de Brudzinski, des troubles de la conscience fréquents (syndrome confusionnel), parfois des signes de localisation neurologique en cas de constitution d'un hématome ou d'une vasoconstriction d'une artère cérébrale. L'examen du fond d'œil peut retrouver un œdème papillaire en cas d'augmentation de la pression à l'intérieur du crâne (hypertension intracrânienne), voire des hémorragies du fond d'œil.
Des signes généraux sont habituels : fièvre, rythme cardiaque rapide (tachycardie), anomalies de la tension artérielle, accélération de la fréquence respiratoire (polypnée).
Il n'est pas rare d'observer des troubles du rythme (tachycardie ventriculaire, torsades de pointe, fibrillation ventriculaire) nécessitant alors d'être choqués[réf. nécessaire].
La céphalée révélatrice peut être précédée parfois par des maux de tête transitoires.
Le diagnostic est cependant loin d'être évident. Durant les années 1980, entre un tiers et un quart des hémorragies méningées recevaient un mauvais diagnostic lors de la consultation initiale[9]. Cette proportion a diminué mais ne s'est pas annulée malgré la mise à disposition plus aisée des moyens d'imagerie cérébrale : une hémorragie méningée sur dix n'est pas reconnue lors de la prise en charge, correspondant cependant à des formes moins graves[10].
Examens complémentaires
Exploration cérébrale : Imagerie en coupe
- Scanner cérébral en contraste spontané
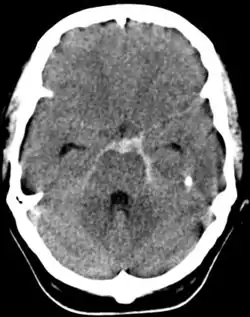
Il est systématique et demandé en urgence : il permet de faire le diagnostic en décelant des hyperdensités au sein des espaces sous-arachnoïdiens (témoignant de la présence de sang frais) de topographie variable selon l'étiologie et la localisation d'une lésion éventuelle (vallée sylvienne, scissure inter-hémisphérique, citernes de la base, sillons de la convexité). La sensibilité est excellente dans les premiers jours[11]. Il recherche des complications (hématome cérébral, inondation ventriculaire, hydrocéphalie aiguë). Cette hyperdensité peut s'amoindrir, voire s'escamoter complètement après quelques jours d'évolution[5].
- L'angioscanner cérébral avec injection en bolus d'un produit de contraste est fait le plus souvent dans les suites immédiates de la première acquisition, faite sans produit de contraste. Il permet de rechercher un anévrisme rompu responsable de l'hémorragie méningée. La sensibilité des angioscanners multicoupes dans cette indication est très bonne, sous réserve d'une lecture expérimentée de l'imagerie.
- L'IRM permet également de faire le diagnostic. La séquence FLAIR permet de bien visualiser les saignements au niveau des sillons (les anomalies de signal pericisternaux sont d'interprétation plus difficile). Une séquence de type écho de gradient pondéré T2 visualise très bien un phénomène hémorragique. Les séquences d'ARM permettent de recherche une lésion anévrismale. L'IRM est aussi sensible que le scanner à une phase précoce et donne de meilleurs résultats plus tardivement[3]. Cet examen peut montrer également la topographie de l'anévrisme.
Ponction lombaire
La ponction lombaire montre un liquide typiquement teinté mais le rendement diagnostic est très faible en cas de scanner normal, surtout s'il est fait dans les quelques jours après le début de l'accident[12]. On demandera une analyse biochimique, cytologique, une centrifugation avec analyse du surnageant, bactériologique).
Elle révèle :
- une pression d'ouverture augmentée, témoignant de l'augmentation de la pression dans les méninges ;
- un liquide cérébrospinal (LCS) rosé de façon homogène dans les 3 tubes, ce qui élimine en théorie une ponction « traumatique », le liquide s'éclaircissant progressivement dans ce cas, bien que des exceptions soient possibles[13] ;
- la présence de globules rouges (hématies) altérés, crénelés ;
- le LCR est incoagulable ;
- le surnageant est jaunâtre (xantochromique) ;
- la recherche de pigments est positive.
Un scanner crânien normal suivi d'une ponction lombaire elle aussi normale permet d'exclure le diagnostic d'hémorragie méningée avec une quasi certitude[14].
Artériographie cérébrale
Examen de référence pour le diagnostic étiologique et pour le bilan avant une éventuelle intervention jusque-là, il tend de plus en plus à être remplacé par un scanner ou une IRM. Il permet d'étudier tous les axes artériels cérébraux, carotidiens et vertébrobasilaires, à l'aide d'un cathétérisme artériel sélectif puis par une opacification par un produit de contraste iodé.
- Il recherche une lésion anévrismale rompue, et la présence d'autre(s) lésion(s) anévrismale(s) associée(s). Une acquisition rotationnelle 3D permet une reconstruction tridimensionnelle sur une console de traitement d'image. Cet examen permet de connaître la taille de la lésion, ses rapports anatomiques, notamment vasculaire, la taille du collet de l'anévrisme. Il visualise la présence d'un faux sac, localisation probable de la fissuration anévrismale. Il permet de définir la meilleure technique de traitement, endovasculaire, ou encore neurochirurgical.
- Il peut mettre en évidence une malformation artérioveineuse ou encore une fistule durale.
- Si aucune lésion intracrânienne n'est retrouvée, une exploration des axes vasculaires cervicaux est réalisée à la recherche d'un anomalie vasculaire en rapport avec le canal spinal. Enfin, en cas de bilan initial négatif, une nouvelle artériographie est réalisée environ 8 à 10 jours après l'épisode (une lésion peut ne pas être retrouvée lors de l'artériographie initiale).
- Le bilan artériographie peut être négatif (ex. : hémorragie interpédonculaire bénigne).
Autres examens
- Bilan préopératoire complet et recherche de contre-indications à l'anesthésie.
- Échographie et doppler transcrânien (à la recherche d'un spasme artériel).
L'électrocardiogramme peut montrer des anomalies trompeuses et faire évoquer, à tort, un infarctus du myocarde.
Prise en charge
la prise en charge a fait l'objet de la publication de recommandations. Celles, américaines, datent de 2012[15].
L'admission en milieu neurochirurgical, au mieux en neuroréanimation, est indispensable.
Traitement symptomatique
Soulager les céphalées : repos strict au lit, limiter tout stimulus, analgésie, anxiolytique. gestion hémodynamique, hydratation adaptée, monitoring de la pression intracrânienne, traitement du vasospasme. La nimodipine, un inhibiteur calcique, peut être employée avec des résultats encourageants pour diminuer le spasme des artères[16]. D'autres traitements comme les anti-endothélines sont en cours d'évaluation. L'état de conscience doit être soigneusement surveillé (score de Glasgow).
Le niveau de la pression artérielle doit être soigneusement contrôlé : pas trop haut de manière à ne pas favoriser un nouveau saignement, mais pas trop bas également pour assurer un débit sanguin correct au niveau du cerveau, le niveau optimal restant cependant empirique[5].
L'acide tranexamique, un médicament inhibant la fibrinolyse permet de diminuer le risque de récidive précoce de saignement[17].
Traitement de la cause
- Traitement d'un anévrisme : le but est d'éviter un nouveau saignement. Dans le cas d'un anévrisme, une exclusion de celui-ci est nécessaire. Le traitement neurochirurgical, qui consiste à cliper le collet de l'anévrisme, était la règle auparavant. À partir des années 1990, une technique de traitement endovasculaire par embolisation hypersélective de l'anévrisme a été développée. Depuis le début des années 2000, elle est devenue le plus souvent le traitement de choix d'un anévrisme cérébral rompu. Un cathéter est monté par voie artérielle rétrograde (c'est-à-dire dans le sens contraire du flux sanguin), en général par ponction de l'artère fémorale, sous contrôle radiologique jusqu'au niveau de l'anévrisme. Ce dernier est alors obstrué par l'injection de spires métalliques appelées coils. Le traitement endovasculaire de l'anévrisme peut être réalisé dans la foulée de l'artériographie cérébrale.
- traitement d'une malformation artério-veineuse ou d'une fistule durale : traitement neurochirurgical, radiochirurgical ou par embolisation cérébrale hypersélective.
Traitement des complications
- Dérivation ventriculaire externe en cas d'hydrocéphalie aiguë.
- Angioplastie par voie endovasculaire d'un vasospasme artériel symptomatique.
- Traitement préventif du vasospasme cérébral par la nimodipine par voie orale pendant 21 jours[18], ce qui diminue le risque d'évolution péjorative de près d'un tiers[19].
Traitement préventif
- En prévention secondaire (le sujet ayant fait un premier épisode d'hémorragie méningée), il convient de maîtriser les facteurs de risque vasculaire : hypertension artérielle, tabagisme...
- En prévention primaire, lorsqu'on découvre un anévrisme intracrânien n'ayant pas saigné, l'attitude doit être discutée au cas par cas en fonction de la taille de l'anévrisme et de l'âge du patient. S'il semble justifiable au vu des dernières études de traiter un anévrisme asymptomatique de plus de 8 mm, la question reste posée pour un diamètre inférieur.
Évolution
C'est une maladie grave avec une mortalité de près de 50 % et de lourdes séquelles chez 30 % des survivants.
Un nouveau saignement est fréquent en l'absence de traitement de l'anévrisme (près de 40 % à un mois), avec une mortalité plus élevée lors d'un resaignement[20]. Il survient néanmoins dans moins de 10 % des cas dans les quelques jours suivant l'accident initial, même correctement pris en charge[21].
Une hydrocéphalie précoce se développe dans près d'un cas sur cinq.
Un spasme artériel secondaire peut compliquer l'évolution au bout de quelques jours, provoquant un nouveau déficit neurologique en rapport avec une hypoperfusion cérébrale d'aval, avec risque d'infarctus cérébral. Ce spasme, de mécanisme inconnu, peut être détecté par un examen par doppler pulsé transcrânien, et confirmé par une artériographie cérébrale. Il survient dans environ 40 % des cas[22]. Une angioplastie par voie endovasculaire peut être réalisée en cas de spasme sévère avec retentissement sur la perfusion cérébrale.
Le tableau neurologique peut également s'aggraver secondairement en dehors de la récidive hémorragique ou du spasme, probablement secondaire à la survenue d'une inflammation locale[23].
Une hydrocéphalie tardive peut se développer également, secondaire à l'obstruction des voies de circulation du liquide cérébrospinal. La fréquence de cette complication est variable mais elle est souvent asymptomatique[5].
Des anomalies cardiaques sont fréquentes lors des hémorragies méningées, allant de la simple élévation de la troponine jusqu'à un tableau d'insuffisance cardiaque pouvant être sévère, mais, en règle, régressif.
Notes et références
- (en) Risk factors for subarachnoid hemorrhage: an updated systematic review of epidemiological studies, Feigin VL, Rinkel GJE, Lawes CM, et al. Stroke 2005; 36: 2773–80.
- (en) Incidence of subarachnoid hemorrhage : role of region, year, and rate of computed tomography, F.H.H. Linn, G.J.E. Rinkel, A. Algra, J. van Gijn, Stroke, 1996;27:625-9.
- (en) Subarachnoid haemorrhage, Jan van Gijn, Richard S Kerr, Gabriel J E Rinkel, Lancet 2007;369:306–18.
- (en) The probability of sudden death from rupture of intracranial aneurysms: a meta-analysis, Huang J, Van Gelder JM, Neurosurgery, 2002;51:1101–05.
- Lawton MT, Vates GE, Subarachnoid hemorrhage, N Engl J Med, 2017; 377:257-266
- Matsuda M, Watanabe K, Saito A, Matsumura K, Ichikawa M, Circumstances, activities, and events precipitating aneurysmal subarachnoid hemorrhage, J Stroke Cerebrovasc Dis, 2007;16:25-29
- Polmear A, Sentinel headaches in aneurysmal subarachnoid haemorrhage: what is the true incidence? A systematic review, Cephalalgia, 2003;23:935-941
- (en) Prospective study of sentinel headache in aneurysmal subarachnoid haemorrhage, Linn FHH, Wijdicks EFM, van der Graaf Y, Weerdesteyn-van Vliet FA, Bartelds AI, van Gijn J. Lancet 1994;344:590–3.
- Edlow JA, Caplan LR, Avoiding pitfalls in the diagnosis of subarachnoid hemorrhage, N Engl J Med, 2000;342:29-36.
- Kowalski RG, Claassen J, Kreiter KT et al. Initial misdiagnosis and outcome after subarachnoid hemorrhage, JAMA, 2004;291:866-869
- Cortnum S, Sørensen P, Jørgensen , Determining the sensitivity of computed tomography scanning in early detection of subarachnoid hemorrhage, Neurosurgery, 2010;66:900-903
- Sayer D, Bloom B, Fernando K et al. An observational study of 2,248 patients presenting with headache, suggestive of subarachnoid hemorrhage, who received lumbar punctures following normal computed tomography of the head, Acad Emerg Med, 2015;22:1267-1273
- (en) Blood-stained cerebrospinal fluid: traumatic puncture or haemorrhage?, Buruma OJS, Janson HL, Den Bergh FA, Bots GTAM, J Neurol Neurosurg Psychiatry 1981;44:144–7.
- Perry JJ, Spacek A, Forbes M et al. Is the combination of negative computed tomography result and negative lumbar puncture result sufficient to rule out subarachnoid hemorrhage?, Ann Emerg Med, 2008;51:707-713
- Connolly ES Jr, Rabinstein AA, Carhuapoma JR et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association, Stroke, 2012;43:1711-1737
- (en) Effect of oral nimodipine on cerebral infarction and outcome after subarachnoid haemorrhage: British aneurysm nimodipine trial, Pickard JD, Murray GD, Illingworth R, et al. BMJ 1989;298:636–42.
- Hillman J, Fridriksson S, Nilsson O, Yu Z, Saveland H, Jakobsson KE, Immediate administration of tranexamic acid and reduced incidence of early rebleeding after aneurysmal subarachnoid hemorrhage: a prospective randomized study, J Neurosurg, 2002;97:771-778
- « SFAR - Hémorragies méningées », sur www.sfar.org (consulté le )
- Dorhout Mees SM, Rinkel GJ, Feigin VL et al. Calcium antagonists for aneurysmal subarachnoid haemorrhage, Cochrane Database Syst Rev, 2007;3:CD000277-CD000277
- (en) Effectiveness of neurosurgical clip application in patients with aneurysmal subarachnoid hemorrhage, Brilstra EH, Algra A, Rinkel GJE, Tulleken CAF, van Gijn J, J Neurosurg 2002;97:1036–41.
- Naidech AM, Janjua N, Kreiter KT et al. Predictors and impact of aneurysm rebleeding after subarachnoid hemorrhage, Arch Neurol, 2005;62:410-416
- Dorsch NW, King MT, A review of cerebral vasospasm in aneurysmal subarachnoid haemorrhage. I. Incidence and effects, J Clin Neurosci, 1994;1:19-26
- Lucke-Wold BP, Logsdon AF, Manoranjan B et al. Aneurysmal subarachnoid hemorrhage and neuroinflammation: a comprehensive review, Int J Mol Sci, 2016;17:497-497
Voir aussi
Article connexe
- Portail de la médecine
- Portail de l’hématologie
- Portail des neurosciences