Hépatite C
L'hépatite C est une maladie infectieuse transmissible par le sang et due au virus éponyme. L'hépatite (inflammation du foie) est le plus souvent asymptomatique et d'évolution chronique. La gravité des hépatites C est variable et peut aller d’une forme bénigne, d’une durée limitée à quelques semaines, à une maladie grave chronique pour la vie si elle n'est pas traitée. L’hépatite C est une cause majeure du cancer du foie. L'infection risquant d'évoluer vers une cirrhose (fibrose cicatricielle et dysfonctionnement du foie) voire un cancer du foie.
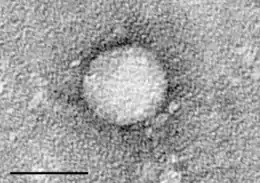
| Causes | Virus de l'hépatite C |
|---|---|
| Symptômes | Nausée, ictère, vomissement, fatigue, douleur abdominale, arthralgie, anorexie, ascite, cirrhose, cancer, hépatite, hypertension portale et Caput medusae |
| Traitement | Antiviral et transplantation hépatique |
|---|---|
| Médicament | Ribavirine, glecaprevir/pibrentasvir (en), ledipasvir/sofosbuvir (en), sofosbuvir, elbasvir/grazoprevir (en), velpatasvir/sofosbuvir (en), boceprevir, telaprevir, siméprévir, ritonavir, peginterféron alfa-2b, peginterféron alfa-2a, ombitasvir/paritaprevir/ritonavir (en), daclatasvir, bicyclol (d), siméprévir, ribavirine, grazoprévir (en) et Ledipasvir |
| Spécialité | Infectiologie |
| CIM-10 | B17.1, B18.2 |
|---|---|
| CIM-9 | 070.70,070.4, 070.5 |
| OMIM | 609532 |
| DiseasesDB | 5783 |
| MedlinePlus | 000284 |
| eMedicine |
177792 ped/979 |
| MeSH | D006526 |
| Patient UK | Hepatitis-c-pro |
![]() Mise en garde médicale
Mise en garde médicale
On estime que 71 millions de personnes sont porteurs chroniques de l’hépatite C, essentiellement infectés par transfusion de sang non soumise à un dépistage et la réutilisation d'aiguilles et de seringues non stériles. La prévention repose essentiellement sur le contrôle des produits sanguins à usage médical et sur l'utilisation de matériel à usage unique pour les prélèvements et injections.
L'infection peut être traitée par l'administration de médicaments anti-viraux. Depuis 2011, de nouveaux médicaments permettent de guérir de l'infection chez plus de 95 % des malades. Le risque de développement ultérieur d'un cancer du foie dépend des dommages que le foie a subi durant l'infection en plus d'autres facteurs (alcoolisme, médicaments…). L’accès au diagnostic et au traitement reste cependant limité dans le monde.
Histoire
Au milieu des années 1970, Harvey J. Alter, responsable de la section des maladies infectieuses au département de médecine transfusionnelle des National Institutes of Health (NIH), a démontré avec son équipe que la plupart des cas d’hépatite post-transfusionnelles n’étaient pas dus au virus de l’hépatite A ni à celui de l’hépatite B. Malgré cette découverte, les efforts de recherche coordonnés au niveau international pour identifier le virus responsable de cette maladie, initialement baptisée « hépatite non A non B » (NANBH en anglais), sont restés sans résultat pendant une décennie. En 1987, Michael Houghton, Qui-Lim Choo, et George Kuo de la Chiron Corporation, en collaboration avec le Dr DW Bradley du CDC, ont utilisé une nouvelle approche de clonage moléculaire pour identifier l'organisme inconnu[1]. En 1988, l’existence du virus a été confirmée par Alter qui a vérifié sa présence chez un groupe de patients atteints d'hépatite non A non B. En , la découverte du virus, connu maintenant sous le nouveau nom de virus de l'hépatite C (VHC), a fait l’objet d’une publication dans deux articles de la revue Science[2],[3].
Chiron a déposé plusieurs brevets sur le virus et ses méthodes de diagnostic sérologique[4]. Une demande de brevet concurrente déposée par le CDC a été abandonnée en 1990 après que Chiron a payé 1,9 million de dollars au CDC et 337 500 USD à Bradley. En 1994, Bradley a poursuivi Chiron, pour faire invalider le brevet, se considérant lui-même comme co-inventeur, et demandant à recevoir des dommages et intérêts et des royalties. Il a renoncé en 1998 après avoir perdu devant une cour d'appel[5].
En 2000, les docteurs Alter et Houghton ont reçu le prix Lasker pour leurs travaux novateurs qui ont abouti à la découverte du virus de l'hépatite C et au développement de méthodes de dépistage permettant de réduire les risques d’hépatite post-transfusionnelle aux États-Unis de 30 % dès 1970 et à le réduire à un niveau proche de zéro en 2000[6].
En 2004, Chiron a obtenu 100 brevets dans 20 pays atteints par l'hépatite C et a poursuivi avec succès devant les tribunaux de nombreuses entreprises qui avaient utilisé illégalement son procédé. Les scientifiques et les concurrents se sont plaints que la société entravait la lutte contre l'hépatite C en exigeant des redevances trop élevées pour utiliser sa technique[5].
Du fait de leur coût et de leur restriction dans les pays occidentaux, certains médicaments comme le sofosbuvir (Sovaldi) fabriqués en génériques en Inde entraînent la création de réseaux de vente parallèles, voire des déplacements des patients vers l'inde pour obtenir les médicaments désirés[7]. Le coût de certains de ces médicaments suscite la mobilisation de plusieurs associations basées sur le bénévolat de professionnels de la santé[8],[9].
En 2020, Alter, Houghton et Charles M. Rice ont conjointement reçu le Prix Nobel de physiologie ou médecine pour leur travaux amenant à la découverte du virus de l'hépatite C[10].
Virologie
Le virus de l'hépatite C (VHC) est un petit virus à ARN d’environ 60 nanomètres de diamètre, enveloppé et contenu dans une capside protéique icosaédrique. Son génome est un ARN monocaténaire linéaire de polarité positive. Il existe six grands génotypes du virus de l'hépatite C, qui sont indiqués par un nombre (par exemple, le génotype 1, le génotype 2, etc.)
Le virus a été classé dans la famille des Flaviviridae qui se compose de trois genres :
- les Flavivirus, responsables d'arboviroses,
- les Pestivirus (en), qui ne causent de pathologies que chez les cétartiodactyles,
- le VHC (virus de l'hépatite C), qui est le seul membre connu du genre des Hepacivirus.
Génotypes
Le VHC est une grande famille, ce virus à ARN a une variété de génome assez importante. Il existe huit principaux génotypes, noté de 1 à 7, et de nombreux sous-types. Ces génotypes ne sont pas responsables d'évolutions significativement différentes de l'hépatite. Quel que soit le génotype, la guérison grâce aux nouveaux traitements AAD (anti-viraux directes) est obtenue dans plus de 97 % des cas en 8 à 12 semaines[11].
Signes et symptômes
Le virus peut rester plusieurs années à l'état latent. Le patient est alors ce qu'on appelle un porteur sain, c'est-à-dire qu'il n'a aucun symptôme, mais peut transmettre la maladie. Le danger est que de nombreux patients sont infectés par le virus sans le savoir, et peuvent donc contaminer leurs proches. D'où l'importance du dépistage pour tous.
Quand la maladie se déclare, elle peut avoir plusieurs conséquences parmi lesquelles la survenue d'une cirrhose (affection chronique du foie). Le virus favorise également le cancer du foie (10 % des cas). Généralement, l’hépatite C ne produit aucun signe ou symptôme au cours de ses premiers stades. Lorsque les signes et symptômes se présentent, ils sont généralement bénins et grippaux et peuvent inclure :
- de la fatigue ;
- de la fièvre ;
- des nausées ;
- des vomissements ;
- des pertes d’appétit ;
- des douleurs musculaires ;
- des douleurs articulaires ;
- une sensibilité au niveau de la zone abdominale où se trouve le foie ;
- un ictère (jaunissement de la peau et du blanc des yeux) ;
- une coloration grisâtre des fèces ;
- une coloration sombre des urines.
Les premières études de charge virale chez onze porteurs asymptomatiques de l’hépatite C ont montré que la charge virale dans le plasma sanguin variait de 100/ml à 50 000 000/ml[12].
Hépatite C aiguë
Après la contamination et une phase d'incubation d'environ sept semaines[13] survient la phase aiguë de l'infection.
La phase de l'hépatite C aiguë désigne la période allant du début de l'infection jusqu'aux six premiers mois. Cette phase est asymptomatique (sans symptôme) dans 60 à 70 % des cas. Chez une minorité de patients on retrouve des symptômes non spécifiques, tels qu'une perte de l'appétit, un état de fatigue, des douleurs abdominales, un état pseudo grippal, un prurit[14] ou un ictère. La durée des symptômes est, en règle générale, inférieure à trois mois[13].
Le virus de l'hépatite C est habituellement détectable dans le sang une à trois semaines après le début de l'infection, et les anticorps contre le virus apparaissent généralement en moins de 3 à 12 semaines.
Au cours de cette phase :
- environ 20 à 30 % des personnes infectées éliminent spontanément le virus, comme en témoigne la normalisation des niveaux des enzymes hépatiques telles que l’alanine aminotransférase (ALAT) et l’aspartate aminotransférase (ASAT), ainsi que la disparition du plasma de l’ARN du VHC (phénomène connu sous le nom d’élimination « spontanée » du virus). Attention, le virus n'est plus détectable mais est toujours présent dans l'organisme ;
- environ 70 à 80 % des personnes infectés évoluent vers une hépatite C chronique, c'est-à-dire, une infection persistant plus de six mois[15],[16],[17].
Les formes gravissimes, dites « fulminantes », sont rarissimes et se retrouvent essentiellement chez des patients déjà infectés avec le VHB, ou après une surinfection par le VHA.
Hépatite C chronique
L'hépatite C chronique est définie par une infection persistant depuis plus de six mois. Cliniquement, cette maladie est souvent asymptomatique et généralement de découverte fortuite. Les complications de l'hépatite chronique vont apparaître 20 ou 30 ans après phase aiguë.
L’évolution naturelle de l'hépatite chronique C varie considérablement d'une personne à l'autre. Pratiquement toutes les personnes infectées par le VHC présentent des signes d’inflammation à la biopsie hépatique ; le taux de progression vers la cicatrisation des lésions du foie (fibrose) est toutefois très variable selon les individus.
L'évolution sans traitement se fait :
- dans un tiers des cas vers une hépatite chronique modérément active ou très active qui peut aboutir à une cirrhose en 10 à 20 ans. Parmi ces cas, certains développeront un carcinome hépato-cellulaire, ou cancer primitif du foie ;
- dans un autre tiers vers une hépatite chronique peu active qui peut soit ne pas évoluer, soit aboutir à une cirrhose après 30 ans ;
- le reste des patients semblent avoir une fibrose qui progresse si lentement qu'ils ont peu de chances de développer une cirrhose dans le cours normal de leur vie.
L’évolution de l'infection dépend de facteurs aggravants tels que l'âge, le sexe (chez les hommes la progression de la maladie est plus rapide que chez les femmes), la consommation d’alcool, la stéatose hépatique, l’excès de poids, la co-infection par le VIH (associée à une nette augmentation du taux de progression de la maladie) et le type de virus (parmi les six génotypes identifiés).
Les symptômes évocateurs d'une maladie du foie sont généralement absents jusqu'à la cicatrisation des lésions hépatiques. Toutefois, l'hépatite C est une maladie systémique et les patients peuvent présenter une grande variété de manifestations cliniques allant de l'absence totale de symptômes à une maladie avérée, jusqu’au développement d’une maladie hépatique avancée. Les signes et les symptômes associés à une hépatite C chronique, sont une fatigue, une perte de poids importante, un état pseudo-grippal, des douleurs musculaires, des douleurs articulaires, une fièvre peu élevée et intermittente, des démangeaisons, des troubles du sommeil, des douleurs abdominales (en particulier dans le quadrant supérieur droit), des troubles de l'appétit, des nausées, de la diarrhée, des troubles dyspeptiques, des troubles cognitifs, des troubles dépressifs, des maux de tête, et des sautes d'humeur.
Lorsque l'hépatite C chronique a atteint le stade de cirrhose, les signes et les symptômes qui peuvent apparaître sont généralement provoqués par une altération des fonctions hépatiques ou une augmentation de la pression dans la circulation sanguine intra-hépatique, une affection connue sous le nom d'hypertension portale. Les signes et les symptômes d’une possible cirrhose sont l’ascite (accumulation de liquide dans la cavité péritonéale de l'abdomen), des ecchymoses et une tendance aux saignements, des douleurs osseuses, des varices œsophagiennes (dilatation des veines, en particulier à la jonction de l'estomac et de l'œsophage), l’émission de selles graisseuses (stéatorrhée), un ictère, et un syndrome de déficience cognitive connu sous le nom d’encéphalopathie hépatique.
Les tests de la fonction hépatique montrent une élévation plus ou moins importante des ALAT, des ASAT[précision nécessaire] et des gamma glutamyl transpeptidase (gamma GT) et périodiquement ils peuvent montrer des résultats normaux. Habituellement le taux de prothrombine et de sérum albumine sont normaux. Il n’y a pas de corrélation entre le niveau d'élévation des enzymes hépatiques et l’importance de l’atteinte hépatique à la biopsie. Le génotype viral et la charge virale ne sont pas non plus en corrélation avec la gravité de l'atteinte hépatique. La biopsie du foie est le meilleur test diagnostic pour déterminer l’étendue des cicatrices et de l'inflammation ; il existe deux solutions: le fibrotest sous la forme d'une simple prise de sang et le fibro-scan qui permet d'évaluer le niveau de fibrose en fonction de l'élasticité du tissu hépatique. Les examens d’imagerie médicale comme l'échographie ou la tomodensitométrie ne montrent pas d’atteinte hépatique avant que la maladie ne soit très évoluée.
L'hépatite C chronique, davantage que d'autres formes d'hépatite, est souvent diagnostiquée en raison de manifestations extra-hépatiques associées à la présence du virus de l'hépatite C qui sont maintenant bien connues[18]. Parmi ces manifestations on peut rencontrer une thyroïdite (inflammation de la thyroïde) avec hyperthyroïdie, une hypothyroïdie, une porphyrie cutanée tardive, une cryoglobulinémie (une forme de vascularite)[19] et une glomérulonéphrite (inflammation des reins), en particulier une glomérulonéphrite membranoproliférative[20]. L'hépatite C est également associée à l’ophtalmorhinostomatoxérose, à la thrombocytopénie, au lichen plan, au diabète sucré et au syndrome lymphoprolifératif à cellules B[21].
Diagnostic biologique
Le diagnostic de l'hépatite C est rarement fait au cours de la phase aiguë de la maladie parce que la majorité des personnes infectées ne présente aucun symptôme apparent au cours de cette phase de la maladie. Ceux qui présentent une phase aiguë symptomatique sont rarement suffisamment malades pour être amenés à consulter un médecin. Les signes sont, par ailleurs très souvent non spécifiques.
L'hépatite C peut être suspectée sur la base des antécédents médicaux (notamment en cas d’antécédents d'échange de matériel de drogues par voie IV ou par inhalation de substances telle que la cocaïne), de certains symptômes, ou des anomalies des enzymes hépatiques ou de la fonction hépatique au cours des tests sanguins de routine. De temps en temps, l'hépatite C est diagnostiquée à l’occasion d’un dépistage ciblé pour le don de sang, la grossesse (les donneurs de sang font l’objet d’un dépistage pour de nombreuses maladies transmissibles par le sang y compris l'hépatite C) ou d’une enquête après un contact supposé avec le virus.
Sérologie
Les tests pour l'hépatite C commencent par des tests sérologiques, des tests sanguins permettant de détecter les anticorps anti-VHC. Ces derniers apparaissent vers la sixième semaine après la contamination[22]. Globalement, le dosage des anticorps anti-VHC possède une forte valeur prédictive positive pour caractériser l’exposition au virus de l'hépatite C, mais il peut laisser passer des patients qui n'ont pas encore développé d’anticorps (séroconversion), ou ont un niveau d'anticorps insuffisant pour pouvoir être détecté. Rarement, il existe des personnes infectées par le VHC qui ne développeront jamais d’anticorps contre le virus et donc, n’auront jamais de test positif au dosage des anticorps anti-VHC. En raison de cette possibilité, la recherche d'ARN viral (voir ci-dessous méthodes d’analyses de l'acide nucléique) devrait être proposée lorsque la recherche d'anticorps est négative, mais qu’il existe une suspicion élevée d'hépatite C (en raison par exemple de l’élévation des transaminases (ALAT) chez quelqu'un qui présente des facteurs de risque pour l'hépatite C).
En l’absence de signes cliniques ou de notion d’exposition à un risque le diagnostic biologique d'hépatite C se limite à la mise en évidence des anticorps anti-HCV par un test de dépistage. Si ce test est négatif, le sujet n'a jamais été en contact avec le virus. Si ce test de dépistage est positif, il faudra le contrôler sur un second prélèvement sanguin et utiliser une autre technique de détection des anticorps. Lorsque les deux tests sont positifs, le sujet a été en contact avec le virus et possède des anticorps qui ne sont malheureusement pas protecteurs contre une éventuelle nouvelle infection. L'hépatite virale C a pu toutefois être guérie spontanément.
Le taux d'anticorps ne semble pas être corrélé avec les chances de guérison[23]. Cet échec de l'immunité humorale naturelle peut être expliqué, au moins partiellement, par un taux de mutation important concernant les antigènes du virus[24]. L'immunité cellulaire a un rôle au moins aussi important, dans la lutte de l'organisme contre le VHC.
En pratique, lors d'un tableau d'hépatite aiguë, idéalement, une première sérologie doit être faite rapidement, complétée par un second dosage quelques semaines plus tard : l'augmentation importante du taux d'anticorps anti VHC entre les deux dosages (séroconversion) permet de signer la contamination récente. Il est fait de même en cas de contamination possible, par exemple après une piqûre accidentelle par une aiguille potentiellement souillée.
Recherche du virus
La présence d’anti-anticorps anti-VHC pour les sujets ayant deux tests de dépistage positifs (ou des tests discordants), révèle une exposition au virus, mais ne permet pas de déterminer s'il s’agit d’une infection en cours ou d’une infection ancienne qui a pu guérir spontanément. Toutes les personnes ayant des anti-anticorps anti-VHC positifs doivent faire l'objet de tests supplémentaires pour rechercher la présence du virus de l'hépatite C lui-même afin de déterminer si l'infection est en cours d’évolution. La présence du virus est recherchée par l'utilisation de méthodes de test des molécules d’acides nucléiques tels que la Réaction en chaîne par polymérase (PCR), ou d’autres techniques d’amplification. Si cette recherche est positive, le sujet est infecté par le virus. Si cette recherche est négative, il a éliminé le virus (guérison spontanée) et n'est plus infecté. Ce dernier cas, représente un peu moins d'un tiers des cas. La majorité des sujets reste infecté de manière chronique par le virus (absence de guérison après 6 mois).
Tous les tests moléculaires sur les acides nucléiques du virus de l'hépatite C ont la capacité de détecter non seulement la présence du virus, mais aussi de mesurer la quantité de virus présent dans le sang (charge virale du VHC). Cette dernière est un facteur important pour déterminer la probabilité de réponse au traitement par l'interféron, mais ne permet pas d’évaluer la gravité de la maladie, ni son risque d'aggravation. Le suivi de la charge virale HCV permet de contrôler l'efficacité du traitement conjointement avec le dosage des transaminases (ALAT). L'objectif est la guérison avec une charge virale HCV indétectable 6 mois après l'arrêt du traitement.
Chez les personnes pour lesquelles l'infection par le VHC est confirmée, la détermination du génotype est généralement recommandée. La connaissance de ce dernier sert à déterminer la durée requise du traitement et d’évaluer les chances de réponse au traitement par l'interféron. Le génotypage du virus est le plus souvent réalisé par séquençage (ou hybridation) d'une région du génome viral.
Transmission
_US.png.webp)
La transmission du virus de l'hépatite C (VHC) est parentérale, c'est-à-dire qu’il se transmet par une autre voie que celle du tube digestif. Dans les pays développés, 90 % des personnes porteuses d'infection chronique par le virus de l'hépatite C ont été infectées par la transfusion de sang ou de produits sanguins non testés ou par usage de drogues par injection ou de drogues par inhalation.[25] Dans les pays en développement, les premières sources d'infection par le VHC sont le matériel d'injection non stérilisé et la transfusion de sang ou de produits sanguins mal testés.
Bien que l'utilisation de drogues injectables et l’administration de sang ou de produits sanguins infectés soient les voies de transmission les plus répandues de l’infection par le VHC, toute pratique, activité ou situation qui implique un contact de sang à sang peut potentiellement être une source d'infection par le VHC. Le virus peut se transmettre par « voie sexuelle » s'il y a contact de sang à sang, mais cette éventualité est rare et, en général, ne se produit qu’en cas d’association avec une MST (comme le VIH), de rapports sexuels anaux ou pendant les règles, ce qui augmente la probabilité de contact avec le sang[26].
Plusieurs activités et plusieurs pratiques ont été identifiées comme des sources potentielles d'exposition au virus de l'hépatite C. Toute personne qui peut avoir été exposée au virus de l'hépatite C dans une ou plusieurs de ces circonstances devrait subir des examens pour dépister une éventuelle hépatite C.
Utilisation de drogues par voie injectable
Les personnes qui utilisent ou ont utilisé des drogues en injection intraveineuse ainsi que celles qui sont impliquées dans le circuit de fourniture de drogues illicites sont plus exposées à contracter l'hépatite C parce qu'ils peuvent partager les aiguilles ou d'autres ustensiles utilisés par les toxicomanes (y compris les réchauds, le coton, les cuillères, l'eau, etc.), qui peuvent avoir été contaminés par du sang infecté par le virus de l'hépatite C. On estime que 60 % à 80 % de tous les utilisateurs de drogues injectables aux États-Unis ont été infectés par le VHC. Les stratégies de réduction des risques sont encouragés dans de nombreux pays pour réduire la propagation de l'hépatite C, par l'éducation, la fourniture d'aiguilles et de seringues, et la promotion de techniques d'injection sûres.
Usage de drogues par voie nasale (drogues qui sont « sniffées »)
Les chercheurs ont suggéré que la transmission du VHC pouvait être possible par inhalation nasale de drogues illégales comme la cocaïne et les cristaux de méthamphétamine lorsque les pailles (contenant des traces de mucus et de sang) sont partagées entre les utilisateurs[27].
Produits sanguins
La transfusion sanguine, l’administration de produits sanguins, ou la transplantation d'organes avant la mise en œuvre du dépistage du VHC (aux États-Unis, cela concerne les procédures utilisées avant 1992) est un facteur de risque d'hépatite C en voie de régression.
Le virus a été isolé pour la première fois en 1989 et les tests de dépistage fiables de ce virus n'ont pas été disponibles avant 1992. Par conséquent, ceux qui reçurent du sang ou des produits sanguins avant la mise en œuvre du dépistage du VHC dans les produits sanguins labiles (globules rouges, plasmas, plaquettes) ont été exposés au virus. Les produits sanguins stables comprennent principalement l'albumine, les facteurs de coagulation (pour les hémophilies, entre autres), les immunoglobulines. Un traitement par solvant-détergent (traitement S.D) de ces produits a permis d'inactiver le virus après 1987. En 2001, le Center for Disease Control and Prevention (CDC) ont indiqué que le risque d'infection du VHC par transfusion aux États-Unis était de moins d’un cas par million d'unités transfusées. Maintenant, en France, les dons de sang sont également testés en biologie moléculaire.
Ce n'est pas le cas dans d'autres pays où le dépistage systématique des donneurs n'est pas effectif. En Inde, par exemple, à la fin des années 1990, seuls 6 % des donneurs ont été testés pour l'hépatite C[28]. La transmission par du matériel médical mal stérilisé reste une réalité dans les pays en voie de développement[29].
Exposition au cours de soins médicaux ou dentaires
Les personnes peuvent être exposées au virus de l'hépatite C par l'intermédiaire d’instruments médicaux ou dentaires mal stérilisés. Parmi le matériel qui peut être souillé par du sang contaminé, s’il est mal stérilisé, on compte les aiguilles ou les seringues, le matériel d'hémodialyse, les instruments dentaires et d’hygiène bucco-dentaire, etc. L’utilisation de techniques scrupuleuses de stérilisation et d'élimination du matériel usagé peut réduire le risque d'exposition iatrogène au virus de l'hépatite C pratiquement à zéro.
Exposition professionnelle au sang
Les professionnels des soins médicaux et dentaires, les intervenants de premiers secours (par exemple, les pompiers, les ambulanciers, le personnel des services médicaux d'urgence, les agents des services de police), les militaires et les combattants peuvent être exposés au virus de l'hépatite C par le biais d’une exposition accidentelle au sang à l’occasion de piqûres accidentelles ou d’éclaboussures de sang sur les yeux ou des plaies ouvertes. Les mesures universelles de protection contre les risques de tels accidents permettent de réduire très sensiblement le risque d'exposition au VHC.
Exposition au sang au cours des loisirs
Les sports de contact et d'autres activités, telles que la « slam dance » peuvent entraîner une exposition par contact accidentel de sang à sang, source potentielle d'exposition au VHC[30].
Exposition sexuelle
La transmission sexuelle du VHC est considérée comme une éventualité rare (moins de 5 % des cas). Des études montrent que le risque de transmission sexuelle dans les relations hétérosexuelles monogames est extrêmement faible, voire nul[31],[32]. Le CDC ne recommande pas l'utilisation de préservatifs entre partenaires vivant en couple monogame stable (lorsqu’un des partenaires est positif et l'autre est négatif)[33]. Toutefois, en raison de la forte prévalence de l'hépatite C, ce risque faible est susceptible de se traduire par un nombre non négligeable de cas transmis par voie sexuelle. Les rapports sexuels avec pénétration vaginale comporteraient un risque plus faible de transmission par rapport aux pratiques sexuelles qui impliquent un risque plus élevé de traumatisme des muqueuses ano-génitales (rapports sexuels avec pénétration anale, fist-fucking, utilisation de jouets sexuels)[34].
Piercings et tatouages
Les tatouages à base de colorants ou d'encre, le port de stylets et de piercing peuvent transmettre l'hépatite C d'une personne à une autre par le sang infecté si des techniques de stérilisation correctes ne sont pas respectées. Les tatouages ou piercing réalisés avant le milieu des années 1980, « Underground », ou non professionnels sont particulièrement préoccupantes, car les techniques de stérilisation dans de tels contextes peuvent avoir été insuffisantes pour prévenir la maladie.
Partage d’articles de soins personnels
Les articles de soins personnels tels que rasoirs, brosses à dents, ciseaux à ongles, et d'autres instruments de manucure ou pédicure peuvent être facilement contaminés par du sang. Le partage de ces objets peut exposer au VHC.
Le VHC n’est pas propagé par simple contact comme étreintes, baisers, partage de nourriture ou d'ustensiles de cuisine.
Transmission verticale (mère à enfant)
Le terme de transmission verticale désigne la transmission d'une maladie infectieuse de la mère à son enfant pendant l’accouchement. La transmission de l'hépatite C de la mère à l’enfant a bien été décrite, mais elle se produit relativement rarement et uniquement chez les femmes qui sont positives pour l’ARN du VHC au moment de la délivrance, le risque de transmission dans ce contexte étant d'environ 6 %[35]. Comme pour la transmission par voie sexuelle il est directement proportionnel à la virémie (quantité de virus circulant). Parmi les femmes qui sont séropositives à la fois pour le VHC et pour le VIH au moment de l'accouchement, le risque de transmission au nouveau-né de hépatite C est d’environ 25 %[36].
Le risque de transmission verticale du virus de l'hépatite C ne semble pas être associé à un mode particulier d’accouchement ou à l'allaitement. Une césarienne ne semble donc pas prévenir le risque de transmission. Curieusement, il est nettement plus élevé si le nouveau-né est une fille[37].
Épidémiologie
La prévalence de l'hépatite C est difficile à estimer car elle survient sans signe apparent dans une forte proportion des cas ce qui tend à faire sous-estimer les chiffres réels, sauf à faire des études basées sur des sérologies faites systématiquement.
En 1999, l'hépatite C infectait selon l'OMS environ 170 millions de personnes dans le monde[38]. L'estimation est aujourd'hui de 200 millions de personnes, ce qui provoque environ 700 000 morts par an dans le monde[39].
Aux États-Unis au début des années 1990, près de 4 millions de personnes étaient probablement touchées[40]. 35 000 à 185 000 nouveaux cas environ surviennent chaque année aux États-Unis. La co-infection par le VIH est fréquente et le taux d’infection parmi les populations VIH positives est plus élevé. 10 000 à 20 000 décès par an aux États-Unis sont dus au virus de l'hépatite C; on s’attend à ce que le taux de mortalité augmente, tant que n’auront pas été repérées toutes les personnes qui ont été infectées à l’époque où les tests sérologiques pour le virus de l'hépatite C n’étaient pas encore pratiqués avant toute transfusion.
Au début des années 2000, une enquête a montré que la prévalence pouvait atteindre 34 % chez les détenus de Californie[41]; 82 % des sujets chez qui on a diagnostiqué une hépatite C ont fait un séjour en prison[42], et la transmission en prison a été bien décrite[43].
Suivant les régions, sa prévalence varie de 0,5 % à 6 % de la population (< 0,5 % en France en 2011[44], 2 % au Japon). Mais depuis, de nombreux patients ont été guéris et en 2018 on estime à environ 110 000 le nombre de personnes infectées par elle VHC (référence : Melin P et al. AASLD2018). On estime à environ 1500 le nombre de nouvelles infections chaque année en France. En 2001, 2 650 décès ont été imputés à l’hépatite C en France[45].
L’Égypte est le pays qui a le taux de séroprévalence du VHC le plus élevé, jusqu’à 20 % dans certaines régions. Une hypothèse est que cette forte prévalence serait liée à une campagne, maintenant interrompue, de traitement de masse de la bilharziose, qui est endémique dans ce pays[46]. Indépendamment de cause initiale de l'épidémie, un taux élevé de transmission du VHC persiste en Égypte, à la fois d’origine iatrogénique et par transmission communautaire familiale.
La séroprévalence de l'hépatite C chez les enfants et les adolescents est de 0,2 à 0,4 %[réf. nécessaire].
L'incidence a augmenté jusque dans les années 1980 puis tend à décroître, au moins dans les pays industrialisés[47].
En 2017, l'OMS, grâce à des analyses se basant non plus sur la recherche d'anticorps mais sur la preuve de présence d'ARN viral a pu revoir son estimation (à la baisse)[48]. Il y aurait 71 millions de porteurs du virus en 2015 et non pas 130 à 150 millions qui serait à l'origine de 440 000 morts chaque année. Il y aurait aussi 257 millions de nouveaux infectées par le virus de l’hépatite B (HBV), nombre presque identique aux estimations antérieures. Le virus C et B ne sont pas liés, mais tous deux sont discrets et persistant durant des décennies, et pouvant induire une cirrhose ou un cancer du foie[49]. Ensemble, ces deux virus sont responsables de 96 % des morts par hépatite et auraient tué 1,34 million de personnes rien qu’en 2015 (environ autant que la tuberculose et plus que le VIH/sida[49].
Co-infection avec le VIH
Aux États-Unis environ 350 000 (soit 35 %) des patients infectés par le VIH sont également infectés par le virus de l'hépatite C, principalement parce que les deux virus sont transmis par le sang et présents dans les mêmes populations. Dans d'autres pays, la co-infection est moins fréquente (environ 25 % en France[50]), ce qui peut être lié à des habitudes différentes dans l’usage des drogues.
Le VHC est la principale cause de maladie chronique du foie aux États-Unis. Il a été démontré dans les études cliniques que l'infection par le VIH entraîne une progression plus rapide de l'hépatite chronique C vers la cirrhose et l’insuffisance hépatique et les complications thérapeutiques sont plus fréquentes du fait de la lourdeur des traitements : en 2005, en France, la co-infection par VHC et les complications que cela engendre en font la deuxième à troisième cause de décès non directement liée au VIH[51].
Pronostic
Lors d'une hépatite aiguë, un peu moins d'un tiers des patients élimine spontanément le virus en guérissant de l'hépatite aiguë[23]. Les deux tiers restant évoluent vers une hépatite chronique. Parmi ces derniers, une très faible proportion contrôle spontanément l’infection pour devenir porteuses chroniques de l'hépatite C (0,5 à 0,74 % par an)[52],[53]. La grande majorité des patients atteints n’en guérissent donc pas sans traitement.
La régression d'une cirrhose post hépatite C n'est pas exceptionnelle sous traitement[54].
Traitement
Les formes beignes d'infection par le virus de l'hépatite C (VHC) ne nécessitent pas toujours de traitement. Le virus peut être éliminé par le système immunitaire du malade[55].
Ancien traitement par interféron
Jusqu'en 2011, le traitement de référence de l'hépatite C se faisait avec une combinaison d’interféron alpha pégylée (peginterféron alfa) et d’un médicament antiviral, la ribavirine, pendant une période de 24 ou 48 semaines[56]. Cette durée pouvait être prolongée jusqu'à un an et demi dans les formes avec fibrose évoluée. Les taux de guérison étaient de 70 à 80 % pour les génotypes 2 et 3 et de 45 à 70 % pour les génotypes 1 et 4[57]. Les effets indésirables de ces traitements étaient fréquents, la moitié des personnes présentant des symptômes grippaux et un tiers des problèmes émotionnels[58]. Le traitement pendant les six premiers mois de l'infection était plus efficace que lorsque l'hépatite C était chronique[59]. Chez les personnes atteintes d'hépatite B chronique, le traitement entraîne la réactivation de l'hépatite B dans environ 25 %[60]. Le traitement pouvait être en particulier physiquement éprouvant pour les patients avec des antécédents de toxicomanie ou d'alcoolisme. Ce traitement n'est désormais plus recommandé car trop peu efficace par rapport aux effets secondaires.
Effets secondaires du traitement par interféron
Les effets secondaires de l'ancien du traitement par interféron sont nombreux, varient suivant les personnes, mais disparaissent à la fin du traitement. Dans la plupart des cas, le patient doit cesser toute activité à cause de ces effets : travail, sport, etc.
- Interféron : L'injection d'interféron provoque le syndrome pseudo-grippal : fortes fièvres, courbatures et mal de tête. Les autres symptômes sont la fatigue, les insomnies, la perte des cheveux, la sécheresse de la peau. Un trouble du caractère et un dérèglement de la glande thyroïde peuvent aussi survenir.
- Ribavirine : L'effet secondaire principal est l'anémie: essoufflement, cœur rapide, fatigue…
L'association de ces deux médicaments provoque les effets secondaires indiqués ci-dessus, mais ces effets sont plus fréquents.
Ces effets secondaires apportent d'autres complications :
- sécheresse de la peau, déshydratation avec envie de boire continuelle, éruptions cutanées de toutes tailles et toutes sortes sur tout le corps, conjonctivite provoquée par l'absence de protection de l'œil (larmes) ;
- dépression avec envie de suicide[61].
Les insomnies, ajoutées à la fatigue, peuvent amener un état d'épuisement.
Nouveaux antiviraux
Le traitement de l’hépatite C chronique a été révolutionné par l’introduction à partir de 2011 de nouveaux antiviraux (directly acting antivirals [DAA])[62],[63]. Dans les cas d’infection chronique du VHC, le traitement permet, en 2019, d’obtenir une guérison chez plus de 95 % des patients[55],[64]. Le traitement dure entre 12 et 24 semaines, selon la présence ou non d’une cirrhose[55]. L’accès au traitement dans le monde reste cependant limité. En 2017, sur les 71 millions de personnes infectées, 19% (13,1 millions) d’entre elles avait été diagnostiquées et environ 5 millions avaient reçu un traitement[55]. En effet, bien que la prise en charge médicale précoce soit utile du fait de la gravité potentielle de la maladie, les personnes atteintes d'une infection par le VHC ne sont pas demandeuses d'un traitement car elles présentent souvent des symptômes discrets[65].
Vaccin
Bien qu'on dispose aujourd'hui d'antiviraux très efficaces, la recherche d'un vaccin se poursuit. Mais elle se heurte à de nombreux obstacles immunologiques et virologiques. Les résultats de ces recherches sont aujourd'hui très incertains. [66]
Mesures associées
Les lignes directrices recommandent fortement de vacciner les patients atteints d'hépatite C contre les hépatites A et B, s’ils n’ont pas encore été exposés à ces virus, susceptibles d’aggraver radicalement l’atteinte hépatique.
La consommation de boissons alcoolisées accélère la fibrose et la cirrhose associées au VHC et rend plus probable la survenue d’un cancer du foie. La résistance à l'insuline et le syndrome métabolique peuvent également aggraver le pronostic hépatique. Le tabagisme augmente le taux de fibrose cicatricielle.
Un traitement anti-oxydant a pu donner des résultats dans de rares cas sélectionnés[67].
Pendant la grossesse et l’allaitement
Si une femme enceinte présente des facteurs de risque pour l'hépatite C, elle doit se voir proposer un dépistage par recherche d’anticorps contre le VHC. Environ 4 % des nourrissons nés de femmes infectées par le VHC seront atteints. Le virus se transmet au bébé au moment de la naissance. Il n'existe pas de traitement capable de prévenir cette transmission.
Lorsque la mère est également porteuse du VIH, le taux de transmission peut atteindre 19 %. Il n'existe pas actuellement de données pour déterminer si un traitement antiviral réduit le risque de transmission périnatale. La ribavirine et l’interféron sont contre-indiqués pendant la grossesse. Toutefois, en évitant le monitoring du fœtus par pose d’électrodes sur le cuir chevelu et un travail prolongé après la rupture des membranes, on peut réduire le risque de transmission au nouveau-né.
Les anticorps anti-VHC de la mère peuvent persister chez le nourrisson jusqu'à l'âge de 15 mois. Si un diagnostic précoce est nécessaire, la recherche de l’ARN du VHC peut être effectuée à l’âge de 2 à 6 mois, avec une répétition des tests quel que soit le résultat du premier test. Si un diagnostic plus tardif est préféré, une recherche des anticorps contre le virus de l'hépatite C peut être effectuée après l'âge de 15 mois. La plupart des nourrissons infectés par le VHC au moment de la naissance n'ont pas de symptômes et vont bien pendant l'enfance. Il n'existe aucune preuve que le virus de l'hépatite C se propage par l’Allaitement. Par prudence, une mère infectée devrait éviter l'allaitement si ses mamelons sont fissurés et présentent des saignements[68].
Séquelles
Si un virus (celui de l'hépatite C par exemple) réussit à épuiser la production de lymphocytes cytotoxiques, il peut continuer sa progression dans l'organisme (dans le foie en induisant une cirrhose ou un cancer du foie dans le cas de l'hépatite C, comme l'a récemment montré une équipe d'infectiologues et de spécialistes de l'immunité à l'Institut Pasteur de Shanghai et à l'Institut de Biophysique de l'Académie chinoise des sciences de Pékin)[69],[70],[71]. On ne sait pas encore comment les virus arrivent à épuiser le système des lymphocytes cytotoxiques ni dans quelle mesure cela explique leur degré d'infectiosité[72], mais on sait que l'expression de NKG2A sur les cellules T NK et LT CD8+ entraîne un épuisement fonctionnel des cellules NK et LT CD8+[73]
Prévention et recherche
Les lignes directrices suivantes peuvent permettre de prévenir l'infection par le virus de l'hépatite C, qui se propage par le sang :
- éviter de partager les aiguilles utilisées pour les drogues injectables ou toute autre drogue, y compris celles inhalées avec des pailles ;
- éviter les tatouages dans des conditions d’hygiène défectueuses ;
- éviter les piercings et l’acupuncture dans des conditions d’hygiène douteuses ;
- éviter les blessures par aiguille à injection ;
- éviter le partage des articles personnels comme les brosses à dent, les rasoirs, les coupe-ongles ;
- quoique le risque de transmission soit faible, utiliser des préservatifs en latex pour les rapports sexuels en dehors d’une relation monogame durable[74].
Les tenants de la réduction des risques pensent que les stratégies telles que la fourniture d’aiguilles et de seringues neuves, et l’apprentissage de procédures sécurisées d’injection de drogues sont susceptibles de diminuer le risque de propagation de l'hépatite C entre les consommateurs de drogues injectables.
Il n’existe aucun vaccin préventif ou curatif de l'hépatite C. Des vaccins sont en cours de développement et certains ont donné des résultats encourageants[75]. En 2011, la recherche d'un vaccin avance avec la création de « pseudo-particules » virales (sans matériel génétique) chimériques (à partir de 2 virus, un rétrovirus de souris recouvert de protéines du VHC) utilisées dans une vaccination chez la souris et le macaque. La réaction a conduit, pour la première fois, à la production d'anticorps neutralisant le virus VHC[39].
Données nationales
États-Unis
Aux États-Unis, les personnes qui ont un passé d’usager de drogues par voie intraveineuse, par inhalation, par voie nasale, qui ont eu des tatouages, ou qui ont été exposés au sang au cours de rapports sexuels non protégés ou de pratiques sociales exposées présentent un risque accru pour cette maladie. L'hépatite C est la principale cause de transplantation hépatique aux États-Unis.
Notes et références
- (en) 2000 Albert Lasker Award for Clinical Medical Research, The Lasker Foundation, consulté le 20 février 2008
- (en) Choo Q, Kuo G, Weiner A, Overby L, Bradley D, Houghton M, « Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome », Science, vol. 244, no 4902, , p. 359-62. (PMID 2523562, DOI 10.1126/science.2523562)
- (en) Kuo G, Choo Q, Alter H, Gitnick G, Redeker A, Purcell R, Miyamura T, Dienstag J, Alter M, Stevens C, « An assay for circulating antibodies to a major etiologic virus of human non-A, non-B hepatitis », Science, vol. 244, no 4902, , p. 362-4. (PMID 2496467, DOI 10.1126/science.2496467)
- (en) Houghton M, Q-L Choo et G. Kuo, NANBV Diagnostics and Vaccines Brevet EP 0318216 déposé le 18 novembre 1988.
- (en) Paul Elias. « Hepatitis Drug-Maker Complaints Reviewed » The Associated Press, 27 février 2004.
- (en) 2000 Winners Albert Lasker Award for Clinical Medical Research, The Lasker Foundation, consulté le 20 février 2008.
- , lefigaro.fr, 4 mars 2016
- Hépatite C : plus de rationnement, accès universel aux médicaments génériques !, mediapart.fr, 16 avril 2016
- Hépatite C : bataille pour l’accès à un traitement révolutionnaire, lemonde.fr, 22 janvier 2015
- (en + sv) Comité Nobel, « Communiqué de presse : Le prix Nobel de physiologie ou médecine 2020 », sur https://www.nobelprize.org/, (consulté le )
- « Rapport HAS - Commission de transparence », sur https://www.has-sante.fr, (consulté le )
- (en) Ulrich P, Romeo J, Lane P, Kelly I, Daniel L, Vyas G, « Detection, semiquantitation, and genetic variation in hepatitis C virus sequences amplified from the plasma of blood donors with elevated alanine aminotransferase », J Clin Invest, vol. 86, no 5, , p. 1609-14. (PMID 2173725, DOI 10.1172/JCI114882, lire en ligne)
- (en) Marcellin P, « Hepatitis C: the clinical spectrum of the disease » J Hepatol. 1999;31:9-16
- Dega H, Frances C, Dupin N, Lebre C, Simantov A, Callot C, Chosidow O. et al., « Prurit et virus de l'hépatite C », Annales de dermatologie et de vénéréologie 1998;125(1):9-12.
- (en) Villano SA, Vlahov D, Nelson KE, Cohn S, Thomas DL, « Persistence of viremia and the importance of long-term follow-up after acute hepatitis C infection », Hepatology, vol. 29, no 3, , p. 908–14 (PMID 10051497, DOI 10.1002/hep.510290311)
- (en) Cox AL, Netski DM, Mosbruger T et al., « Prospective evaluation of community-acquired acute-phase hepatitis C virus infection », Clin Infect Dis, vol. 40, no 7, , p. 951–8. (PMID 15824985, DOI 10.1086/428578)
- (en) « NIH Consensus Development Conference on Management of Hepatitis C: 2002 » (consulté le )
- Patrice Cacoub, « Traitement des manifestations extrahépatiques associées au virus de l'hépatite C »,
- (en) Pascual M, Perrin L, Giostra E, Schifferli J, « Hepatitis C virus in patients with cryoglobulinemia type II », J Infect Dis, vol. 162, no 2, , p. 569-70. (PMID 2115556)
- (en) Johnson R, Gretch D, Yamabe H, Hart J, Bacchi C, Hartwell P, Couser W, Corey L, Wener M, Alpers C, « Membranoproliferative glomerulonephritis associated with hepatitis C virus infection », N Engl J Med, vol. 328, no 7, , p. 465-70. (PMID 7678440, DOI 10.1056/NEJM199302183280703)
- (en) Zignego AL, Ferri C, Pileri SA, Caini P, Bianchi FB. for the Italian Association of the Study of Liver (A.I.S.F.) Commission on Extrahepatic Manifestations of HCV infection, « Extrahepatic manifestations of Hepatitis C Virus infection: A general overview and guidelines for a clinical approach », Dig Liver Dis, , E-publication (PMID 16884964)
- (en) Netski DM, Mosbruger T, Depla E et al., « Humoral immune response in acute hepatitis C virus infection », Clin Infect Dis. 2005;41:667-75.
- (en) Maheshwari A, Ray S, Thuluvath Pj, « Acute hepatitis C » Lancet 2008;372:321-32.
- (en) Farci P, Alter HJ, Wong DC. et al., « Prevention of hepatitis C virus infection in chimpanzees after antibody-mediated in vitro neutralization », Proc Natl Acad Sci USA 1994;91:7792-6.
- Philippe Peyre, « Pourquoi l’hépatite C continue de tuer dans le monde ? », Sud-Ouest, (lire en ligne)
- (en) What is hepatitis?, Planification familiale, consulté le 25 mai 2007
- (en) Thompson S, Hernberger F, Wale E, Crofts N, « Hepatitis C transmission through tattooing: a case report », Aust N Z J Public Health, vol. 20, no 3, , p. 317-8. (PMID 8768424)
- (en) Kapoor D, Saxena R, Sood B, Sarin SK, « Blood transfusion practices in India: results of a national survey » Indian J Gastroenterol. 2000 ; 19: 64-67
- (en) Simonsen L, Kane A, Lloyd J, Zaffran M, Kane M, « Unsafe injections in the developing world and transmission of bloodborne pathogens: a review », Bull World Health Organ. 1999;77:789-800
- Karmochkine M, Carrat F, Dos Santos O, Cacoub P, Raguin G, « A case-control study of risk factors for hepatitis C infection in patients with unexplained routes of infection », J Viral Hepat, vol. 13, no 11, , p. 775–82. (PMID 17052278, DOI 10.1111/j.1365-2893.2006.00742.x)
- (en) Vandelli C1, Renzo F, Romanò L, Tisminetzky S, De Palma M, Stroffolini T, Ventura E, Zanetti A. « Lack of evidence of sexual transmission of hepatitis C among monogamous couples: results of a 10-year prospective follow-up study » Am J Gastroenterol. 2004;99(5):855-9.
- (en) « Sexual Transmission of Hepatitis C »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- (en) Hepatitis C: FAQ | CDC Viral Hepatitis
- (en) Hahn JA, « Sex, Drugs, and Hepatitis C Virus », J Infect Dis, vol. 195, , p. 1556–9. (DOI 10.1086/516792)
- (en) Roberts EA, Yeung L, « Maternal-infant transmission of hepatitis C virus infection » Hepatology 2002;36:S106-S113.
- (en) Mast EE, Hwang LY, Seto DS et al. « Risk factors for perinatal transmission of hepatitis C virus (HCV) and the natural history of HCV infection acquired in infancy » J Infect Dis. 2005;192:1880-9.
- (en) European Paediatric Hepatitis C Virus Network, « A significant sex —but not elective cesarean section— effect on mother-to-child transmission of hepatitis C virus infection » J Infect Dis. 2005;192:1872-9.
- (en) WHO. « Hepatitis C—global prevalence (update) » Wkly Epidemiol Rec. 1999;49:421-8.
- "L'hépatite C", Institut National de Prévention et d'Éducation pour la Santé
- (en) Alter MJ, Kruszon-Moran D, Nainan OV et al. « The prevalence of hepatitis C virus infection in the United States, 1988 through 1994 » N Engl J Med. 1999;341:556-62.
- (en) Ruiz J, Molitor F, Plagenhoef J, « Trends in hepatitis C and HIV infection among inmates entering prisons in California, 1994 versus 1999 », AIDS, vol. 16, no 16, , p. 2236-8. (PMID 12409752)
- (en) Campbell J, Hagan H, Latka M, Garfein R, Golub E, Coady M, Thomas D, Strathdee S, « High prevalence of alcohol use among hepatitis C virus antibody positive injection drug users in three US cities », Drug Alcohol Depend, vol. 81, no 3, , p. 259-65. (PMID 16129567, DOI 10.1016/j.drugalcdep.2005.07.005)
- (en) McGovern B, Wurcel A, Kim A, Schulze zur Wiesch J, Bica I, Zaman M, Timm J, Walker B, Lauer G, « Acute hepatitis C virus infection in incarcerated injection drug users », Clin Infect Dis, vol. 42, no 12, , p. 1663-70. (PMID 16705568, DOI 10.1086/504327)
- Santé publique France - InVS, « Autres données épidémiologiques / Hépatite C / Hépatites virales / Maladies infectieuses / Dossiers thématiques / Accueil », sur invs.santepubliquefrance.fr (consulté le )
- INPES, Planète vaccination, , 63 p. (lire en ligne)
- (en) Frank C, Mohamed M, Strickland G, Lavanchy D, Arthur R, Magder L, El Khoby T, Abdel-Wahab Y, Aly Ohn E, Anwar W, Sallam I, « The role of parenteral antischistosomal therapy in the spread of hepatitis C virus in Egypt », Lancet, vol. 355, no 9207, , p. 887-91. (PMID 10752705, DOI 10.1016/S0140-6736(99)06527-7)
- (en) Armstrong GL, Alter MJ, McQuillan GM, Margolis HS, « The past incidence of hepatitis C virus infection: implications for the future burden of chronic liver disease in the United States » Hepatology 2000; 31: 777-82.
- OMS (2017) Rapport : Global hepatitis report, 2017 ; April ; en anglais ; (ISBN 978-92-4-156545-5) ; (résumé, pdf, 755kb et Infographie)
- Cohen J (2017), New report halves the number of people infected with hepatitis C worldwide ; 21 avril
- (en) Larsen C, Pialoux G, Salmon D, Antona D, Le Strat Y, Piroth L. et al. « Prevalence of hepatitis C and hepatitis B infection in the HIV-infected population of France 2004 » Euro Surveill. 2008;13:pii:18888.
- (en) Lewden C1, May T, Rosenthal E, Burty C, Bonnet F, Costagliola D, Jougla E, Semaille C, Morlat P, Salmon D, Cacoub P, Chêne G; ANRS EN19 Mortalité Study Group and Mortavic et al. (560) « Changes in causes of death among adults infected by HIV between 2000 and 2005: The "Mortalité 2000 and 2005" surveys (ANRS EN19 and Mortavic) » J Acquir Immune Defic Syndr. 2008;48(5):590-8. DOI:10.1097/QAI.0b013e31817efb54
- (en) Watanabe H, Saito T, Shinzawa H, Okumoto K, Kawata S et al., « Spontaneous elimination of serum hepatitis C virus (HCV) RNA in chronic HCV carriers: a population-based cohort study », J Med Virol, vol. 71, no 1, , p. 56-61 (PMID 12858409, DOI 10.1002/jmv.10448)
- (en) Scott J, McMahon B, Bruden D, Sullivan D, Homan C, Christensen C, Gretch D, « High rate of spontaneous negativity for hepatitis C virus RNA after establishment of chronic infection in Alaska Natives », Clin Infect Dis, vol. 42, no 7, , p. 945-52 (PMID 16511757, DOI 10.1086/500938)
- (en) Mallet V, Gilgenkrantz H, Serpaggi J et al. « The relationship of regression of cirrhosis to outcome in chronic hepatitis C » Ann Int Med. 2008;149:399-403
- « OMS - Hépatite C », sur http://www.who.int, OMS, (consulté le )
- Thad Wilkins, Jennifer K. Malcolm, Dimple Raina et Robert R. Schade, « Hepatitis C: diagnosis and treatment », American Family Physician, vol. 81, no 11, , p. 1351–1357 (ISSN 1532-0650, PMID 20521755, lire en ligne, consulté le )
- TJ Liang et Ghany, MG, « Current and future therapies for hepatitis C virus infection. », The New England Journal of Medicine, vol. 368, no 20, , p. 1907–17 (PMID 23675659, PMCID 3893124, DOI 10.1056/NEJMra1213651)
- T Wilkins, Malcolm JK, Raina D et Schade RR, « Hepatitis C: diagnosis and treatment », American Family Physician, vol. 81, no 11, , p. 1351–7 (PMID 20521755, lire en ligne [archive du ])
- R Ozaras et Tahan, V, « Acute hepatitis C: prevention and treatment », Expert Review of Anti-infective Therapy, vol. 7, no 3, , p. 351–61 (PMID 19344247, DOI 10.1586/eri.09.8)
- Marcus M Mücke, Lisa I Backus, Victoria T Mücke, Nicola Coppola, Carmen M Preda, Ming-Lun Yeh, Lydia S Y Tang, Pamela S Belperio, Eleanor M Wilson, Ming-Lung Yu, Stefan Zeuzem, Eva Herrmann et Johannes Vermehren, « Hepatitis B virus reactivation during direct-acting antiviral therapy for hepatitis C: a systematic review and meta-analysis », The Lancet Gastroenterology & Hepatology, vol. 3, no 3, , p. 172–180 (PMID 29371017, DOI 10.1016/S2468-1253(18)30002-5)
- J-P Lang, S Schmitter, S Benassi, L Michel « Prise en charge de l’hépatite chronique C : une urgence psychiatrique ? » L'Information Psychiatrique volume 85, numéro 7, p. 629-39, septembre 2009, Addictions
- Netgen, « Hépatite C: traitement actuel », sur Revue Médicale Suisse (consulté le )
- (en) Raymond T. Chung, Stephanie M. Rutledge et Jacinta A. Holmes, « Direct-acting antiviral treatment for hepatitis C », The Lancet, vol. 393, no 10179, , p. 1392–1394 (ISSN 0140-6736 et 1474-547X, PMID 30765125, DOI 10.1016/S0140-6736(18)32326-2, lire en ligne, consulté le )
- « Prise en charge thérapeutique et suivi de l’ensemble des personnes infectées par le virus de l’hépatite C », sur https://solidarites-sante.gouv.fr (consulté le )
- (en) Ryan KJ et Ray CG (editors), Sherris Medical Microbiology, New York, McGraw Hill, (réimpr. 4e éd.), 4e éd. (ISBN 978-0-8385-8529-0, LCCN 2003054180), p. 551-2.
- NEJM DOI: 10.1056/NEJMp2031110 https://www.nejm.org/doi/full/10.1056/NEJMp2031110?query=WB
- (en) Berkson BM., « A conservative triple antioxidant approach to the treatment of hepatitis C. Combination of alpha lipoic acid (thioctic acid), silymarin, and selenium: three case histories. », Med Klin (Munich), (PMID 10554539)
- (en) Mast E, « Mother-to-infant hepatitis C virus transmission and breastfeeding », Adv Exp Med Biol, vol. 554, , p. 211-6. (PMID 15384578)
- (en) Chao Zhang, Xiao-mei Wang, Shu-ran Li et Trix Twelkmeyer, « NKG2A is a NK cell exhaustion checkpoint for HCV persistence », Nature Communications, vol. 10, no 1, , p. 1–11 (ISSN 2041-1723, PMID 30944315, PMCID PMC6447531, DOI 10.1038/s41467-019-09212-y, lire en ligne, consulté le )
- (en) Fenglei Li, Hairong Wei, Haiming Wei et Yufeng Gao, « Blocking the Natural Killer Cell Inhibitory Receptor NKG2A Increases Activity of Human Natural Killer Cells and Clears Hepatitis B Virus Infection in Mice », Gastroenterology, vol. 144, no 2, , p. 392–401 (ISSN 0016-5085 et 1528-0012, DOI 10.1053/j.gastro.2012.10.039, lire en ligne, consulté le )
- (en) Muttiah Barathan, Rosmawati Mohamed, Yean K. Yong et Meganathan Kannan, « Viral Persistence and Chronicity in Hepatitis C Virus Infection: Role of T-Cell Apoptosis, Senescence and Exhaustion », Cells, vol. 7, no 10, , p. 165 (PMID 30322028, PMCID PMC6210370, DOI 10.3390/cells7100165, lire en ligne, consulté le )
- (en) Xiaoqin Guo, Zhongmin Guo, Chaohui Duan et Zeliang chen, « Long-Term Persistence of IgG Antibodies in SARS-CoV Infected Healthcare Workers (pré-print, non encore relue par des pairs, étude rétrospective basée sur un panel de 34 soignants infectés par le SARS 17 ans plus tôt, dont 20 ont été suivis de 2003 à 2015 pour leur taux d'anticorps anti-SARS-CoV-1 dans leur sérum) », MedRxiv, Infectious Diseases (except HIV/AIDS), (DOI 10.1101/2020.02.12.20021386, résumé, lire en ligne, consulté le )
- (en) Meijuan Zheng, Yong Gao, Gang Wang et Guobin Song, « Functional exhaustion of antiviral lymphocytes in COVID-19 patients », Cellular & Molecular Immunology, , p. 1–3 (ISSN 2042-0226, PMCID PMC7091858, DOI 10.1038/s41423-020-0402-2, lire en ligne, consulté le )
- (en) « Hepatitis C: Fact Sheet|CDC Viral Hepatitis » [html], sur www.cdc.gov (consulté le )
- (en) Manns MP, Foster GR, Rockstroh JK, Zeuzem S, Zoulim F, Houghton M, « The way forward in HCV treatment—finding the right path », Nat. Rev. Drug Discov., vol. 6, no 12, , p. 991-1000. (PMID 18049473, DOI 10.1038/nrd2411)
Voir aussi
Articles connexes
Liens externes
- « Hépatite C : un Nobel pour en finir », La Méthode scientifique, France Culture, 26 octobre 2020.
- (en)« Special issue on virology and clinical advances of HCV », International Journal of Medical Sciences, consulté le 27 octobre 2020.
- Portail de la médecine
- Portail de la virologie
- Portail des maladies infectieuses