Hexokinase
Une hexokinase est une phosphotransférase qui catalyse la réaction :
| Hexokinase I | ||
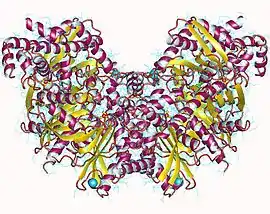 Dimère d'hexokinase I humaine (PDB 1HKC[1]) | ||
| Caractéristiques générales | ||
|---|---|---|
| Nom approuvé | Hexokinase 1 | |
| Symbole | HK1 | |
| N° EC | 2.7.1.1 | |
| Classification | ||
| Pfam | PF00349 | |
| Clan Pfam | CL0108 | |
| InterPro | IPR022672 | |
| PROSITE | PDOC00370 | |
| SCOP | 1cza | |
| SUPERFAMILY | 1cza | |
| Homo sapiens | ||
| Locus | 10q22.1 | |
| Masse moléculaire | 102 486 Da[2] | |
| Nombre de résidus | 917 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Hexokinase II | ||
| Caractéristiques générales | ||
| Nom approuvé | Hexokinase 2 | |
| Symbole | HK2 | |
| N° EC | 2.7.1.1 | |
| Classification | ||
| Pfam | PF03727 | |
| Clan Pfam | CL0108 | |
| InterPro | IPR022673 | |
| PROSITE | PDOC00370 | |
| SCOP | 1cza | |
| SUPERFAMILY | 1cza | |
| Homo sapiens | ||
| Locus | 2p12 | |
| Masse moléculaire | 102 380 Da[2] | |
| Nombre de résidus | 917 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Hexokinase III | ||
| Caractéristiques générales | ||
| Nom approuvé | Hexokinase 3 | |
| Symbole | HK3 | |
| N° EC | 2.7.1.1 | |
| Homo sapiens | ||
| Locus | 5q35.2 | |
| Masse moléculaire | 99 025 Da[2] | |
| Nombre de résidus | 923 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
Cette enzyme cytosolique intervient notamment à la première étape de la glycolyse pour convertir le glucose en glucose-6-phosphate. Le glucose est son principal substrat dans le métabolisme cellulaire normal.
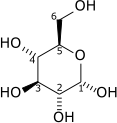 |
+ ATP → ADP + H+ + |  |
| Glucose | Glucose-6-phosphate |
Un cation de magnésium Mg2+ est nécessaire à cette réaction comme cofacteur. Le glucose est le substrat principal de cette enzyme, qui peut cependant phosphoryler tous les hexoses. Ceci permet de dégrader ces hexoses dans tous les tissus où l'hexokinase est présente en les convertissant en fructose-6-phosphate par épimérisation ou isomérisation (comme pour le galactose).
L'hexokinase ne doit pas être confondue avec la glucokinase, qui en est une isoforme spécifique agissant uniquement sur le glucose.
Propriétés générales
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
La réaction de phosphorylation des hexoses est couplée à l'hydrolyse d'une molécule d'ATP. En effet, cette phosphorylation est endergonique dans les conditions cellulaires, donc thermodynamiquement défavorable ; le couplage avec la déphosphorylation de l'ATP (réaction fortement exergonique) permet une réaction-bilan qui est globalement exergonique, et qui devient donc thermodynamiquement favorable :
- (1) Hexose + Pi → hexose 6-phosphate : réaction endergonique (thermodynamiquement défavorable) avec ΔG°’ = 13,8 kJ·mol-1 ;
- (2) ATP → ADP + Pi : réaction exergonique (thermodynamiquement favorable) avec ΔG°’ = −30,5 kJ·mol-1 ;
- (1+2) Hexose + ATP → hexose-6-phosphate + ADP : réaction globale exergonique, avec ΔG°’ = 13,8 – 30,5 = −16,7 kJ·mol-1.
L'hexokinase présente les caractéristiques suivantes :
- Grande affinité pour le glucose, qui se traduit par une constante de Michaelis très basse (KM = 0,1 mM)
- Vitesse maximum Vmax relativement faible
- Inhibition en présence de concentrations élevées de glucose-6-phosphate (rétroinhibition)
L'hexokinase est ainsi adaptée aux besoins des tissus périphériques : optimiser l'absorption du glucose plasmatique pour l'utiliser comme substrat énergétique via la glycolyse, à la différence du foie dont la glucokinase présente une affinité sensiblement moindre et n'est pas inhibée par le glucose-6-phosphate mais par le fructose-6-phosphate.
Isoenzymes des mammifères
Les mammifères possèdent quatre isoenzymes d'hexokinase dont la distribution intracellulaire et la cinétique varient en fonction des substrats et des conditions physiologiques[3],[4]. Ces quatre isoenzymes sont désignées comme hexokinases I, II, III et IV ou comme hexokinases A, B, C et D selon les auteurs.
Hexokinases I, II et III
Les hexokinases I, II et III portent le no EC . Elles sont dites « isoenzymes à faible KM » car elles ont une affinité élevée pour le glucose, d'où une constante de Michaelis inférieure à 1 mM. Elles sont toutes les trois fortement inhibées par le produit de leur réaction, c'est-à-dire le glucose-6-phosphate[5]. Leur masse moléculaire est voisine de 100 kDal. Elles sont formées de deux sous-unités très semblables de 50 kDal chacune, mais l'hexokinase II est la seule à posséder des sites actifs sur ces deux sous-unités. La cinétique des hexokinases I et II suit l'équation de Michaelis-Menten aux concentrations de substrat physiologiques.
- L'hexokinase I, ou hexokinase A, est ubiquitaire, c'est à dire présente dans tous les tissus des mammifères et est considérée comme une enzyme de maintenance qui n'est pas affectée par la plupart des changements physiologiques, hormonaux et métaboliques.
- L'hexokinase II, ou hexokinase B, représente la principale isoforme régulée d'hexokinase d'un grand nombre de cellules et son expression est accrue dans de nombreux cancers[6]. C'est l'hexokinase du muscle et du cerveau. On la trouve également dans les mitochondries, ce qui lui permet d'accéder directement à l'ATP.
- L'hexokinase III, ou hexokinase C, est inhibée par son substrat, le glucose, aux concentrations physiologiques. On sait peu de choses au sujet du mode de régulation de cette isoforme.
Hexokinase IV ou glucokinase
L'hexokinase IV des mammifères, ou glucokinase, est différente des trois autres aussi bien du point de vue de sa cinétique que de sa fonction et porte le no EC . Sa constante de Michaelis pour le glucose est cent fois plus élevée que celle des hexokinases I, II et III, de sorte qu'elle n'est active sur son substrat que lorsque celui-ci est suffisamment concentré. Elle n'est constituée que d'une seule sous-unité dont la masse moléculaire est voisine de 50 kDal. Elle présente une régulation coopérative avec le glucose et n'est pas inhibée allostériquement par le glucose-6-phosphate.
On la trouve dans le foie, le pancréas, l'hypothalamus, l'intestin grêle et peut-être également dans certaines cellules neuroendocrines (en). Elle joue un rôle régulateur important dans le métabolisme des glucides[7]. Elle contrôle la libération de l'insuline dans les cellules β des îlots de Langerhans et la libération du glucagon dans les cellules α[8]. Dans les hépatocytes du foie, elle agit en ajustant la glycogénogenèse pour n'amorcer cette voie métabolique que lorsque le taux de glucose est suffisant pour nécessiter son stockage.
Notes et références
- (en) Alexander E. Aleshin, Chenbo Zeng, Hans D. Bartunik, Herbert J. Fromm et Richard B. Honzatko, « Regulation of hexokinase I: crystal structure of recombinant human brain hexokinase complexed with glucose and phosphate », Journal of Molecular Biology, vol. 282, no 2, , p. 345-357 (PMID 9735292, DOI 10.1006/jmbi.1998.2017, lire en ligne).
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) John E. Wilson, « Isozymes of mammalian hexokinase: structure, subcellular localization and metabolic function », Journal of Experimental Biology, vol. 206, no Pt 12, , p. 2049-2057 (PMID 12756287, DOI 10.1242/jeb.00241, lire en ligne).
- (en) Howard M. Katzen et Robert T. Schimke, « Multiple Forms of Hexokinase in the Rat: Tissue Distribution, Age Dependency, and Properties », Proceedings of the National Academy of Sciences of the United States of America, vol. 54, no 4, , p. 1218-1225 (PMID 5219826, PMCID 219842, DOI 10.1073/pnas.54.4.1218, Bibcode 1965PNAS...54.1218K, lire en ligne).
- (en) Robert K. Crane et Alberto Sols, « The non-competitive inhibition of brain hexokinase by glucose-6-phosphate and related compounds », Journal of Biological Chemistry, vol. 210, no 2, , p. 597-606 (PMID 13211596, lire en ligne).
- (en) S. P. Mathupala1, Y. H. Ko et P. L. Pedersen, « Hexokinase II: Cancer's double-edged sword acting as both facilitator and gatekeeper of malignancy when bound to mitochondria », Oncogene, vol. 25, no 34, , p. 4777-4786 (PMID 16892090, PMCID 3385868, DOI 10.1038/sj.onc.1209603, lire en ligne).
- (en) Osaku Uyeda et Efraim Racker, « Regulatory mechanisms in carbohydrate metabolism. VII. Hexokinase and phosphofructokinase », Journal of Biological Chemistry, vol. 240, no 12, , p. 4682-4688 (PMID 4221248, lire en ligne).
- (en) Howard M. Katzen, « The multiple forms of mammalian hexokinase and their significance to the action of insulin », Advances in Enzyme Regulation, vol. 5, , p. 335-336 (PMID 5603267, DOI 10.1016/0065-2571(67)90025-8, lire en ligne).
Voir aussi
Articles connexes
Liens externes
- Portail de la biochimie