Lactoferrine
La lactoferrine (parfois dite « LF ») est une glycoprotéine de la famille des transferrines qui se lie au fer et a des effets bactériostatiques, bactéricides, antiviraux, immunomodulateurs, anti-inflammatoires et protecteur de la muqueuse intestinale[1]. Une partie de ces effets biologiques serait liée à sa très forte affinité pour le fer.
Son gène est LTF situé sur le chromosome 3 humain.
Elle est présente dans le lait cru. Ses concentrations dans le lait humain sont 5 à 10 fois plus élevées que dans le lait de vache laitière (150 mg/l).
Production
La concentration en lactoferrine du lait maternel décroit au cours du premier mois[2]. Cette concentration reste supérieure à celle dans le lait de vache ou dans les laits maternisés[3].
Mode d'action
La lactoferrine agit en régulant la réponse immunitaire cellulaire à différents niveaux[4].
Chez des individus en bonne santé, elle serait en première ligne dans le système de défense immunitaire et protège des invasions infectieuses les ouvertures et orifices du corps, ce grâce à sa capacité unique à se lier au fer, utilisé par un vaste éventail d’organismes pathogènes et de tumeurs pour croître et se reproduire.
Elle joue un rôle dans les premières lignes de défense contre les organismes pathogènes invasifs, probablement en les privant du fer nécessaire à leur croissance. Délivrée dans les zones d’inflammation par les granulocytes[5], elle limite la disponibilité du fer pour les envahisseurs pathogènes, les empêchant ainsi de l’utiliser pour se multiplier.
Elle pourrait également « lyser » directement la membrane cellulaire de certains organismes pathogènes[6].
Métabolisme
La lactoferrine est trouvée dans certaines zones spécifiques du système nerveux central et plus particulièrement chez l'Homme dans la substance noire où on la trouve dans les neurones dopaminergiques et dans les cellules microgliales qui la produisent uniquement quand elles sont activées [7].
Chez le nourrisson, la lactoferrine n'est pas totalement dégradée dans le tube digestif[8].
Un récepteur à la lactoferrine humaine a été identifié au niveau des cellules de l'endothélium de l'intestin chez le fœtus[9].
Utilisation médicale
La lactoferrine bovine, en tant que complément alimentaire, est autorisée aux États-Unis[10]. Son efficacité a été démontrée par de nombreuses études[11].
- Elle réduit les problèmes infectieux chez les grands prématurés[12], dont le risque d'entérocolite nécrosante[13], mais cette efficacité n'est pas retrouvée dans toutes les études[14]. On notera néanmoins qu'elle est très utilisée en Asie et en particulier au Japon, où les poudres de lait infantile sont toutes enrichies en lactoferrine[15],[16].
- la lactoferrine est parfois prescrite en complément des traitements de l'anémie liée à la grossesse[17].
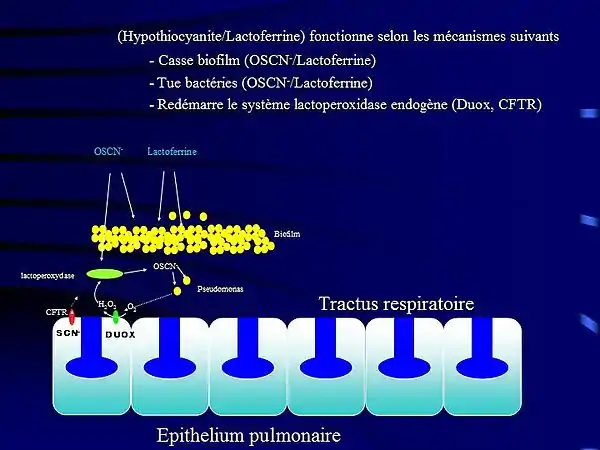
- elle présente une efficacité contre la mucoviscidose, maladie dans laquelle le poumon manquait à la fois de lactoferrine[18] et d'hypothiocyanite[19]. Ces travaux faisaient suite aux travaux[20],[21] signifiant que les poumons de malades atteints de mucoviscidose étaient infectés par des bactéries (pseudomonas aeruginosa, burkholderia cepacia) agglutinées en biofilm, lequel biofilm pouvait être inhibé par de la lactoferrine.
- la lactoferrine a aussi montré une activité antivirale contre plusieurs virus à ARN et contre des virus à ADN, dont le VIH[22], le virus Zika[23], le virus du Chikungunya[23], le virus de l'hépatite C [24], le virus Sindbis[25], le cytomégalovirus[26], l'herpes simplex[27], et le papillomavirus humain[28] ou encore contre le rotavirus[29].
La lactoferrine est reconnue comme un principe actif pharmaceutique par les agences Européennes EMEA et Américaines FDAdans le cadre d'une préparation pharmaceutique.
En raison de ses propriétés antivirales, immunomodulatrices et anti-inflammatoires, la lactoferrine a été proposée et testées dans le cadre du développement et recherche de médicaments contre la Covid-19, contre l'accrochage du SARS-CoV-2 sur sa cible. ACE2[30].
Régulateur de l'assimilation du Fer (Fe)
La lactoferrine est un régulateur permettant l'assimilation du fer dans l'organisme. Cela pourrait paraître antinomique avec le fait que l'utilisation du lait UHT génère chez les jeunes enfants (bébés) une carence en fer si on ne rappelait que la lactoferrine est sensible aux traitements thermiques (>60 °C). Dès lors, il convient d'utiliser et/ou d'extraire la lactoferrine du lait cru ou microfiltré.
Ce rôle de régulateur de fer revient également à dire que chez la personne anémiée ou chez les grands sportifs, supplémenter en lactoferrine via l'utilisation de compléments alimentaires ou de lait cru/microfiltré ou via la consommation d'aliments riches en fer (lentilles, foie, abats) permet de retrouver très rapidement un taux de fer ou de ferritine normale. La lactoferrine peut aussi aider des personnes utilisant des médicaments de type tardyféron, pour rétablir plus rapidement leur équilibre en fer mais aussi éviter la production de radicaux libres générés par l'utilisation des dits médicaments.
Notes et références
- Kruzel, M L, Harari, Y., Chen, C. Y., & Castro, G. A. (2000). Lactoferrin protects gut mucosal integrity during endotoxemia induced by lipopolysaccharide in mice. Inflammation, 24(1), 33–44. https://doi.org/ 10.1023/a:1006935908960
- Trend S, Strunk T, Lloyd ML et al. Levels of innate immune factors in preterm and term mothers' breast milk during the 1st month postpartum, Br J Nutr, 2016;115:1178-1193
- Donovan SM, The role of lactoferrin in gastrointestinal and immune development and function: a preclinical perspective, J Pediatr, 2016;173:S16-S28
- Legrand D, Overview of lactoferrin as a natural immune modulator, J Pediatr, 2016;173:S10-S15
- Ward PP, Uribe-Luna S, Conneely OM, Lactoferrin and host defense, Biochem Cell Biol, 2002;80:95-102
- Orsi N, The antimicrobial activity of lactoferrin: current status and perspectives, Biometals, 2004;17:189-196
- Carine Fillebeen, Marie-Magdeleine Ruchoux, Valérie Mitchell, Sylvie Vincent, Monique Benaı̈ssa, Annick Pierce (2001) Lactoferrin is synthesized by activated microglia in the human substantia nigra and its synthesis by the human microglial CHME cell line is upregulated by tumor necrosis factor α or 1-methyl-4-phenylpyridinium treatment (Original Research Article) ; Molecular Brain Research, Vol.96, n°1–2, 30 nov 2001, Pages 103 à 113 (résumé)
- Davidson LA, Lönnerdal B, Persistence of human milk proteins in the breastfed infant, Acta Paediatr Scand, 1987;76:733-740
- Kawakami H, Lönnerdal B, Isolation and function of a receptor for human lactoferrin in human fetal intestinal brush-border membranes, Am J Physiol, 1991;261:G841-G846
- CFSAN/Office of Food Additive Safety. Agency response letter: GRAS notice No. GRN 000077 US Food and Drug Administration Web site. 14 août 2001
- « Protéines à activités biologiques : lactoferrine et lactoperoxydase. Connaissances récemment acquises et technologies d'obtention: p7/22 »
- Manzoni P, Rinaldi M, Cattani S et Als. Bovine lactoferrin supplementation for prevention of late-onset sepsis in very low-birth-weight neonates, JAMA, 2009;302:1421-1428
- Pammi M, Suresh G, Enteral lactoferrin supplementation for prevention of sepsis and necrotizing enterocolitis in preterm infants, Cochrane Database Syst Rev, 2017;6:CD007137
- ELFIN Trial Investigators Group, Enteral lactoferrin supplementation for very preterm infants: a randomised controlled trial, Lancet, 2019;393:423-433
- Lönnerdal B, Nutritional roles of lactoferrin, Curr Opin Clin Nut Metab Care, 2009;3:293-7
- Lactoferrin
- « La lactoferrine »
- Rogan MP, Taggart CC, Greene CM, Murphy PG, O'Neill SJ, McElvaney NG. Loss of microbicidal activity and increased formation of biofilm due to decreased lactoferrin activity in patients with cystic fibrosis. J Infect Dis. 2004 Oct 1;190(7):1245-53. Epub 2004 Aug 26.
- Mowska, Patryk, Daniel Lorentzen, Katherine Excoffon, Joseph Zabner, Paul B. McCray, William M. Nauseef, Corinne Dupuy, and Botond Bánfi. A novel host defense system of airways is defective in cystic fibrosis. American Journal of Respiratory and Critical Care Medicine, 1 Nov. 2006. Web. 26 Nov. 2009
- Singh PK, Shaefer AL, Parsek MR, Moninger TO, Welsh MJ, Greenberg EP. Quorum-sensing signals indicate that cystic fibrosis lungs are infected with bacterial biofilms. Nature. 2000;407:762-4
- Singh PK, Parsek MR, Greenberg EP, Welsh MJ. A component of innate immunity prevents bacterial biofilm development, Nature. 2002;417:552-5
- Reghunathan R, Jayapal M, Puddua P, Borghi P, Gessani S, et al. Antiviral effect of bovine lactoferrin saturated with metalions on early steps of human immunodeciency virus type 1 infection. The International Journal of Biochemistry & Cell Biology. 1998;30:1055-63
- Carvalho AM, Casseb S, Gonçalves RB. Bovine lactoferrin activity against Chikungunya and Zika viruses. Journal of General Virology. 2016;98(7):1749-75
- Wrapp D, Wang N, Corbett K, Goldsmith JA, Hsieh CL, Abiona O, et al. Cryo- EM structure of the 2019-nCoV spike in the prefusion conformation. Science. 2020;367:1260-3.
- Hofmann H, Pohlmann S. Cellular entry of the SARS coronavirus. Trends in Microbiology. 2004;12:466-72.
- Berlutti F, Pantanella F, Natalizi T, Frioni A, Paesano R, Polimeni A, et al. Antiviral properties of lactoferrin-A Natural Immunity Molecule. Molecules. 2011;16:6992-7018
- Wakabayashi H, Kurokawa M, Shin K, Teraguchi S, Tamura Y, Shiraki K. Oral lactoferrin prevents body weight loss and increases cytokine responses during herpes simplex virus type 1 infection of mice. Biosci Biotechnol Biochem. 2004;68:537-44
- Wang A, Duncan SE, Lesser GL. Effect of lactoferrin on taste and smell abnormalities induced by chemotherapy: A proteome analysis. Food Funct. 2018;9:4948-58.
- Yen MH, Chiu CH, Huang YC. Effects of lactoferrin-containing formula in the prevention of enterovirus and rotavirus infection and impact on serum cytokine levels: A randomized trial. Chang Gung Med J. 2011;34-4:395-401.
- Chang R & Sun WZ (2020) Lactoferrin may reduce the incidence and attenuate the severity of COVID-19 in infants and children. Preprint at: https://doi.org/10.22541/au.158586333.32247750
Voir aussi
Articles connexes
Bibliographie
- Actor, J. K., Hwang, S.-A., & Kruzel, M. L. (2009). Lactoferrin as a natural immune modulator. Current Pharmaceutical Design, 15(17), 1956–1973. https://doi.org/10.2174/138161209788453202
- Andersen, J. H., Jenssen, H., Sandvik, K., & Gutteberg, T. J. (2004). Anti-HSV activity of lactoferrin and lactoferricin is dependent on the presence of heparan sulphate at the cell surface. Journal of Medical Virology. https://doi.org/10.1002/jmv.20171
- Baveye, S., Elass, E., Mazurier, J., Spik, G., & Legrand, D. (1999). Lactoferrin: A multifunctional glycoprotein involved in the modulation of the inflammatory process. Clinical Chemistry and Laboratory Medicine. https://doi.org/10.1515/CCLM.1999.049
- Behrens, E. M., & Koretzky, G. A. (2017). Review: Cytokine Storm Syndrome: Looking Toward the Precision Medicine Era. Arthritis & Rheumatology (Hoboken, N.J.), 69(6), 1135–1143. https://doi.org/ 10.1002/art.40071
- Bruni, N., Capucchio, M. T., Biasibetti, E., Pessione, E., Cirrincione, S., Giraudo, L., Corona, A., & Dosio, F. (2016). Antimicrobial activity of lactoferrin-related peptides and applications in human and veterinary medicine. Molecules (Basel, Switzerland), 21(6). https://doi.org/10.3390/molecules21060752
- Chang, R., Sun ,WZ. Lactoferrin may reduce the incidence and attenuate the severity of COVID-19 in infants and children. Preprint at: https://doi.org/10.22541/au.158586333.32247750 (2020)
- Egashira, M., Takayanagi, T., Moriuchi, M., & Moriuchi, H. (2007). Does daily intake of bovine lactoferrin-containing products ameliorate rotaviral gastroenteritis ? Acta Paediatrica, International Journal of Paediatrics. https://doi.org/10.1111/j.1651-2227.2007.00393.x
- Fung, S.-Y., Yuen, K.-S., Ye, Z.-W., Chan, C.-P., & Jin, D.-Y. (2020). A tug-of-war between severe acute respiratory syndrome coronavirus 2 and host antiviral defence: lessons from other pathogenic viruses. Emerging Microbes & Infections, 9(1), 558–570. https://doi.org/10.1080/22221751.2020.173664
- Guntupalli, K., Dean, N., Morris, P. E., Bandi, V., Margolis, B., Rivers, E., Levy, M., Lodato, R. F., Ismail, P. M., Reese, A., Schaumberg, J. P., Malik, R., & Dellinger, R. P. (2013). A Phase 2 Randomized, Double- Blind, Placebo–Controlled Study of the Safety and Efficacy of Talactoferrin in Patients With Severe Sepsis. Critical Care Medicine, 41(3), 706–716. https://doi.org/10.1097/CCM.0b013e3182741551
- Hoffmann, M., Kleine-Weber, H., Schroeder, S., Krüger, N., Herrler, T., Erichsen, S., Schiergens, T. S., Herrler, G., Wu, N.-H., Nitsche, A., Müller, M. A., Drosten, C., & Pöhlmann, S. (2020). SARS-CoV-2 Cell Entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell. https://doi.org/10.1016/j.cell.2020.02.052
- Hong, H., Wang, Y., Chung, H.-T., & Chen, C.-J. (2020). Clinical characteristics of novel coronavirus disease 2019 (COVID-19) in newborns, infants and children. Pediatrics and Neonatology. https://doi.org/10. 1016/j.pedneo.2020.03.001
- Ishikado, A., Imanaka, H., Takeuchi, T., Harada, E., & Makino, T. (2005). Liposomalization of lactoferrin enhanced it’s anti-inflammatory effects via oral administration. Biological & Pharmaceutical Bulletin, 28(9), 1717–1721. https://doi.org/10.1248/bpb.28.1717
- Johanson, B., Virtanen, A. I., Tweit, R. C., & Dodson, R. M. (1960). Isolation of an iron-containing red protein from human milk. Acta Chemica Scandinavica. https://doi.org/10.3891/acta.chem.scand.14- 0510
- Jolles, J., Mazurier, J., Schoentgen, F., Legrand, D., Spik, G., Montreuil, J., & Jolles, P. (1984). Human lactotransferrin : amino acid sequence and structural comparisons with other transferrins. European Journal of Biochemistry.
- Kaito, M., Iwasa, M., Fujita, N., Kobayashi, Y., Kojima, Y., Ikoma, J., Imoto, I., Adachi, Y., Hamano, H., & Yamauchi, K. (2007). Effect of lactoferrin in patients with chronic hepatitis C : combination therapy with interferon and ribavirin. Journal of Gastroenterology and Hepatology, 22 (11), 1894–1897. https://doi.org/10.1111/j.1440-1746.2007.04858.x
- Kruzel, M L, Harari, Y., Chen, C. Y., & Castro, G. A. (2000). Lactoferrin protects gut mucosal integrity during endotoxemia induced by lipopolysaccharide in mice. Inflammation, 24(1), 33–44. https://doi.org/ 10.1023/a:1006935908960
- Kruzel, Marian L, Actor, J. K., Radak, Z., Bacsi, A., Saavedra-Molina, A., & Boldogh, I. (2010). Lactoferrin decreases LPS-induced mitochondrial dysfunction in cultured cells and in animal endotoxemia model. Innate Immunity, 16(2), 67–79. https://doi.org/10.1177/1753425909105317
- Kruzel, Marian L, Zimecki, M., & Actor, J. K. (2017). Lactoferrin in a context of inflammation-induced pathology. Frontiers in Immunology, 8, 1438. https://doi.org/10.3389/fimmu.2017.01438
- Kuchler, H., Cookson, C., & Neville, S. (2020, March 6). The $2bn race to find a vaccine. Financial Times, 7. https://www.ft.com/content/e0ecc6b6-5d43-11ea-b0ab-339c2307bcd4
- Lang, J., Yang, N., Deng, J., Liu, K., Yang, P., Zhang, G., & Jiang, C. (2011). Inhibition of SARS pseudovirus cell entry by lactoferrin binding to heparan sulfate proteoglycans. PloS One, 6(8), e23710. https://doi. org/10.1371/journal.pone.0023710
- Legrand, D., Elass, E., Carpentier, M., & Mazurier, J. (2006). Interactions of lactoferrin with cells involved in immune function. Biochemistry and Cell Biology. https://doi.org/10.1139/O06-045
- Levay, P. F., & Viljoen, M. (1995). Lactoferrin: a general review. Haematologica, 80(3), 252–267. http: //www.ncbi.nlm.nih.gov/pubmed/7672721
- Lu, L., Hangoc, G., Oliff, A., Chen, L. T., Shen, R. N., & Broxmeyer, H. E. (1987). Protective influence of lactoferrin on mice infected with the polycythemia-inducing strain of Friend virus complex. Cancer Research, 47(15), 4184–4188. http://www.ncbi.nlm.nih.gov/pubmed/3038309
- Marchetti, M., Superti, F., Ammendolia, M. G., Rossi, P., Valenti, P., & Seganti, L. (1999). Inhibition of poliovirus type 1 infection by iron-, manganese- and zinc-saturated lactoferrin. Medical Microbiology and Immunology, 187(4), 199–204. https://doi.org/10.1007/s004300050093
- Mehta, P., McAuley, D. F., Brown, M., Sanchez, E., Tattersall, R. S., Manson, J. J., & HLH Across Speciality Collaboration, U. (2020). COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet (London, England). https://doi.org/10.1016/S0140-6736(20)30628-0
- Milewska, A., Zarebski, M., Nowak, P., Stozek, K., Potempa, J., & Pyrc, K. (2014). Human coronavirus NL63 utilizes heparan sulfate proteoglycans for attachment to target cells. Journal of Virology, 88(22), 13221–13230. https://doi.org/10.1128/JVI.02078-14
- Ng, T. B., Cheung, R. C. F., Wong, J. H., Wang, Y., Ip, D. T. M., Wan, D. C. C., & Xia, J. (2015). Antiviral activities of whey proteins. Applied Microbiology and Biotechnology. https://doi.org/10.1007/s00253- 015-6818-4
- Nozaki, A., Ikeda, M., Naganuma, A., Nakamura, T., Inudoh, M., Tanaka, K., & Kato, N. (2003). Identifi- cation of a lactoferrin-derived peptide possessing binding activity to hepatitis C virus E2 envelope protein. The Journal of Biological Chemistry, 278(12), 10162–10173. https://doi.org/10.1074/jbc.M207879200
- Oda, H., Nakano, M., Wakabayasi, H., Koji, Y., Toida, T., Iwatsuki, K., & Matsumoto, T. (2012). Ques- tionnaire survey on the subjective effects of a lactoferrin supplement. Japanese Journal of Complementary and Alternative Medicine, 9(2), 121–128. https://doi.org/10.1625/jcam.9.121
- Puddu, P., Borghi, P., Gessani, S., Valenti, P., Belardelli, F., & Seganti, L. (1998). Antiviral effect of bovine lactoferrin saturated with metal ions on early steps of human immunodeficiency virus type 1 infection. The International Journal of Biochemistry & Cell Biology, 30(9), 1055–1062. https://doi.org/10.1016/ s1357-2725(98)00066-1
- Razak, A., & Hussain, A. (2019). Lactoferrin supplementation to prevent late-onset sepsis in preterm infants: A meta-analysis. American Journal of Perinatology. https://doi.org/10.1055/s-0039-1696676
- Rosa, L., Cutone, A., Lepanto, M. S., Paesano, R., & Valenti, P. (2017). Lactoferrin: A natural glycoprotein involved in iron and inflammatory homeostasis. In International Journal of Molecular Sciences. https: //doi.org/10.3390/ijms18091985
- Sapp, M., & Bienkowska-Haba, M. (2009). Viral entry mechanisms: Human papillomavirus and a long journey from extracellular matrix to the nucleus. In FEBS Journal. https://doi.org/10.1111/j.1742-4658.2009. 07400.x
- Soerensen, M, S. S. (1939). The protein in whey. C R Trav Lab Carlsberg, 23, 55–00.
- Spear, P. G. (2004). Herpes simplex virus: Receptors and ligands for cell entry. In Cellular Microbiology.
https://doi.org/10.1111/j.1462-5822.2004.00389.x
- Vincent, J. L., Marshall, J. C., Dellinger, R. P., Simonson, S. G., Guntupalli, K., Levy, M. M., Singer, M., & Malik, R. (2015). Talactoferrin in severe sepsis: results from the phase II/III Oral talactoferrin in severe sepsis trial. Critical Care Medicine. https://doi.org/10.1097/CCM.0000000000001090
- Vitetta, L., Coulson, S., Beck, S. L., Gramotnev, H., Du, S., & Lewis, S. (2013). The clinical efficacy of a bovine lactoferrin/whey protein Ig-rich fraction (Lf/IgF) for the common cold: A double blind randomized study. Complementary Therapies in Medicine. https://doi.org/10.1016/j.ctim.2012.12.006
- Wakabayashi, H., Oda, H., Yamauchi, K., & Abe, F. (2014). Lactoferrin for prevention of common viral infections. In Journal of Infection and Chemotherapy. https://doi.org/10.1016/j.jiac.2014.08.003
- Wei, M., Yuan, J., Liu, Y., Fu, T., Yu, X., & Zhang, Z.-J. (2020). Novel coronavirus infection in hospitalized infants under 1 year of age in China. JAMA. https://doi.org/10.1001/jama.2020.2131
- Zhang, L., & Liu, Y. (2020). Potential interventions for novel coronavirus in China: A systematic review. Journal of Medical Virology, 92(5), 479–490. https://doi.org/10.1002/jmv.25707
- Zhu, N., Zhang, D., Wang, W., Li, X., Yang, B., Song, J., Zhao, X., Huang, B., Shi, W., Lu, R., Niu, P., Zhan, F., Ma, X., Wang, D., Xu, W., Wu, G., Gao, G. F., & Tan, W. (2020). A novel coronavirus from patients with pneumonia in China, 2019. New England Journal of Medicine, 382(8), 727–733. https: //doi.org/10.1056/NEJMoa2001017
- Zimecki, M., Wl aszczyk, A., Zagulski, T., & Ku ̈bler, A. (1998). Lactoferrin lowers serum interleukin 6 and tumor necrosis factor alpha levels in mice subjected to surgery. Archivum Immunologiae et Therapiae Experimentalis, 46(2), 97–104. http://www.ncbi.nlm.nih.gov/pubmed/9613707
- Portail de la biochimie
- Portail de la médecine