Levure chimique
La levure chimique, poudre à lever, poudres levantes ou poudre à pâte (au Canada) est un mélange composé essentiellement d'un agent basique (tel que le bicarbonate de sodium), un agent acide (acide tartrique, pyrophosphate de sodium) et un agent stabilisant (tel que l'amidon de blé ou de maïs), se présentant sous forme de poudre blanche et servant à faire gonfler pains et pâtisseries. D'après la directive 95/2/CE du parlement européen concernant les additifs alimentaires autres que les colorants et les édulcorants, les poudres levantes sont définies de la façon suivante : les substances ou combinaison de substances qui libèrent des gaz et de ce fait accroissent le volume d'une pâte[1].


Contrairement à la levure de boulanger, dont l'action dépend de micro-organismes vivants, la levure chimique fait seulement intervenir des réactions chimiques de type acide-base. Tant que la poudre reste sèche, la réaction ne démarre pas. Lorsqu'elle est humidifiée, l’acide réagit avec le bicarbonate de sodium et un dégagement de dioxyde de carbone se produit, ce qui fait gonfler la pâte. Il faut alors la cuire sans tarder.
En général, un sachet de levure chimique contient 10 g de poudre, ce qui correspond à la dose pour 500 g de farine.
Pour les aliments industriels, la liste des ingrédients précise obligatoirement les composants de la poudre à lever qui est considérée comme une catégorie d'additifs, avec la mention de la catégorie poudre à lever[2].
Histoire
Les premières levures chimiques sont réalisées par la réaction d'acides levants (lait aigre, vinaigre, jus de citron) avec du bicarbonate de soude. Une forme rudimentaire de ce type de levure est utilisée aux États-Unis vers 1790 mais elle laisse un arrière-goût amer et la réaction est si rapide que la pâte utilisant la levure doit être cuite rapidement[3]. Une amélioration apparaît avec l'utilisation comme acide de la crème de tartre obtenue à partir des résidus de barils de vin. Mise au point par Alfred Bird en 1835[4], cette levure est commercialisée en 1850. En 1864, le sel de phosphate monocalcique est breveté par Eben Norton Horsford pour une utilisation commerciale dans la levure. Vers 1885, le sel de sulfate de sodium d'aluminium (en) remplace également la crème de tartre car ces sels agissent à basse température et ne laissent pas d'arrière-goût[5]. Le succès populaire de la levure chimique se développe en 1891 lorsque l'entrepreneur allemand August Oetker (en) portionne la levure dans de petites sachets et apporte sa garantie de l'efficacité du produit en le vendant sous son nom propre[6].
Utilisation dans le domaine agroalimentaire
Poudres levantes utilisées en agroalimentaire
Tableau présentant les principales poudres levantes autorisées dans les denrées alimentaires (d’après Arrêté Français du )[1] :
| Additifs | Code européen |
|---|---|
| Acide citrique | E330 |
| Citrates de sodium | E331 |
| Citrates de potassium | E332 |
| Acide tartrique | E334 |
| Tartrates de potassium | E336 |
| Tartrates de sodium | E335 |
| Tartrate double de sodium et potassium | E337 |
| Orthophosphates de sodium | E339 |
| Diphosphates | E450 |
| Carbonate de sodium | E500 |
| Carbonate de potassium | E501 |
| Carbonate d'ammonium | E503 |
| Phosphate d'aluminium sodique acide | E541 |
| Glucono delta lactone | E575 |
Mode d'action des poudres levantes
Deux composés vont être utilisés pour la production de gaz carbonique, c’est-à-dire la levée du biscuit :
Le carbonate acide d'ammonium de formule (NH4)HCO3 ou le carbonate d’ammonium de formule (NH4)2CO3, pouvant être utilisés seuls, permettent de faire lever la pâte grâce à une décomposition des sels d’ammonium à chaud. En effet, lors de la cuisson, une libération d’ammoniac (NH3) (à petite dose car responsable de mauvais goût), de gaz carbonique (CO2) et d’eau aura lieu. Si l’on en utilise une quantité trop importante ou que la cuisson des biscuits n’est pas suffisante, on peut retrouver dans le biscuit des traces de sels ammoniacaux présentant une odeur désagréable. En revanche, aucun composé basique ou alcalin ne sera libéré. C’est l’une des substances alcalines génératrices de gaz carbonique les plus puissantes mais une utilisation de ce composé en excès peut provoquer un déchirement de la pâte. En revanche, son temps d’action est court, et va s’arrêter avant la coagulation de la pâte. L’équation de la réaction est la suivante :
NH42CO3 + Chaleur → CO2 + 2NH3 + H2O
NH4HCO3 + Chaleur → CO2 + NH3 + H2O
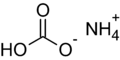 Formule chimique du bicarbonate d'ammonium
Formule chimique du bicarbonate d'ammonium
Le carbonate acide de sodium (ou bicarbonate de sodium) de formule CO3HNa, est l’une des poudres levantes les plus anciennes. Lors de la cuisson, ce dernier se transforme en gaz carbonique, carbonate de sodium (CO3Na2) et eau. Il est largement moins puissant que le carbonate acide d’ammonium. En effet, il ne produit que du gaz carbonique et pas d’autre gaz contrairement au carbonate acide d’ammonium. Il permet un faible dégagement gazeux. En revanche, son temps d’action est long, jusqu’à la stabilisation du produit. Il faut cependant savoir que le composé libéré lors de la cuisson est basique et va donner un mauvais goût aux biscuits. L’équation de la réaction se produisant est la suivante : 2CO3HNa + Chaleur → CO2 + CO3Na2 + H2O
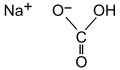 Formule chimique du carbonate acide de sodium
Formule chimique du carbonate acide de sodium
Cette poudre levante ajoutée seule dans une formule ne présente pas de réel intérêt mais principalement des inconvénients :
- Libération d’un composé basique engendrant un pH non neutre et donc un mauvais goût
- Risque de saponification des acides gras libres
- Dégagement gazeux faible donc obtention de produits peu développés
De ce fait, l’utilisation du carbonate acide de sodium va principalement être en complémentarité du carbonate acide d’ammonium. Ce dernier va permettre un gonflement de la pâte en début de cuisson, du fait de son puissant pouvoir, et le carbonate acide de sodium va, quant à lui, éviter la chute de la pâte tout au long de l’étape de cuisson. Cependant, afin d’obtenir des biscuits finis ayant un pH proche de la neutralité, la transformation du carbonate acide de sodium en carbonate de sodium doit être empêchée par l’ajout d’un composé acide. En effet, la présence de produits alcalins va engendrer un mauvais goût ainsi qu’un risque de saponification des acides gras libres et un biscuit acide a une flaveur atténuée ainsi qu’un goût acidulé. Cependant, il faut savoir, qu’un biscuit légèrement alcalin a de meilleures qualités organoleptiques. Ce goût est inhibé par une réaction appelée neutralisation se faisant mieux à chaud, permettant de maintenir l’équilibre chimique et libérant un sel neutre et de l’eau qui ne présentent donc aucun goût désagréable :
Acide + Base → Sel neutre + Eau + CO2
Les acides utilisés le plus souvent en biscuiterie pour neutraliser le carbonate acide de soude sont les suivants[1] :
- Acide tartrique
- Crème de tartre = Bitartrate de potassium
- Phosphate acide monocalcique = Orthophosphate monocalcique
- Pyrophosphate acide de soude = Diphosphate disodique
- Phosphate d’aluminium sodique
Les acides se différencient par leur temps d’action pouvant être rapide, moyen ou lent. Le choix des acides va alors se faire en fonction du procédé de fabrication et principalement du temps de cuisson du produit. Dans le cas des biscuits moulés, le temps de cuisson est aux alentours de 10 minutes, ce qui correspond à un temps assez court. Il faut savoir qu’en biscuiterie, les acides les plus utilisés sont ceux à temps d’action moyen donc le phosphate acide monocalcique et le pyrophosphate acide de soude. Le phosphate acide monocalcique était le principal[7] acide utilisé mais tend à être supplanté par le pyrophosphate acide de soude[8] qui présente une action plus lente mais réagit de façon rapide lorsque la pâte augmente en température pendant le début de la cuisson.
De façon générale les poudres levantes présentent deux stades d’activité. Le premier avant cuisson et on parle de « préfermentation » ; l’activité a lieu dans ce cas dès l’introduction des poudres levantes dans la pâte et doit être faible et lente pour éviter la perte de gaz utile au développement du volume. Le deuxième débutant à la cuisson donc en présence de chaleur est appelé « postfermentation ». Elle doit commencer entre 50 et 60 °C afin que la majeure partie du travail des poudres levantes (création d’alvéoles et gonflement de la pâte) ait lieu au moment de l’enfournement c’est-à-dire avant la coagulation de la pâte[1].
Agent stabilisant
L'agent stabilisant est de l'amidon. Le plus souvent il provient du blé (donc peut contenir des traces de gluten). Plus rarement, l'amidon est de la fécule de maïs, encore appelée fleur de maïs[9]. Cet agent sert à absorber l'humidité de la préparation commerciale, afin que la réaction acide-base ne se déclenche pas accidentellement[9].
Notes et références
- Richard LEVY, « Levures biologiques alimentaires ou poudres levantes », Techniques de l'ingénieur,
- Règlement 1169/2011 Annexe VII Partie C
- L'Encyclopédie visuelle des aliments, Québec Amérique, , p. 659
- (en) Aki Kamozawa, H. Alexander Talbot, Ideas in Food : Great Recipes and Why They Work, Crown Publishing Group, , p. 97
- (en) Clyde E. Stauffer, Functional Additives for Bakery Foods, Springer Science & Business Media, , p. 193
- (en) Paul H. Freedman, Food. The History of Taste, University of California Press, , p. 242
- (en) Duncan Manley, Manley's technology of biscuits, crackers and cookies, Cambridge, Woodhead publ., , 588 p. (ISBN 978-1-84569-770-9)
- (en) Peter Wade, Biscuits, cookies and crackers, Londres, , 176 p. (ISBN 978-1-85166-187-9)
- « La levure Chimique », sur Devenir Pâtissier, (consulté le )
Voir aussi
Articles connexes
- Additif alimentaire
- Liste des additifs alimentaires
- Bicarbonate de sodium
- Bicarbonate d'ammonium
- Bicarbonate de potassium
- Carbonate de sodium
- Δ-Gluconolactone
- Alimentation et gastronomie