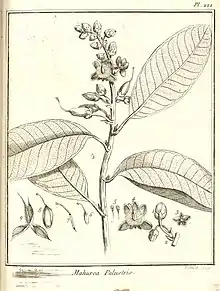
Mahurea palustris
Mahurea palustris est une espèce de plantes endémique du plateau des Guyanes, appartenant à la famille des Calophyllaceae (anciennement des Clusiaceae, des Bonnetiaceae, ou des Theaceae), et qui est l'espèce type du genre Mahurea Aubl..

| Règne | Plantae |
|---|---|
| Classe | Equisetopsida |
| Sous-classe | Magnoliidae |
| Super-ordre | Rosanae |
| Ordre | Malpighiales |
| Famille | Calophyllaceae |
| Genre | Mahurea |
Selon INPN (09 mars 2022)[2] :
- Bonnetia meridionalis Sw., 1800 [nom. illeg. superfl.]
- Bonnetia palustris (Aubl.) J.F.Gmel., 1791
- Mahurea palustris var. palustris Aubl., 1775
- Mahurea palustris var. typica Wawra, 1886
Il est connu en Guyane sous les noms de Bois de vin (Créole)[3], Atit kamwi (Palikur)[4].
Description
.png.webp)
Mahurea palustris est un arbre ou un arbuste atteignant 10 m de haut, à jeunes branches glabres. Sa sève a un goût brûlant[4].
Son bois est de couleur brun violacé foncé, mi-lourd (densité : 0,80), avec un grain fin. On compte de très nombreux vaisseaux (45 par mm2 environ), plutôt fins (90 µm), souvent accolés radialement par 2 à 4[3],[6].
Les pétioles sont longs de 0,9 à 1,5 cm. On obesrve 2 petites stipules. Les feuilles sont longues de 11-20 cm pour 3,5-12 cm de large, chartacées à subcoriacées, glabres, de forme largement lancéolée, obtuse ou ovale, arrondie et parfois brièvement apiculées, o base arrondie à obtuse. Les nervures secondaires divergent presque à angle droit de la nervure médiane.
L'inflorescence est un épi terminal, long de 25 cm, de couleur purpurine, presque glabres, comportant 8-30 fleurs (parfois groupées par 2-3). Le pédoncule des fleurs porte 3 écailles pubérulentes, longues de 2 mm : une bractée à l'aisselle, et 2 bractéoles latérales opposées.
Le bouton floral est de forme ellipsoïde. Les sépales sont densément pubescents, onguiculés, de forme aiguë, arrondie à obtuse, et inégaux : les 3 extérieurs sont longs de 4-5 mm, et les 2 intérieurs de 6-8 mm. Les pétales sont de couleur rose, densément tomentellés à l'extérieur, de forme elliptique ou spatulée, atteignant jusqu'à 1,5 cm de long. On compte (120-)150-180 étamines, avec les filets blancs, longs d'environ 7 mm, les anthères jaunes, atteignant jusqu'à 1,5 mm de long, et une glande large d'environ 0,5 mm. L'ovaire est glabre, de forme ovoïde à oblongue, avec le style rose, et le stigmate creux.
Son fruit est une capsule à 3 valves et 3 loges, roussâtre, membraneuse, surmontée du style persistant, atteignant jusqu'à 1,5-2 x 0,9 cm, et contenant de nombreuses graines noires[7],[8].
Répartition
Mahurea palustris est endémique du plateau des Guyanes[9], présent au Suriname, en Guyane (zone côtière[4]), et au Brésil (Amazonas, Roraima[10])[7].
Écologie
Mahurea palustris est un arbre commune en Guyane[9], poussant dans les forêts humides secondaire et ancienne[4], les lisières forestières[11], les zones humides de Guyane[12] et les forêts submontagnardes sempervirentes du Roraima[10].
Mahurea palustris est occasionnellement l'hôte des fourmilières arboricoles de Azteca chartifex[13] et Dolichoderus bidens[11], ainsi que des guêpes Protopolybia emortualis (Epiponini)[14],[15].
Mahurea palustris perd ses feuilles au mois d'août en Guyane[16].
Utilisation
Mahurea palustris entre dans la composition d'un poison de guerre Palikur : le latex abondant de Hura crepitans est mélangé à de l'eau de roucou, bouilli, jusqu'à devenir pâteux, l'on y ajoute alors la sève de Mahurea palustris, et l'on enduit cette préparations sur les pointes de flèche lancéolée[4].
La durabilité du bois de Mahurea palustris a été testée (perte de masse calculée à 6 mois : 20,0 ; perte de masse relative par rapport à l’espèce de référence non durable : 55,1% ; Densité à 12% d'humidité : 0,60 ; infraDensité : 0,48 )[17].
On a isolé dans les feuilles de Mahurea palustris 5 dérivés originaux d'acyl-phloroglucinol (les mahuréones A−E (1, 3−6) ), qui présentent de propriétés inhibitrices sur l'ADN polymérase β humaine[18],[19]
Protologue
En 1775, le botaniste Aublet propose le protologue suivant[20] :
« MAHUREA (paluſtris). (Tabula 222.)
Arbor trunco quindecim-pedali, in ſumitate ramoſo ; ramis erectis. Folia alterna, petiolata, glabra, ovata, integerrima. Stipulæ binæ, parvæ, ad exortum petiolorum. Flores in ſpicâ terminali vei ſolitarii, vel bini, vel ternatím diſpoſiti. Flores ſolitarii, pedunculati. Squamulæ tres ; una ex axillâ pedunculi, binæ aliæ ex lateribus, hínc & indè.
Flores bini vel terni, pedunculati, pedunculo communi ad baſim ſquamulâ munito. Color ſpicæ & florum purpureus. Capsula ovata, ſtylo non deciduo terminata.
Florebat Auguſto, fructum ferebat Octobri.
Habitat in locis paludoſis Caïennæ & Guianæ.
LE MAHURI aquatique. (Plance 222.)Le tronc de cet arbre s'élève a environ quinze pieds, ſur ſept à huit pouces de diamètre. Son écorce eſt liſſe, rouſſâtre. Son bois eſt blanc, peu compacte. Il pouſſe a l'on ſommet pluſieurs branches longues, droites, chargées de rameaux qui ſont garnis de feuilles alternes, entières, vertes, liſſes & ovales. leur pédicule eſt convexe en deſſous, & creuſé en gouttiere en deſſus; il eſt accompagné a ſa naiſſance de deux stipules oppoſées; 4es plus grandes feuilles ont ſept pouces de longueur, ſur deux & demi de largeur.
Les fleurs naiſſent à l'extrémité des branches & des rameaux ; elles ſont rangées & diſpoſées alternativement une, deux ou trois enſemble. Le pédoncule de chaque fleur eſt garni a ſa baſe d'une Écaille, & de deux plus petites latérales & oppoſées. Lorſque deux ou trois fleurs ſont ſur un pédoncule commun, ce pédoncule porte à ſa baſe une écaille. Tout l'épi eſt de couleur purpurine.
Le calice eſt d'une ſeule pièce, diviſé profondément en cinq parties fermés, concaves & aiguës, dont deux plus grandes, & trois plus petites.
La corolle eſt à cinq pétales attaches pat un onglet au fond du calice ; les pétales ſont aigus, concaves ; trois ſupérieurs rélevés, deux inférieurs plus grands, écartés & inclinés.
Les étamines ſont en grand nombre. On en compte juſqu'à 170 ; elles ſont placées au deſſous de l'ovaire. Les filets ſont blancs. Les anthères ſont jaunes, à deux bourſes, marquées de quatre ſillons longitudinaux.
Le piſtil eſt un ovaire oblong, ſurmonté d'un style couleur de chair, coude, & terminé par un stigmate creux, à trois angles obtus.
L'ovaire devient une capsule rouſſâtre, membraneuſe, ſèche, qui conſerve le ſtyle. Elle eſt à trois loges & à trois valves ; chaque valve forme une loge, qui s'ouvre du côte ou elle eſt attachée a l'axe qui porte le ſtyle. Cet axe a trois placenta chargés d'un grand nombre de semences oblongues, noires, couvertes d'une membrane dorée, & couchées les unes ſur les autres.
Cet arbre croît dans les lieux marécageux de l'île de Caïenne & de la Guiane.
Je l'ai trouvé à Aroura dans les marécages qui dépendent de l'habitation de Madame Bertier, & dans l'île de Caïenne au bas du jardin, de Madame Dubilly.
II étoit en fleur au mois d'Août, & en fruit au mois d'Octobre. »
— Fusée-Aublet, 1775.
.jpg.webp) Jeune pied de Mahurea palustrisi dans une savane proche du bagne des Annamites de Montsinéry (Guyane)
Jeune pied de Mahurea palustrisi dans une savane proche du bagne des Annamites de Montsinéry (Guyane).jpg.webp) Rameaux fleuris de Mahurea palustrisi
Rameaux fleuris de Mahurea palustrisi.jpg.webp) Inflorescence de Mahurea palustrisi
Inflorescence de Mahurea palustrisi.jpg.webp) Inflorescence de Mahurea palustrisi
Inflorescence de Mahurea palustrisi.jpg.webp) Inflorescence de Mahurea palustrisi
Inflorescence de Mahurea palustrisi.jpg.webp) Inflorescence de Mahurea palustrisi
Inflorescence de Mahurea palustrisi.jpg.webp) Inflorescence de Mahurea palustrisi
Inflorescence de Mahurea palustrisi.jpg.webp) Fleur de Mahurea palustrisi
Fleur de Mahurea palustrisi.jpg.webp) Fleur de Mahurea palustrisi
Fleur de Mahurea palustrisi
Notes et références
- Tropicos.org. Missouri Botanical Garden., consulté le 09/03/2022
- MNHN & OFB [Ed]. 2003-présent. Inventaire national du patrimoine naturel (INPN), Site web : https://inpn.mnhn.fr, consulté le 09 mars 2022
- Pierre DÉTIENNE, Paulette JACQUET et Alain MARIAUX, Manuel d'identification des bois tropicaux : Tome 3 Guyane française, Quae, (lire en ligne), p. 146
- Pierre Grenand, Christian Moretti, Henri Jacquemin et Marie-Françoise Prévost, Pharmacopées traditionnelles en Guyane : Créoles. Wayãpi, Palikur, Paris, IRD Editions, , 663 p. (ISBN 978-2-7099-1545-8, lire en ligne), p. 313, 360
- Jacques Cambessèdes, Mémoire sur les familles des Ternstroemiacées et des Guttifères., A. Belin. (lire en ligne), p. 60 Tom.16 pl.16.
- Tine Baretta-Kuipers, « Comparative wood anatomy of Bonnetiaceae, Theaceae and Guttiferae », LEIDEN BOTANICAL SERIES, no 3, , p. 76-101 (lire en ligne)
- (en) A. A. Pulle et A. L. STOFFERS & J. C. LINDEMAN, Flora of Suriname : ADDITIONS AND CORRECTIONS, vol. III, PART 1-2, LEIDEN, E. J. BRILL - FOUNDATION VAN EEDENFONOS - e/o Royal Tropical Institute. Amsterdam, , 259-498 p. (ISBN 90 04 07779 0), p. 307-308
- Albert Lemée, Flore de la Guyane française : Tome III - Dilléniacées à Composées, Brest, LIBRAIRIE LECHEVALlER, , 656 p., p. 35
- (en) Stéphanie Bodin, Caractérisation de l'impact des feux anthropiques de la période pré-colombienne sur la végétation forestière de la Réserve Naturelle des Nouragues en Guyane française par une approche anthracologique, Université Montpellier, , 237 p. (lire en ligne)
- (en) William Milliken, Bruce Albert, Maria de Lourdes Ruivo, Francois-Michel Le Tourneau et Rogerio Duarte, Degraded areas in the Yanomami territory, Roraima, Brazil : Ethno-environmental evaluation of the Homoxi region, , 187 p. (lire en ligne)
- Pablo Servigne, « Eco-éthologie de la fourmi arboricole Dolichoderus bidens (L.)(Hymenoptera: Dolichoderinae) en Guyane Française », Travail de fin d’études, Faculté Universitaire des Sciences Agronomiques de Gembloux, (lire en ligne)
- Sophie GONZALEZ, Gaëlle JAOUEN, Jean-François MOLINO, Marie-Françoise PREVOST, Daniel SABATIER et Jean-Louis SMOCK, ETABLISSEMENT D’UNE LISTE DES ESPECES VEGETALES DES ZONES HUMIDES DE GUYANE FRANCAISE pour la mise en application des directives de l’arrêté du 24 Juin 2008 précisant les critères de définition et de délimitation des zones humides en application des articles L. 214-7 et R. 211-108 du code de l’environnement, MEEDDM/DIREN - IRD, UMR AMAP – HERBIER DE GUYANE, (lire en ligne)
- (en) Alain Dejean, Julien Grangier, Céline Leroy, Jerôme Orivel et Marc Gibernau, « Nest site selection and induced response in a dominant arboreal ant species », Naturwissenschaften, vol. 95, , p. 885–889 (DOI 10.1007/s00114-008-0390-z, lire en ligne)
- (en) A. Dejean, B. Corbara et J.M. Carpenter, « Nesting site selection by wasps in the Guianese rain forest », Insectes soc., vol. 45, , p. 33–41 (DOI 10.1007/s000400050066, lire en ligne)
- (en) Bruno Corbara, J.M. Carpenter, R. Céréghino, M. Leponce, M. Gibernau et Alain Dejean, « Diversity and nest site selection of social wasps along Guianese forest edges: assessing the influence of arboreal ants », Comptes Rendus Biologies, vol. 332, , p. 470–479 (DOI 10.1016/j.crvi.2009.01.003, lire en ligne)
- Denis Loubry, « La phénologie des arbres caducifoliés en forêt guyanaise (5° de latitude nord) : illustration d'un déterminisme à composantes endogène et exogène », Canadian Journal of Botany, vol. 72, no 12, (DOI 10.1139/b94-226)
- Jacques Beauchêne, Durabilité naturelle des bois de Guyane sous-tâche du Projet "DEGRAD" : programme convergence 2007-2013, Kourou, Région Guyane, ECOFOG, , 27 p. (lire en ligne)
- (en) Georges Massiot, Christophe Long, Bruno David, Marie-Jeanne Serrano, Florence Daubié, Frédéric Alby, Frédéric Ausseil, Martine Knibiehler, Christian Moretti, Jean-Sébastien Hoffmann, Christophe Cazaux et Catherine Lavaud, « Acylphloroglucinol Derivatives from Mahurea palustris », J. Nat. Prod., vol. 68, no 7, , p. 979–984 (DOI 10.1021/np049676o)
- (en) F. Boudsocq, P. Benaim, Y. Canitrot, M. Knibiehler, F. Ausseil, J. P. Capp, A. Bieth, C. Long, B. David, I. Shevelev, E. Frierich-Heinecken, U. Hübscher, F. Amalric, G. Massiot, J. S. Hoffmann et C. Cazaux, « Modulation of Cellular Response to Cisplatin by a Novel Inhibitor of DNA Polymerase β », Molecular Pharmacology, vol. 67, no 5, , p. 1485-1492 (DOI 10.1124/mol.104.001776)
- Jean Baptiste Christophe Fusée-Aublet, HISTOIRE DES PLANTES DE LA GUIANE FRANÇOISE, rangées suivant la méthode sexuelle, avec plusieurs mémoires sur les différents objets intéreſſants, relatifs à la culture & au commerce de la Guiane françoiſe, & une Notice des plantes de l'Iſle de France. volume I, Londres et Paris, P.-F. Didot jeune, Librairie de la Faculté de Médecine, quai des Augustins, (lire en ligne), p. 558-560
Voir aussi
Articles connexes
Liens externes
- (en) Référence NCBI : Mahurea palustris (taxons inclus) (consulté le )
- (en) Référence JSTOR Plants : Mahurea palustris (consulté le )
- (en) Référence The Plant List : Mahurea palustris Aubl. (source : Tropicos.org) (consulté le )
- (en) Référence Tropicos : Mahurea palustris Aubl. (+ liste sous-taxons) (consulté le )
- (en) Référence uBio : Mahurea palustris Aubl. (consulté le )
- (en) Référence World Flora Online (WFO) : Mahurea palustris Aubl. (consulté le )
- (en) Référence IPNI : Mahurea palustris
- (fr+en) Référence GBIF : Mahurea palustris Aubl.
- (fr+en) Référence EOL : Mahurea palustris Aubl.
- (en) Référence Catalogue of Life : Mahurea palustris Aubl. (consulté le )
- (fr) Référence INPN : Mahurea palustris Aubl.
- « Mahurea palustris », sur Flore de Guyane, (consulté le )
- « Mahurea palustris », sur la chaussete rouge, (consulté le )
- Portail de la botanique
- Portail de la Guyane