Maladies de l'abeille domestique
Les maladies de l'abeille domestique sont causées par divers agents pathogènes, notamment champignons, bactéries et virus. Dans cet articles sont assimilées à des maladies les infestations par des insectes et acariens.
Ravageurs et parasites
Varrooses
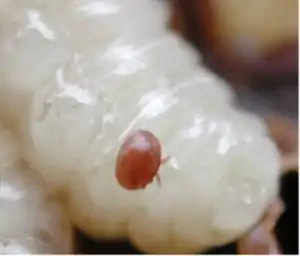
Varroa destructor et Varroa jacobsoni sont des espèces d'acariens parasites qui se nourrissent des fluides corporels des abeilles adultes, nymphes et larves. Les acariens du genre Varroa peuvent être vus à l'œil nu comme de petites taches rouges ou brunes sur le thorax des abeilles. Les Varroa sont porteurs de nombreux virus qui attaquent les abeilles. Par exemple, les abeilles infectées au cours de leur développement ont souvent visiblement les ailes déformées.
Les acariens Varroa ont conduit à la quasi-élimination des colonies d'abeilles sauvages dans de nombreuses régions et constituent un problème majeur pour les abeilles gardées dans les ruchers. Certaines populations sauvages se rétablissent maintenant - il semble qu'elles aient été naturellement sélectionnées pour la résistance au Varroa.
Les acariens Varroa ont été découverts pour la première fois en Asie du Sud-Est vers 1904, mais ils sont maintenant présents sur tous les continents sauf l'Australie. Ils ont été découverts aux États-Unis en 1987, en Nouvelle-Zélande en 2000 et dans le Devon, Royaume-Uni en 1992.
Pour l'œil non averti, ces acariens ne sont généralement pas un problème très perceptible pour une ruche en forte croissance - car les abeilles peuvent sembler fortes en nombre et peuvent même être très efficaces pour se nourrir. Cependant, le cycle de reproduction des acariens se produit à l'intérieur des chrysalides coiffées, et la population d'acariens peut augmenter en raison de la croissance des colonies. L'observation attentive d'une colonie peut aider à identifier les signes de maladies souvent propagées par les acariens. Lorsque la croissance de la population de la ruche est réduite en prévision de l'hiver ou en raison d'une mauvaise alimentation de fin d'été, la croissance de la population d'acariens peut dépasser celle des abeilles et peut alors détruire la ruche. On a observé que les colonies malades peuvent mourir lentement et être incapables de survivre pendant l'hiver, même en présence de réserves alimentaires adéquates. Souvent, une colonie s'enfuit simplement (part comme dans un essaim, mais ne laissant aucune population derrière elle) dans de telles conditions.
Les Varroa, en combinaison avec des vecteurs viraux et des bactéries, ont été théoriquement impliqué dans le syndrome d'effondrement des colonies d'abeilles.
On sait que le thymol, composé produit par le thym, présent naturellement dans le miel de thym, est un traitement contre les Varroa, bien qu'il puisse entraîner la mortalité des abeilles à des concentrations élevées[1]. La fourniture de cultures de thym aux colonies actives peut donner à ces colonies une défense chimique non interventionnelle contre le Varroa.
Traitement
Différents traitements chimiques et mécaniques sont utilisés pour tenter de lutter contre les acariens Varroa.
Les moyens chimiques couramment utilisés comprennent des produits chimiques « durs » tels que l'Amitraze (commercialisé sous le nom d'Apivar[2], le fluvalinate (commercialisé sous le nom d'Apistan) et le coumaphos (commercialisé sous le nom de CheckMite). Les contrôles chimiques « doux » comprennent le thymol (commercialisé sous le nom d'ApiLife-VAR et Apiguard), les esters d'octanoate de sucrose (commercialisés sous le nom de Sucrocide), l'acide oxalique et l'acide formique (vendu sous forme liquide ou de bandes de gel comme Mite Away Quick Strips et Formic Pro[3],mais également utilisé dans d'autres formulations). Selon l'Agence américaine de protection de l'environnement, lorsqu'ils sont utilisés dans les ruches en respectant les directives, ces traitements tuent une grande partie des acariens sans perturber considérablement le comportement ou la durée de vie des abeilles. L'utilisation de moyens chimiques est généralement réglementée et varie d'un pays à l'autre. À quelques exceptions près, ils ne sont pas destinés à être utilisés lors de la production de miel commercialisable[4]
Les moyens mécaniques couramment utilisés reposent généralement sur la perturbation de certains aspects du cycle de vie des acariens. Ces moyens ne visent généralement pas à éliminer tous les acariens, mais simplement à maintenir l'infestation à un niveau que la colonie peut tolérer. Des exemples de moyens mécaniques incluent le sacrifice de couvain de mâles (les acariens Varroa sont de préférence attirés par le couvain de mâles), le saupoudrage de sucre en poudre (qui encourage le comportement de nettoyage et déloge certains acariens), les planches de fond grillagées (ainsi les acariens délogés tombent au fond et loin de la colonie), la rupture de couvain et, peut-être, la réduction de taille des cellules du couvain.
Acariose de la trachée
Acarapis woodi est une espèce d' acariens parasites qui infestent la trachée à partir de la première paire de spiracles thoraciques. L'espèce-hôte d'origine est probablement l'abeille mellifère orientale, Apis cerana. Une maladie non identifiée des abeilles a été signalée pour la première fois dans l'île de Wight en Angleterre en 1904, connue par la suite sous le nom de « maladie de l'île de Wight »' (IoWD), qui était initialement considérée comme causée par Acarapis woodi lorsqu'elle a été identifiée en 1921 par Rennie. La maladie IoWD s'est rapidement propagée au reste de la Grande-Bretagne et de l'Irlande, portant un coup dévastateur à l'apiculture britannique et irlandaise, dont on prétendu qu'il avait anéanti la population d'abeilles indigènes des îles britanniques. En 1991, Bailey & Ball ont déclaré : « L'opinion finale de Rennie (1923), co-découvreur d'Acarapis woodi, qui avait beaucoup d'expérience des abeilles considérées comme atteintes de la maladie de l'île de Wight, était que sous la désignation originale, et maintenant tout à fait correctement écartée, de « Maladie de l'île de Wight », il existait plusieurs maladies présentant des symptômes superficiels analogues »[5], les auteurs sont parvenus à la conclusion ferme que l'IoWD n'était pas uniquement causée par les acariens de l'espèce Acarapis woodi, mais principalement par le virus de la paralysie chronique des abeilles (CBPV), même si Acarapis woodi était toujours présent dans la ruche lorsque les symptômes du CBPV étaient observés. Le frère Adam de l'abbaye de Buckfast a sélectionné une race d'abeille résistante connue sous le nom d'abeille Buckfast, qui est maintenant disponible dans le monde entier. Le diagnostic de l'acariose de la trachée implique généralement la dissection et l'examen microscopique d'un échantillon d'abeilles de la ruche.
Acarapis woodi est probablement entré aux États-Unis en 1984, en provenance du Mexique.
Les acariens femelles adultes quittent les voies respiratoires de l'abeille et grimpent sur un poil de l'abeille, où ils attendent de pouvoir passer sur une jeune abeille. Une fois sur la nouvelle abeille, ils se déplacent dans les voies respiratoires et commencent à pondre des œufs.
Traitement
En général, on lutte contre ces acariens avec des galettes de graisse (généralement constituées d'une partie de graisse végétale mélangée à trois à quatre parties de sucre en poudre) placées sur les barrettes supérieures de la ruche. Les abeilles viennent manger le sucre et ramassent des traces de graisse végétale, ce qui perturbe la capacité de l'acarien à identifier une jeune abeille. Certains des acariens en attente de transfert vers un nouvel hôte restent sur l'hôte d'origine. D'autres sont transférés à une autre abeille de manière aléatoire - une partie d'entre eux meurent d'autres causes avant de pouvoir se reproduire.
Le menthol est également souvent utilisé pour traiter les acariens, soit laisser se vaporiser à partir de la forme cristalline, soit mélangé dans les galettes de graisse.
Nosémose
Nosema apis est une espèce de microsporidies qui envahit le tractus intestinal des abeilles adultes et cause la maladie connue sous le nom de nosémose. L'infection à nosema est également associée au virus de la cellule royale noire. Ce n'est normalement un problème que lorsque les abeilles ne peuvent pas quitter la ruche pour éliminer les déchets (par exemple, pendant une vague de froid prolongée en hiver ou lorsque les ruches sont enfermées dans une grange d'hivernage). Lorsque les abeilles sont incapables d'évacuer les déchets (vol de propreté), elles peuvent développer la dysenterie.
La maladie due aux Nosema est traitée en augmentant la ventilation de la ruche. Certains apiculteurs traitent les ruches avec des agents tels que la fumagilline.
La nosémose peut également être évitée ou minimisée en retirant une grande partie du miel de la ruche, puis en nourrissant les abeilles avec de l'eau sucrée à la fin de l'automne. L'eau sucrée à base de sucre raffiné a une teneur en cendres inférieure à celle du nectar de fleurs, ce qui réduit le risque de dysenterie. Le sucre raffiné, cependant, contient moins de nutriments que le miel naturel, ce qui provoque des controverses chez les apiculteurs.
En 1996, un type d'organisme similaire à Nosema apis a été découvert sur l'abeille asiatique Apis cerana et nommé par la suite Nosema ceranae. Ce parasite infecte apparemment également l'abeille domestique[6].
L'exposition à du pollen de maïs porteur de gènes pour la production de Bacillus thuringiensis (Bt) peut affaiblir la défense des abeilles contre le Nosema[7]. En ce qui concerne l'alimentation d'un groupe d'abeilles avec du pollen maïs Bt et un groupe témoin avec du pollen de maïs non Bt : « la première année, les colonies d'abeilles étaient infestées par les parasites (microsporidies). Cette infestation a conduit à une réduction du nombre d'abeilles et par la suite une réduction des couvains dans les colonies nourries au pollen Bt, ainsi que dans les colonies nourries avec du pollen sans toxine Bt. L'essai a ensuite été interrompu à un stade précoce. Cet effet a été significativement plus marqué chez les colonies nourries au Bt. (Les différences significatives indiquent une interaction de la toxine et du pathogène sur les cellules épithéliales de l'intestin de l'abeille. Le mécanisme sous-jacent qui cause cet effet est inconnu.) »
Cette étude doit être interprétée avec prudence étant donné qu'aucune répétition de l'expérience ni aucune tentative de recherche de facteurs de confusion n'a été faite. En outre, la toxine Bt et le pollen transgénique Bt n'ont montré aucune toxicité aiguë à aucun des stades de vie des abeilles examinées, même lorsque la toxine Bt était apportée à des concentrations 100 fois supérieures à celles trouvées dans le pollen transgénique du maïs Bt..
Petit coléoptère des ruches

Aethina tumida est un petit coléoptère de couleur sombre qui vit dans les ruches. Originaire d'Afrique, la première découverte du petit coléoptère des ruches dans l'hémisphère occidental a été faite dans le comté de Sainte-Lucie (Floride), en 1998. L'année suivante, un spécimen qui avait été collecté à Charleston (Caroline du Sud), en 1996, a été identifié et serait le cas index des États-Unis[8]. En décembre 1999, de petits coléoptères des ruches ont été signalés dans plusieurs États des États-Unis, Iowa, Maine, Massachusetts, Minnesota, New Jersey, Ohio, Pennsylvanie, Texas et Wisconsin, et l'insecte a été trouvé en Californie en 2006.
Le cycle de vie de ce coléoptère comprend la nymphose qui se déroule dans le sol à l'extérieur de la ruche. On pense que les moyens utilisés pour empêcher les fourmis de grimper dans les ruches sont également efficaces contre le coléoptère de la ruche. Certains apiculteurs expérimentent l'utilisation de la terre de diatomée autour de la ruche comme moyen de perturber le cycle de vie du coléoptère. Les diatomées abrasent les surfaces extérieures des insectes, ce qui entraîne leur déshydratation et la mort.
Traitement
Plusieurs insecticides sont actuellement utilisés contre le petit coléoptère des ruches. Le fipronil (commercialisé notamment sous le nom de Combat Roach Gel[9] est couramment appliqué à l'intérieur des ondulations d'un morceau de carton. Les ondulations standard sont suffisamment grandes pour qu'un petit coléoptère des ruches puisse entrer dans le carton par l'extrémité, mais suffisamment petites pour que les abeilles mellifères ne puissent pas entrer (elles sont donc tenues à l'écart de l'insecticide). D'autres méthodes de lutte tels que des pièges à barrette supérieure à base d'huile sont également disponibles, mais ils ont eu très peu de succès commercial.
Fausses-teignes des ruches

Galleria mellonella, la grosse fausse-teigne de la cire, n'attaque pas directement les abeilles, mais se nourrit des exosquelettes de larves d'abeilles et de pollen trouvé dans les rayons du couvain qui a été utilisé par les abeilles pour soutenir les abeilles en croissance. Leur développement complet jusqu'à l'âge adulte nécessite l'accès à des rayons à couvain ou à des nettoyages de cellules de couvain - ceux-ci contiennent des protéines essentielles au développement larvaire, sous forme de cocons de couvain. La destruction du rayon entraîne le gaspillage ou la contamination du miel stocké et peut tuer les larves d'abeilles.
Lorsque les hausses de miel sont stockées pour l'hiver dans un climat doux ou dans un stockage chauffé, les larves de la fausse-teigne peuvent détruire des parties du rayon, bien qu'elles ne se développent pas complètement. Le rayon endommagé peut être gratté et remplacé par les abeilles. Les larves et les œufs de la fausse-teigne de la cire sont tués par le gel, de sorte que le stockage dans des hangars non chauffés ou des granges à des latitudes plus élevées est le seul moyen nécessaire.
Comme les fausses-teignes ne peuvent pas survivre à un hiver froid, elles ne sont généralement pas un problème pour les apiculteurs du nord des États-Unis ou du Canada, à moins qu'elles ne survivent à l'hiver dans un entrepôt chauffé, ou qu'elles soient amenées du sud par l'achat ou la migration des apiculteurs. Elles prospèrent et se propagent le plus rapidement à des températures supérieures à 30 °C, de sorte que certaines zones n'ayant que quelques jours chauds ont rarement un problème avec les fausses-teignes, à moins que la colonie soit déjà faible en raison d'autres facteurs de stress.
Traitement
Une ruche forte ne nécessite généralement aucun traitement pour contrôler les fausses-teignes de la cire. Les abeilles elles-mêmes tuent et nettoient les larves et les toiles du papillon. Les larves de la fausse-teigne peuvent se développer complètement lors des nettoyages cellulaires lorsque ces nettoyages s'accumulent en épaisseur là où ils ne sont pas accessibles aux abeilles.
Le développement de la fausse-teigne de la cire dans les rayons n'est généralement pas un problème avec les ruches horizontales à barres , car les rayons non utilisés sont généralement laissés dans la ruche pendant l'hiver. Comme ce type de ruche n'est pas utilisé dans des conditions d'hivernage rigoureuses, les abeilles peuvent patrouiller et inspecter les rayons inutilisés.
Les fausses-teignes de la cire peuvent être maîtrisées dans un rayon stocké par l'application par pulvérisation de la variété aizawai de Bacillus thuringiensis. C'est une méthode de lutte biologique très efficace et qui possède un excellent dossier de sécurité.
Les fausses-teignes peuvent être traitées chimiquement avec du paradichlorobenzène (boules anti-mites, disques pour urinoirs). Si des méthodes chimiques sont utilisées, les rayons doivent être bien aérés pendant plusieurs jours avant utilisation. L'utilisation de naphtalène (boules de naphtaline) est déconseillée car elle s'accumule dans la cire, ce qui peut tuer les abeilles ou contaminer les réserves de miel. La lutte contre les fausses-teignes de la cire par d'autres moyens comprend la congélation des rayons pendant au moins vingt-quatre heures.
Tropilaelapsose
Les acariens du genre Tropilaelaps (notamment Tropilaelaps mercedesae et Tropilaelaps clareae) sont considérés comme de sérieuses menaces pour les abeilles. Bien qu'ils ne soient actuellement pas signalés en dehors de l'Asie, ces acariens ont le potentiel d'infliger de graves dommages aux colonies en raison de leur reproduction rapide à l'intérieur de la ruche. Les dégâts sont similaires à ceux des Varroa[10].
L’infestation par les acariens du genre Tropilaelaps est une maladie règlementée au sein de l’Union européenne[10].
Maladies bactériennes
| Apparence du rayon de couvain | Âge du couvain mort | Couleur du couvain mort | Consistance du couvain mort | Odeur du couvain mort | Caractéristiques des écailles | Agent infectieux |
|---|---|---|---|---|---|---|
| Couvain operculé, décoloré, enfoncé ou opercules perforés | Généralement larves operculées plus âgées ou jeunes nymphes couchées dans le sens de la longueur dans les cellules | Blanc terne, devenant brun clair, brun café à brun foncé ou presque noir | Mou, devenant collant à filant | Odeur putride légère à prononcée | Allongées uniformément à plat sur la face inférieure de la cellule, adhérant fermement à la paroi, présentant parfois une langue fine et filiforme de mort, tête plate, de couleur noire | Loque américaine |
| Couvain non operculé, certains couvain operculés dans les cas avancés avec des opercules décolorés, enfoncés ou perforés | Généralement jeunes larves non operculées, parfois larves operculées plus âgées, typiquement au stade enroulé | Blanc terne, devenant blanc jaunâtre à brun, brun foncé ou presque noir | Aqueux, rarement collant ou filant, granuleux | Aigre léger à pénétrant | Habituellement entortillées dans la cellule, n'adhérant pas à la paroi cellulaire, caoutchouteuses, de couleur noire | Loque européenne |
Loque américaine
La loque américaine (American foulbrood, histolysis infectiosa perniciosa larvae apium, pestis americana larvae apium), causée par une espèce de bactéries sporulantes, Paenibacillus larvae[12],(anciennement classée B. larvae, puis P. larvae ssp. larvae / pulvifaciens), est la plus répandue et la plus destructrice des maladies du couvain d'abeilles. P. larvae est une bactérie en forme de bâtonnet. Les larves âgées de moins de trois jours sont infectées en ingérant des spores présentes dans leur nourriture. Les jeunes larves de moins de 24 heures sont les plus sensibles à l'infection. Les spores germent dans l'intestin de la larve et les bactéries végétatives commencent à se développer, se nourrissant de la larve. Les spores ne germent pas chez les larves âgées de plus de trois jours. Les larves infectées meurent normalement après que leur cellule est operculée. La forme végétative de la bactérie meurt, mais pas avant d'avoir produit plusieurs millions de spores. Les spores de la loque américaine sont extrêmement résistantes à la dessiccation et peuvent rester viables pendant 80 ans dans le miel et le matériel apicole. Chaque larve morte peut contenir jusqu'à 100 millions de spores. Cette maladie n'affecte que les larves d'abeilles, mais elle est très contagieuse et mortelle pour le couvain d'abeilles. Les larves infectées noircissent et meurent.
Comme pour la loque européenne, des recherches ont été menées en recourant au processus de l'« essaim artificiel »[13] pour lutter contre la loque américaine, « l'avantage étant qu'on n'utilise pas de produits chimiques ».
Loque européenne
La loque européenne (putrificatio polybacterica larvae apium, pestis europea larvae apium) est une maladie provoquée par une espèce de bactéries, Melissococcus plutonius, qui infectent l'intestin moyen des larves d'abeilles. Elle est considérée comme moins grave que la loque américaine[14]. Melissococcus plutonius n'est pas une bactérie sporulée, mais les cellules bactériennes peuvent survivre plusieurs mois sur un substrat de cire. Les symptômes comprennent des larves mortes et mourantes qui peuvent apparaître enroulées vers le haut, brunes ou jaunes, fondues ou dégonflées avec des tubes trachéaux plus apparents, ou desséchées et caoutchouteuses[15].
La loque européenne est souvent considérée comme une maladie de « stress » - dangereuse seulement si la colonie est déjà soumise à un stress pour d'autres raisons. Une colonie par ailleurs saine peut généralement survivre à la loque européenne. Un traitement chimique avec du chlorhydrate d'oxytétracycline peut maîtriser une épidémie de la maladie, mais le miel des colonies traitées peut contenir des résidus chimiques du traitement. L'« essaim artificiel »[16] technique d'apiculture, peut également permettre de maîtriser efficacement la maladie, avec l'avantage d'éviter l'utilisation de produits chimiques. Les traitements prophylactiques ne sont pas recommandés car ils conduisent à des bactéries résistantes.
La recherche scientifique a montré que la propagation de la maladie dépend de la densité. Plus la densité des ruchers est élevée, plus la probabilité de transmission de la maladie est élevée[17].
Maladies fongiques
Couvain plâtré (ascosphérose)
_L.S._Olive_%2526_Spiltoir_1324048.jpg.webp)
Ascosphaera apis provoque une maladie fongique qui infeste l'intestin des larves. Le champignon est en concurrence avec elles pour la nourriture, ce qui les fait mourir de faim. Le champignon continue ensuite à consommer le reste des corps larvaires, les faisant apparaître blancs et « crayeux ».
Le couvain plâtré (ascosphaerosis larvae apium) est le plus souvent visible pendant les printemps humides. Les ruches à couvain plâtré peuvent généralement être récupérées en augmentant la ventilation dans la ruche.
Couvain pétrifié (aspergillose)
Le couvain pétrifié (aspergillosis larvae apium) est une maladie fongique causée par des espèces de champignons du genre Aspergillus : A. fumigatus, A. flavus, et A. niger. Il provoque la momification du couvain d'une colonie d'abeilles mellifères. Ces champignons sont communs dans les sols et sont également pathogènes pour d'autres insectes, oiseaux et mammifères. La maladie est difficile à identifier aux premiers stades de l'infection. Les spores des différentes espèces ont des couleurs différentes et peuvent également causer des affections respiratoires chez l'homme et d'autres animaux. Lorsque les larves d'abeilles absorbent des spores, elles peuvent éclore dans l'intestin, se développant rapidement pour former un anneau en forme de collier près des têtes larvaires. Après la mort, les larves deviennent noires et difficiles à écraser, d'où le nom de couvain pétrifié. Finalement, le champignon émerge du tégument des larves et forme une fausse peau. À ce stade, les larves sont couvertes de spores fongiques poudreuses. Les abeilles ouvrières nettoient le couvain infecté et la ruche peut se rétablir en fonction de facteurs tels que la force de la colonie, le niveau d'infection et les habitudes d'hygiène de la souche d'abeilles (ce caractère varie selon les différentes sous-espèces).
Maladies virales
Maladie noire
La maladie noire est causée par le virus de la paralysie chronique des abeilles (CBPV, Chronic bee paralysis virus). On observe deux types de symptômes.
- Syndrome 1 - Les abeilles subissent un tremblement anormal des ailes et du corps, ne peuvent pas voler et rampent souvent sur le sol et sur les tiges des plantes. Dans certains cas, les abeilles rampantes peuvent être trouvées en grand nombre (1000+). Les abeilles se blottissent ensemble sur le dessus de la grappe ou sur les barres supérieures de la ruche. Elles peuvent avoir l'abdomen gonflé en raison de la distension du sac de miel. Les ailes sont partiellement écartées ou disloquées.
- Syndrome 2 - les abeilles atteintes sont capables de voler, mais sont presque glabres. Elles apparaissent foncées ou noires et paraissent plus petites. Leur abdomen est relativement large. Elles sont souvent grignotées par des abeilles plus âgées dans la colonie et cela peut être la cause de la perte des poils. Elles sont entravées à l'entrée de la ruche par les abeilles gardiennes. Quelques jours après l'infection, le tremblement commence. Elles deviennent alors incapables de voler et meurent rapidement[18],[19].
En 2008, le virus de la paralysie chronique des abeilles a été signalé pour la première fois chez Formica rufa et chez une autre espèce de fourmi, Camponotus vagus[20]
Virus de la paralysie aiguë de l'abeille
Le virus de la paralysie aiguë de l'abeille (ABPV, Acute bee paralysis virus)[21] est considéré comme un agent infectieux commun des abeilles. Il appartient à la famille des Dicistroviridae, tout comme le virus israélien de la paralysie aiguë, le virus de l'abeille du Cachemire et le virus de la cellule royale noire. Il est fréquemment détecté dans des colonies apparemment saines. Ce virus semble jouer un rôle dans les cas d'effondrement soudain des colonies d'abeilles mellifères infestées par l'acarien parasite Varroa destructor[23].
Virus israélien de la paralysie aiguë
Un virus apparenté décrit en 2004 est connu comme le virus israélien de la paralysie aiguë (IAPV, Israeli acute paralysis virus)[24]. Ce virus porte le nom de l'endroit où il a été identifié pour la première fois - son lieu d'origine est toutefois inconnu. Il a été suggéré comme marqueur associé au syndrome d'effondrement des colonies d'abeilles[25],[26]
Virus de l'abeille du Cachemire
Le virus de l'abeille du Cachemire (KBV, Kashmir bee virus)[27] est apparenté aux virus précédents. Récemment découvert, il n'est actuellement positivement identifiable que par un test de laboratoire. On en sait encore peu[28]
Virus de la cellule royale noire
Le virus de la cellule royale noire (BQCV, Black queen cell virus)[29] affecte la larve de la reine qui devient noire et meurt. On estime que ce virus est associé à des espèces de champignon du genre Nosema, responsables de la nosémose[30]
Virus des ailes nuageuses
Le virus des ailes nuageuses (CWV, Cloudy wing virus) est un petit virus icosaédrique, peu étudié, que l'on trouve couramment chez les abeilles mellifères, en particulier dans les colonies en effondrement infestées par Varroa destructor, fournissant des preuves circonstancielles que l'acarien peut agir comme un vecteur[31],[32]
Virus du couvain sacciforme
Un virus semblable au Picornavirus, le virus du couvain sacciforme (SBV, Sacbrood virus) provoque une maladie du couvain[33],[34]. Les larves affectées passent du blanc nacré au gris et enfin au noir. La mort survient lorsque les larves sont dressées, juste avant la pupaison. Par conséquent, les larves affectées se trouvent généralement dans des cellules operculées. Le développement de la tête des larves malades est généralement retardé. La région de la tête est généralement plus sombre que le reste du corps et peut pencher vers le centre de la cellule. Lorsque les larves affectées sont soigneusement retirées de leurs cellules, elles semblent être un sac rempli d'eau. En règle générale, les écailles sont cassantes mais faciles à enlever. Les larves atteintes du couvain sacciforme n'ont pas d'odeur caractéristique[35]
Virus des ailes déformées
Le virus des ailes déformées (DWV, Deformed wing virus) est l'agent causal de la déformation des ailes et d'autres malformations corporelles généralement observées dans les colonies d'abeilles qui sont fortement infestées par des acariens parasites, Varroa destructor[36]. Le DWV fait partie d'un complexe de souches / espèces de virus étroitement apparentées qui comprend également le virus Kakugo (KV), le virus 1 du Varroa destructor (VDV1)[37] et le virus de l'abeille d'Égypte (EBV). Les déformations sont produites presque exclusivement en raison de la transmission du DWV par Varroa destructor quand il parasite les nymphes. Les abeilles infectées à l'âge adulte ne présentent aucun symptôme, même si elles présentent des changements de comportement et ont une espérance de vie réduite. Les abeilles aux ailes déformées sont rapidement expulsées de la colonie, ce qui entraîne une perte progressive d'abeilles adultes pour le maintien de la colonie. Si cette perte est excessive et ne peut plus être compensée par l'émergence d'abeilles en bonne santé, la colonie diminue et meurt rapidement.
Virus Kakugo
Le virus Kakugo (KV, Kakugo virus) est une espèce de virus du genre Iflavirus infectant les abeilles. Les acariens du genre Varroa peuvent favoriser sa prévalence[38].
Virus iridescent des invertébrés type 6 (IIV-6)
En appliquant des outils de dépistage d'agents pathogènes basés sur la protéomique en 2010, des chercheurs ont annoncé qu'ils avaient identifié une co-infection par un Iridovirus[39], en l’occurrence le virus iridescent des invertébrés type 6 (IIV-6, Invertebrate iridescent virus type 6) et Nosema ceranae dans toutes les colonies effondrées de l'échantillon[40]. Sur la base de cette recherche, le New York Times a rapporté que le mystère de l'effondrement des colonies était résolu, citant le chercheur Dr Bromenshenk, co-auteur de l'étude, « [Le virus et le champignon] sont tous deux présents dans toutes ces colonies effondrées. »[41],[42]. Les preuves de cette association restent toutefois minimes[43] et plusieurs auteurs ont contesté la méthodologie originale utilisée pour associer l'effondrement des colonies à l'IIV-6[44],[45]
Virus des taches en anneaux du tabac
Le virus des taches en anneaux du tabac (TRSV, Tobacco ringspot virus), virus à ARN phytopathogène, a été décrit comme infectant les abeilles par l'intermédiaire du pollen contaminé[46], mais cette affirmation inhabituelle a été rapidement contestée et reste à confirmer[47].
Virus du lac Sinaï
En 2015, les génomes du virus du lac Sinaï (LSV, Lake Sinai virus) ont été assemblés et trois domaines principaux ont été découverts : Orf1 (cadre de lecture ouvert), une polymérase à ARN dépendante de l'ARN et les séquences protéiques de la capside.. Les souches LSV1, LSV2, LSV3, LSV4, LSV5 et LSV6 ont été décrites[48]. Le LSV a été détecté chez les abeilles, les acariens et dans le pollen. Il ne se reproduit activement que chez les abeilles mellifères et les abeilles maçonnes (Osmia cornuta) et pas chez les acariens Varroa[49]
Dysenterie
La dysenterie n'est pas une maladie imputable à un agent pathogène, mais une condition des abeilles et de la ruche lié à diverses perturbations. Elle résulte d'une combinaison de longues périodes d'incapacité des abeilles à effectuer des vols de nettoyage (généralement en raison du froid) et de réserves alimentaires contenant une forte proportion de matières non digestibles. Au fur et à mesure que l'intestin d'une abeille est engorgé de matières fécales qui ne peuvent pas être évacuées en vol comme le préfèrent les abeilles, l'abeille se vide dans la ruche. Quand suffisamment d'abeilles font cela, la population de la ruche s'effondre rapidement et la colonie meurt. Les miels foncés et les miellats contiennent de plus grandes quantités de matière non digestible.
Les journées chaudes occasionnelles en hiver sont essentielles à la survie des abeilles domestiques. Les problèmes de dysenterie augmentent en probabilité pendant des périodes de plus de deux ou trois semaines avec des températures inférieures à 10 ° C. Lorsque les vols de nettoyage sont rares, les abeilles sont souvent forcées de sortir à des moments où la température est à peine suffisante pour que les muscles de leurs ailes fonctionnent, et un grand nombre d'abeilles peuvent être vues mortes dans la neige autour des ruches. Les colonies retrouvées mortes au printemps de la dysenterie présentent des excréments étalés sur les cadres et autres parties de la ruche.
Dans les régions très froides d'Amérique du Nord et d'Europe, où les abeilles mellifères sont gardées dans des bâtiments ventilés pendant la partie la plus froide de l'hiver, aucun vol de nettoyage n'est possible. Dans de telles circonstances, les apiculteurs retirent généralement tout le miel des ruches et le remplacent par de l'eau sucrée ou du sirop de maïs à haute teneur en fructose, qui ne contiennent presque pas de matière indigeste.
Couvain refroidi
Le couvain refroidi n'est pas réellement une maladie, mais peut être le résultat de mauvais traitements infligés aux abeilles par l'apiculteur. Ce syndrome peut également être causé par des pesticides qui tuent principalement la population adulte, ou par une baisse soudaine de la température pendant la montée rapide du printemps. Le couvain doit être maintenu au chaud en tout temps. Les abeilles nourricières se regroupent au-dessus du couvain pour le maintenir à la bonne température. Lorsqu'un apiculteur ouvre la ruche (pour inspecter, retirer le miel, vérifier la reine ou simplement pour regarder) et empêche les abeilles nourricières de se regrouper sur le cadre pendant trop longtemps, le couvain peut se refroidir, se déformer ou même tuer certaines des abeilles
Pertes dues aux pesticides
Les abeilles mellifères sont sensibles à de nombreux produits chimiques utilisés pour les traitements agricoles contre d'autres insectes et ravageurs. De nombreux pesticides sont connus pour être toxiques pour les abeilles. Comme les abeilles se nourrissent jusqu'à plusieurs kilomètres de la ruche, elles peuvent voler dans des zones soumises à des pulvérisations actives par les agriculteurs et où elles peuvent récolter du pollen de fleurs contaminées.
Les pesticides de la famille des carbamates, comme le carbaryl, peuvent être particulièrement pernicieux car la toxicité peut prendre jusqu'à deux jours pour se manifester, ce qui permet au pollen infecté d'être renvoyé et distribué dans toute la colonie. Les organophosphates et autres insecticides sont également connus pour tuer les grappes d'abeilles domestiques dans les zones traitées.
Les pertes dues aux pesticides peuvent être relativement faciles à identifier (caractère soudain et nombre important d'abeilles mortes devant la ruche) ou assez difficiles, surtout si la perte résulte d'une accumulation progressive de pesticides apporté par les abeilles butineuses. Les pesticides à action rapide peuvent priver la ruche de ses butineuses, qui peuvent tomber dans le champ avant de pouvoir rentrer chez elles.
Pour les insecticides toxiques pour les abeilles, les étiquettes donnent des instructions aux utilisateurs pour protéger les abeilles de l'empoisonnement pendant qu'elles se nourrissent. Pour se conformer à ces instructions, les applicateurs doivent savoir où et quand les abeilles se nourrissent dans la zone d'application, et la durée d'activité résiduelle du pesticide.
Certaines autorités chargées de la réglementation des pesticides recommandent, et certaines juridictions l'exigent, qu'un avis de pulvérisation soit envoyé à tous les apiculteurs connus dans la région, afin qu'ils puissent sceller l'entrée de leurs ruches et garder les abeilles à l'intérieur jusqu'à ce que le pesticide ait eu une chance de se disperser. Cependant, cela ne résout pas tous les problèmes associés à la pulvérisation et les instructions sur l'étiquette doivent être suivies quoi qu'il en soit. Empêcher les abeilles domestiques de voler par temps chaud peut tuer les abeilles. La notification de l'apiculteur n'offre aucune protection aux abeilles, si l'apiculteur ne peut pas y accéder, ni aux abeilles indigènes ou sauvages. Ainsi, la notification des apiculteurs en tant que seule procédure de protection ne protège pas réellement tous les pollinisateurs de la zone et constitue en fait un contournement des exigences en matière d'étiquetage. Les pertes de pesticides sont un facteur majeur du déclin des pollinisateurs.
Syndrome d'effondrement des colonies d'abeilles
Le syndrome d'effondrement des colonies d'abeilles est un phénomène mal compris dans lequel les abeilles ouvrières d'une ruche ou d'une colonie d'abeilles mellifères européennes disparaissent brusquement. Le syndrome d'effondrement des colonies a été découvert à l'origine en Floride par David Hackenberg dans des colonies d'abeilles européennes à la fin de l'année 2006[50].
Les apiculteurs européens ont observé un phénomène similaire en Belgique, France, Pays-Bas, Grèce, Italie, Portugal et Espagne[51], et les rapports initiaux sont également venus de Suisse et d'Allemagne, quoique dans une moindre mesure[52]. Des cas possibles d'effondrement des colonies d'abeilles ont également été signalés à Taïwan depuis avril 2007[53].
Les hypothèses initiales étaient très diverses, incluant le stress lié aux changements environnementaux[54], la malnutrition, les pathogènes (c.-à-d. les maladies[55], y compris le virus israélien de la paralysie aiguë[56],[57]), les acariens, ou la classe de pesticides connue sous le nom de néonicotinoïdes, qui comprend l'imidaclopride, la clothianidine et le thiaméthoxame. La plupart des nouvelles recherches suggèrent cependant que l'hypothèse des néonicotinoïdes était incorrecte et que les pesticides jouent peu de rôle dans le syndrome d'effondrement des colonies d'abeilles par rapport aux infestations de Varroa et de Nosema[58]. D'autres théories impliquaient le rayonnement des téléphones cellulaires ou d'autres appareils artificiels[59], ainsi que les plantes cultivées génétiquement modifiées ayant des caractéristiques de lutte antiparasitaire[60]. En 2010, des chercheurs américains ont annoncé avoir identifié une co-infection par le virus iridescent des invertébrés de type 6 (IIV-6) et Nosema ceranae dans toutes les colonies effondrées de l'échantillon[40]
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « List of diseases of the honey bee » (voir la liste des auteurs).
- (en) Natalia Damiani, Liesel B. Gende, Pedro Bailac, Jorge A. Marcangeli et Martín J. Eguaras, « Acaricidal and insecticidal activity of essential oils on Varroa destructor (Acari: Varroidae) and Apis mellifera (Hymenoptera: Apidae) », Parasitology Research, vol. 106, no 1, , p. 145–152 (DOI 10.1007/s00436-009-1639-y).
- (en) « Home », apivar.net.
- (en) « NOD Apiary Products Ltd. », nodglobal.com.
- (en) « Formic Acid (214900) Fact Sheet », sur Office of Pesticide Programs; US Environmental Protection Agency, .
- (en) Bailey L & Ball BV, Honey Bee Pathology, Academic Press, (ISBN 978-0-12073481-8), p. 119.
- (en) Ritter, Wolfgang, « Nosema ceranae », .
- (en) « Effects of Bt maize pollen on the honeybee », (consulté le ).
- (en) « The biology of the small hive beetle (Aethina tumida, Coleoptera: Nitidulidae): Gaps in our knowledge of an invasive species », Apidologie, vol. 35, no 3, , p. 229–47 (DOI 10.1051/apido:2004010).
- (en) « Combat Source Kill Max Gel Kills Large and Small Roaches », combatbugs.com.
- « Les acariens du genre Tropilaelaps spp. », sur Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (Anses) (consulté le ).
- (en) Shimanuki, Hachiro et Knox, David A., « Diagnosis of Honey Bee Diseases », sur USDA, .
- (en) E Genersch, Forsgren, E, Pentikäinen, J, Ashiralieva, A, Rauch, S, Kilwinski, J et Fries, I, « Reclassification of Paenibacillus larvae subsp. pulvifaciens and Paenibacillus larvae subsp. larvae as Paenibacillus larvae without subspecies differentiation », International Journal of Systematic and Evolutionary Microbiology, vol. 56, no Pt 3, , p. 501–11 (DOI 10.1099/ijs.0.63928-0).
- (en) « Controlling American Foulbrood in Honeybees By Shook Swarm Method », sur Pakistan Journal of Agricultural Research (consulté le )
- (en) « American and European Foulbrood », sur Bee Health eXtension, (consulté le ).
- (en) « European Foulbrood: A Bacterial Disease Affecting Honey Bee Brood », extension.org.
- « Shook Swarm and OTC Antibiotics for European Foulbrood Control », sur extension.org (consulté le ).
- (en) Raphael S. von Büren, Bernadette Oehen, Nikolaus J. Kuhn et Silvio Erler, « High-resolution maps of Swiss apiaries and their applicability to study spatial distribution of bacterial honey bee brood diseases », PeerJ, vol. 7, , e6393 (ISSN 2167-8359, DOI 10.7717/peerj.6393).
- (en) « Detection of chronic honey bee (Apis mellifera L.) paralysis virus infection: application to a field survey », Apidologie, vol. 31, no 5, , p. 567–77 (DOI 10.1051/apido:2000147).
- (en) « Chronic Bee Paralysis Virus », globalnet.co.uk.
- (en) O Celle, P Blanchard, V Olivier, F Schurr, N Cougoule, JP Faucon et M Ribière, « Detection of Chronic bee paralysis virus (CBPV) genome and its replicative RNA form in various hosts and possible ways of spread », Virus Research, vol. 133, no 2, , p. 280–4 (DOI 10.1016/j.virusres.2007.12.011, lire en ligne).
- (TaxID 92444)
- (en) « Phylogenetic analysis of acute bee paralysis virus strains », Appl. Environ. Microbiol., vol. 68, no 12, , p. 6446–50 (DOI 10.1128/AEM.68.12.6446-6450.2002).
- (TaxID 294365).
- (en) Maggie Fox, « New virus may be killing bees », Reuters, (consulté le ).
- (en) Humberto F. Boncristiani, « In vitro infection of pupae with IAPV suggests disturbance of transcriptional homeostasis in honey bees (Apis mellifera) », PLOS One, vol. 8, no 9, , e73429 (DOI 10.1371/journal.pone.0073429).
- (TaxID 68876)
- (en) « Kashmir Bee Virus » (version du 2 mars 2007 sur l'Internet Archive), sur Apiculture Factsheet #230, Ministry of Agriculture and Lands, Government of British Columbia, .
- (TaxID 92395)
- (en) « Multiple Virus Infections in the Honey Bee and Genome Divergence of Honey Bee Viruses », usda.gov.
- (en) Norman L Carreck, Brenda V Ball et Stephen J Martin, « The epidemiology of cloudy wing virus infections in honey bee colonies in the UK », Journal of Apicultural Research, vol. 49, no 1, , p. 66–71 (DOI 10.3896/ibra.1.49.1.09, lire en ligne).
- (en) Gliński, Z. et Jarosz, J., « Infection and immunity in the honey bee Apis mellifera », Apiacta, vol. 36, no 1, , p. 12–24 (lire en ligne).
- (en) CY Wu, CF Lo, CJ Huang, HT Yu et CH Wang, « The complete genome sequence of Perina nuda picorna-like virus, an insect-infecting RNA virus with a genome organization similar to that of the mammalian picornaviruses », Virology, vol. 294, no 2, , p. 312–23 (DOI 10.1006/viro.2001.1344).
- (en) E Grabensteiner, W Ritter, MJ Carter, S Davison, H Pechhacker, J Kolodziejek et O Boecking, « Sacbrood Virus of the Honeybee (Apis mellifera): Rapid Identification and Phylogenetic Analysis Using Reverse Transcription-PCR », Clinical and Diagnostic Laboratory Immunology, vol. 8, no 1, , p. 93–104 (DOI 10.1128/CDLI.8.1.93-104.2001).
- (en) Elvira Grabensteiner, Wolfgang Ritter, Michael J. Carter, Sean Davison, Hermann Pechhacker, Jolanta Kolodziejek et Otto Boecking, « Sacbrood Virus of the Honeybee (Apis mellifera): Rapid Identification and Phylogenetic Analysis Using Reverse Transcription-PCR », Clinical and Diagnostic Laboratory Immunology, vol. 8, no 1, , p. 93–104 (DOI 10.1128/CDLI.8.1.93-104.2001).
- (en) Joachim R. de Miranda et Genersch, Elke, « Deformed wing virus », Journal of Invertebrate Pathology, vol. 103, , S48–S61 (DOI 10.1016/j.jip.2009.06.012).
- (en) Juliette R. Ongus, Els C. Roode, Cornelis W. A. Pleij, Just M. Vlak et Monique M. van Oers, « The 5' non-translated region of Varroa destructor virus 1 (genus Iflavirus): structure prediction and IRES activity in Lymantria dispar cell », J Gen Virol, vol. 87, , p. 3397–3407 (DOI 10.1099/vir.0.82122-0, lire en ligne).
- (en) Tomoko Fujiyuki, Seii Ohka, Hideaki Takeuchi, Masato Ono, Akio Nomoto & Takeo Kubo, « Prevalence and Phylogeny of Kakugo Virus, a Novel Insect Picorna-Like Virus That Infects the Honeybee (Apis mellifera L.), under Various Colony Conditions », Journal of Virology, vol. 80, no 23, , p. 11528–38 (lire en ligne).
- Williams, Trevor Iridoviridae Instituto de Ecología AC (INECOL)Mexico.
- (en) Walter S. Leal, Jerry J. Bromenshenk, Colin B. Henderson, Charles H. Wick, Michael F. Stanford, Alan W. Zulich et Rabih E. Jabbour, « Iridovirus and Microsporidian Linked to Honey Bee Colony Decline », PLOS ONE, vol. 5, no 10, , e13181 (DOI 10.1371/journal.pone.0013181, Bibcode 2010PLoSO...513181B).
- (en) Kirk Johnson, « Scientists and Soldiers Solve a Bee Mystery », The New York Times, (lire en ligne).
- Invertebrate iridescent virus type 6 (IIV-6) Universal Protein Resource (UniProt); European Bioinformatics Institute (EBI), the Swiss Institute of Bioinformatics (SIB) and the Protein Information Resource (PIR).
- (en) Rafal Tokarz, Cadhla Firth, Craig Street, Diana Cox-Foster et W. Ian Lipkin, « Lack of evidence for an Association between Iridovirus and Colony Collapse Disorder », PLOS ONE, vol. 6, no 6, , e21844 (DOI 10.1371/journal.pone.0021844, Bibcode 2011PLoSO...621844T).
- (en) Leonard Foster, « Interpretation of data underlying the link between colony collapse disorder (CCD) and an invertebrate iridescent virus », Molecular & Cellular Proteomics, vol. 10, no 3, , M110.006387 (DOI 10.1074/mcp.m110.006387).
- (en) Giselle Knudsen et Robert Chalkley, « The Effect of Using an Inappropriate Protein Database for Proteomic Data Analysis », PLOS ONE, vol. 6, no 6, , e20873 (DOI 10.1371/journal.pone.0020873, Bibcode 2011PLoSO...620873K).
- (en) J. L. Li, Cornman, R. S., Evans, J. D., Pettis, J. S., Zhao, Y., Murphy, C. et Peng, W. J., « Systemic Spread and Propagation of a Plant-Pathogenic Virus in European Honeybees, Apis mellifera », mBio, vol. 5, no 1, , e00898–13 (DOI 10.1128/mBio.00898-13).
- (en) W. Allen Miller, Jimena Carrillo-Tripp, Bryony C. Bonning, Adam G. Dolezal et Amy L. Toth, « Conclusive Evidence of Replication of a Plant Virus in Honeybees Is Lacking », mBio, vol. 5, no 3, , e00985-14 (ISSN 2150-7511, DOI 10.1128/mBio.00985-14).
- (en) Katie F. Daughenbaugh, « Honey Bee Infecting Lake Sinai Viruses », Viruses, vol. 7, no 6, , p. 3285–3309 (DOI 10.3390/v7062772).
- (en) Jorgen Ravoet, « Genome sequence heterogeneity of Lake Sinai Virus found in honey bees and Orf1/RdRP-based polymorphisms in a single host », Virus Research, vol. 201, , p. 67–72 (DOI 10.1016/j.virusres.2015.02.019).
- (en) « Honey Bee Die-Off Alarms Beekeepers, Crop Growers and Researchers », Penn State University College of Agricultural Sciences, (lire en ligne).
- Gaëlle Dupont, « Les abeilles malades de l'homme », Le Monde, (lire en ligne).
- (de) Petra Steinberger, « Das spurlose Sterben », sueddeutsche.de, (lire en ligne).
- Paul Molga, « La mort des abeilles met la planète en danger », Les Échos, (lire en ligne).
- (en) Amy Sahba, « The mysterious deaths of the honeybees », CNN Money, (lire en ligne, consulté le ).
- (en) « Colony Collapse Disorder Working Group ».
- (en) JR Minkel, « Mysterious Honeybee Disappearance Linked to Rare Virus », Scientific American, (lire en ligne, consulté le ).
- (en) Andrew C. Refkin, « Virus Is Seen as Suspect in Death of Honeybees », The New York Times, (lire en ligne, consulté le ).
- (en) Jon Entine, « 'Gold standard' assessing neonicotinoids: Field bee hive studies find pesticides not major source of health issues », Genetic Literacy Project, (lire en ligne, consulté le ).
- (en) Geoffrey Lean et Harriet Shawcross, « Are mobile phones wiping out our bees? », The Independent, (lire en ligne, consulté le ).
- (en) « GE and bee Colony Collapse Disorder – science needed! », (consulté le ).
Voir aussi
Articles connexes
Bibliographie
- Jean-Paul Faucon, Marie-Pierre Chauzat, « Varroase et autres maladies des abeilles : causes majeures de mortalité des colonies en France », Bulletin de l'Académie vétérinaire de France, vol. 161, no 3, , p. 257-263 (DOI 10.4267/2042/47949, lire en ligne).
- Nicolas Vidal-Naquet, « Les maladies de l'abeille domestique d'élevage, Apis mellifera L. », Bulletin de l'Académie vétérinaire de France, vol. 165, no 4, , p. 307-316 (DOI 10.4267/2042/48811, lire en ligne).
Liens externes
- « Les maladies des abeilles », sur Organisation mondiale de la santé animale (OIE) (consulté le ).
- (en) Guido Cordoni, « Bee infectious diseases », sur http://beediseases.altervista.org.
- (en) Shimanuki, Hachiro & Knox, David A., « Diagnosis of Honey Bee Diseases », sur US Department of Agriculture, (consulté le )
- Portail de l’entomologie
- Portail de l’agriculture et l’agronomie