Micro-ARN 22
Le micro-ARN 22 (miR-22) est un micro-ARN impliqué dans de nombreux processus physiologiques tels que le développement embryonnaire, le métabolisme squelettique, les modifications épigénétiques mais aussi pathologiques comme l'hypertrophie des cellules musculaires cardiaques, le trouble panique et le cancer[2]. Il a notamment un rôle suppresseur de tumeur[3]. MiR-22 est exprimé dans de nombreux tissus mais son expression est enrichie dans la vessie, le tissu adipeux, le muscle squelettique, lisse et cardiaque[2],[4]. Il est localisé sur le petit bras du chromosome 17 (17p13), dans une région fréquemment hyper-méthylée ou délétée en cas de cancer[2]. La séquence de miR-22 est ancienne et fortement conservée par l'évolution ; le plus ancien homologue est retrouvé chez l'oursin pourpre[2].
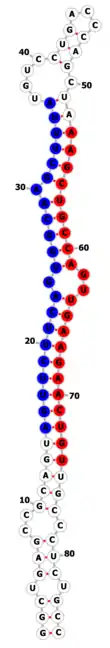
Séquence
Chez l'humain, le brin impliqué dans la régulation post-transcriptionnelle majoritairement incorporé au complexe RISC est localisé en 3' du duplex miARN/miARN* mature. Sa séquence est la suivante :
- 5'- aagcugccaguugaagaacugu -3' (miR-22-3p, la "graine" est soulignée)[5].
Chez l'oursin pourpre, la séquence est la suivante :
- 5'- uauaugcccggugaaguguaua -3' (miR-22-3p, les différences de séquences apparaissent en gras)[6].
Comme nous pouvons le constater, 11 nucléotides sont conservés sur les 22 que compte ce miRNA, soit un degré d'identité de 50%. La probabilité que les séquences humaines et de l'oursin se ressemblent autant de manière aléatoire est, approximativement, de 1 pour 100 millions (). Cela peut paraître peu et indiquer une conservation, mais rapporté à la taille du génome de l'oursin (~800 millions de paires de bases) cette ressemblance pourrait en fait apparaître de manière aléatoire 8 fois dans le génome. Rapporté à la taille du génome humain (~3,2 milliards de paires de bases), cette ressemblance pourrait apparaître de manière aléatoire 32 fois dans le génome. Par ailleurs, une bonne conservation de la séquence ne signifie pas forcément que la séquence est fonctionnelle ni que sa fonction est conservée. L'identité de séquence doit donc toujours être relativisée et la conservation de fonction validée expérimentalement.
Régulation
L'expression de miR-22 est régulée par le facteur de transcription p53[3],[7].
Cibles
MiR-22 agirait par régulation post-transcriptionnelle de l'expression de gènes comme Akt3 (en) ou HDAC6 (en)[7].
| Gène | Contexte cellulaire/tissulaire | Référence |
|---|---|---|
| p21 | lignée de cellules HCT116 (en)/cancer du colon | [3] |
| Sirt1 | Cardiomyocytes/cœur | [4] |
| Hdac4 | Cardiomyocytes/cœur | [4] |
| Pparα | Cœur | [7] |
Rôles
MiR-22 est régulé lors de la différenciation des cellules musculaires cardiaques[4].
L'expression de miR-22 augmenterait dans les cellules cardiaques, de manière dépendante de p53, lors du processus de vieillissement normal[7]. MiR-22 agirait alors comme inhibiteur du processus d'autophagie cardiaque, processus normalement destiné à "nettoyer" le tissu cardiaques des cellules dysfonctionnelles.
Pathologies
Tumorales
À la suite de l'exposition à un agent de stress génotoxique (la doxorubicine), l'expression de miR-22 est induite par p53, favorisant la suppression des cellules tumorales par le processus d'apoptose. MiR-22 agirait en ciblant le régulateur du cycle cellulaire p21, conduisant à une diminution de son expression par régulation post-transcriptionnelle, un arrêt du cycle cellulaire et la mort de la cellule tumorale[3].
Cardiaques
En cas de stress biomécanique ou pathologique, les cellules musculaires cardiaques s'adaptent en s'hypertrophiant afin de maintenir la fonction cardiaque. Cependant, si cette adaptation se prolonge dans le temps et devient chronique, il existe des risques d'insuffisance cardiaque ou de mort subite. MiR-22 est surexprimé dans le cas d'une hypertrophie cardiaque et interviendrait notamment dans l'hypertrophie ventriculaire gauche. Dans un modèle de souris transgéniques pour lesquelles miR-22 a été délété spécifiquement dans le cœur, des facteurs de stress (isoprotérénol, calcineurine) ne sont plus capables d'induire hypertrophie et remodelage (en) cardiaques[4]. MiR-22 serait donc le médiateur génétique par lequel un stress biomécanique ou pathologique induirait de l'hypertrophie cardiaque.
L'inhibition pharmacologique de miR-22, par des acides nucléiques bloqués, libérerait le processus d'autophagie cardiaque et inhiberait ainsi l'hypertrophie cellulaire ; ce faisant, elle limiterait le remodelage post-infarctus et améliorerait la fonction cardiaque[7].
Biomarqueur
MiR-22 pourrait être utilisé comme marqueur biologique permettant le pronostic de certaines pathologies. En effet, un taux élevé de miR-22 circulant a été fortement corrélé à une mortalité précoce chez 154 patients ayant souffert d'insuffisance cardiaque (dysfonction systolique)[7].
Notes et références
- (en) Gruber AR, Lorenz R, Bernhart SH, Neuböck R et Hofacker IL., « The Vienna RNA websuite. », Nucleic Acids Res., vol. 36, no Web Server issue, , W70-4 (PMID 18424795, PMCID PMC2447809, DOI 10.1093/nar/gkn188, lire en ligne [PDF], consulté le )
- (en) Xiong J., « Emerging roles of microRNA-22 in human disease and normal physiology. », Curr Mol Med., vol. 12, no 3, , p. 247-58 (PMID 22300138, DOI 10.2174/156652412799218886, lire en ligne, consulté le )
- (en) Tsuchiya N, Izumiya M, Ogata-Kawata H, Okamoto K, Fujiwara Y, Nakai M, Okabe A, Schetter AJ, Bowman ED, Midorikawa Y, Sugiyama Y, Aburatani H, Harris CC et Nakagama H., « Tumor suppressor miR-22 determines p53-dependent cellular fate through post-transcriptional regulation of p21 », Cancer Res., vol. 71, no 13, , p. 4628-39 (PMID 21565979, DOI 10.1158/0008-5472.CAN-10-2475, lire en ligne [PDF], consulté le )
- (en) Huang ZP, Chen J, Seok HY, Zhang Z, Kataoka M, Hu X et Wang DZ., « MicroRNA-22 regulates cardiac hypertrophy and remodeling in response to stress. », Circ Res., vol. 112, no 9, , p. 1234-43 (PMID 23524588, PMCID PMC3720677, DOI 10.1161/CIRCRESAHA.112.300682, lire en ligne [PDF], consulté en )
- hsa-miR-22-3p dans la base de données miRBase
- spu-miR-22-3p dans la base de données miRBase
- (en) Gupta SK, Foinquinos A, Thum S, Remke J, Zimmer K, Bauters C, de Groote P, Boon RA, de Windt LJ, Preissl S, Hein L, Batkai S, Pinet F et Thum T., « Preclinical Development of a MicroRNA-Based Therapy for Elderly Patients With Myocardial Infarction. », J Am Coll Cardiol., vol. 68, no 14, , p. 1557-71 (PMID 27687198, DOI 10.1016/j.jacc.2016.07.739, lire en ligne [PDF], consulté le )
Annexes
Articles connexes
- Portail de la biologie cellulaire et moléculaire
- Portail de la médecine