Modèles du neurone biologique
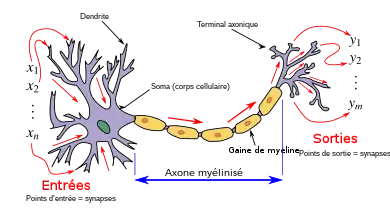
Les modèles de neurones biologiques, également connus sous le nom de modèles de neurones à impulsion[1], sont des descriptions mathématiques des propriétés des neurones, un type de cellules du système nerveux qui génèrent des potentiels électriques d'une durée d'environ une milliseconde à travers leur membrane cellulaire. Ces potentiels électriques sont appelés potentiels d'action, pics ou impulsions (Figure 2). Les impulsions circulent le long de l'axone jusqu'aux synapses du neurone émetteur et sont transmises à de nombreux autres neurones. Les neurones à impulsions décrivant un des aspects majeur du système nerveux, ils sont considérés comme une unité fondamentale de traitement de l'information du système nerveux.

Les différents modèles de neurones à impulsions peuvent être divisés en différentes catégories : les modèles mathématiques les plus détaillés sont les modèles de neurones biophysiques (également appelés modèles de Hodgkin-Huxley) qui décrivent la tension membranaire en fonction du courant d'entrée et de l'activation des différents canaux ioniques. Plus simple mathématiquement, les modèles d'intégration-et-tir décrivent la tension membranaire en fonction du courant d'entrée et prédisent les impulsions sans description des processus biophysiques à l'origine du potentiel d'action. Des modèles encore plus abstraits prédisent uniquement les impulsions de sortie (mais pas la tension membranaire) en fonction de stimulation pouvant provenir d'une entrée sensorielle ou pharmacologique.
Cet article fournit un bref aperçu des différents modèles de neurones à impulsions et, dans la mesure du possible, des liens avec les phénomènes décrits. Les modèles présentés peuvent être aussi bien déterministes que probabilistes.
Introduction : contexte biologique, classification et objectifs des modèles neuronaux
Cellules sans impulsions, cellules à impulsions et leur mesure
Toutes les cellules du système nerveux ne produisent pas le type d'impulsions utilisé dans les modèles de neurones à impulsions. C'est par exemple le cas pour les cellules ciliées cochléaires, les cellules réceptrices rétiniennes et les cellules bipolaires rétiniennes. De plus notre système nerveux n'est pas composé uniquement de neurones mais aussi en grande partie de cellules gliales .
On peut mesurer l'activité neuronale par différentes techniques, telles que la technique de mesure « Cellule entière », qui capture les impulsions d'un seul neurone et produit des potentiels d'action de pleine amplitude.
Avec les techniques de mesure extra-cellulaire, une électrode (ou un réseau de plusieurs électrodes) est inséré à proximité de neurones mais on mesure alors l'activité de plusieurs neurones. On peut tout de même différencier les impulsions provenant de plusieurs sources (le nombre variant en fonction de la taille de l'électrode et de sa proximité avec les sources) avec des techniques de traitement du signal. La mesure extra-cellulaire présente plusieurs avantages : 1) elle est plus facile à obtenir expérimentalement; 2) elle est robuste et dure plus longtemps; 3) elle peut refléter l'effet dominant, en particulier lorsqu'elle est effectuée dans une région anatomique avec de nombreuses cellules similaires.
Présentation des modèles de neurones
On distingue deux catégories de modèles en fonction des unités physiques utilisés à l'interface des modèles. Chaque catégorie pourrait être subdivisée en fonction du niveau d'abstraction/de détail :
- Modèles de tension membranaire entrée-sortie électrique – Ces modèles produisent une prédiction de la tension de sortie membranaire en fonction de la stimulation électrique donnée comme entrée (sous forme d'un courant ou d'une tension). Les différents modèles de cette catégorie diffèrent par la relation exacte entre le courant d'entrée et la tension de sortie et par le niveau de détails. Certains modèles de cette catégorie ne prédisent que le moment d'apparition de l'impulsion de sortie (également appelé « potentiel d'action »); d'autres modèles sont plus détaillés et tiennent compte des processus subcellulaires. Les modèles de cette catégorie peuvent être déterministes ou probabilistes.
- Stimulation naturelle ou modèles de neurones d'entrée pharmacologiques - Les modèles de cette catégorie relient le stimulus d'entrée, qui peut être pharmacologique ou naturel, à la probabilité d'un événement d'impulsions. L'étage d'entrée de ces modèles n'est pas électrique, mais comporte soit des unités de concentration pharmacologiques (chimiques), soit des unités physiques qui caractérisent un stimulus externe tel que la lumière, le son ou d'autres formes de pression physique. De plus, l'étage de sortie représente la probabilité d'un déclenchement d'impulsion et non une tension électrique.
Même s'il n'est pas inhabituel en science et en ingénierie d'avoir plusieurs modèles descriptifs pour différents niveaux d'abstraction ou de détail, le nombre de modèles de neurones biologiques est exceptionnellement élevé. Cette situation s'explique par nombre important de paramètres expérimentaux, et par la difficulté de séparer les propriétés intrinsèques d'un seul neurone des effets de mesures et des interactions de nombreuses cellules (effets du réseau). Pour accélérer la convergence vers une théorie unifiée, nous listons plusieurs modèles dans chaque catégorie et également, le cas échéant, des références à des expériences de soutenant ces théories.
Objectifs des modèles de neurones
À terme, les modèles de neurones biologiques visent à expliquer les mécanismes qui sous-tendent le fonctionnement du système nerveux. La modélisation aide à analyser les données expérimentales et à répondre à des questions telles que : Comment les impulsions d'un neurone sont-elles liés à une stimulation sensorielle ou à une activité motrice telle que les mouvements du bras ? Quel est le code neuronal sous-jacent dans le système nerveux ? Quels modèles peuvent être utilisés dans le cadre de réseaux de neurones artificiels à impulsions ? Ces modèles sont également importants dans le contexte de la restauration des fonctions cérébrales perdues grâce à des dispositifs neuroprothétiques.
Perspective moderne de développement
Les modèles développé dans cet article sont des idéalisations. Les vues modernes concernant le rôle du modèle scientifique suggèrent que « tous les modèles sont faux mais certains sont utiles » (Box et Draper, 1987, Gribbin, 2009 ; Paninski et al., 2009).
Des corrections doivent être apportées pour l'augmentation de la surface membranaire donnée par de nombreuses épines dendritiques, des températures nettement plus chaudes que les données expérimentales à température ambiante et la non-uniformité de la structure interne de la cellule[2]. Certains effets observés n'entrent pas dans certains de ces modèles. Par exemple, le cycle de température (avec une augmentation minimale de la température nette) de la membrane cellulaire pendant la propagation du potentiel d'action n'est pas compatible avec les modèles qui reposent sur la modélisation de la membrane comme une résistance qui doit dissiper de l'énergie lorsque le courant la traverse. L'épaississement transitoire de la membrane cellulaire au cours de la propagation du potentiel d'action n'est pas non plus prédit par ces modèles, ni le changement de capacité et de pic de tension qui résulte de cet épaississement incorporé dans ces modèles. L'action de certains anesthésiques tels que les gaz inertes est également problématique pour ces modèles. De nouveaux modèles, tels que le modèle soliton tentent d'expliquer ces phénomènes, mais sont moins développés que les modèles plus anciens et doivent encore être largement appliqués. Des conjectures récentes suggèrent que chaque neurone pourrait fonctionner comme une collection d'unités de seuil indépendantes. Il est suggéré qu'un neurone pourrait être activé de manière anisotrope suite à l'origine de ses signaux arrivant à la membrane, via ses arbres dendritiques. Il a également été proposé que la forme d'onde d'impulsion dépende de l'origine du stimulus. [3]
Modèles de tension membranaire entrée-sortie électrique déterministes
Les modèles de cette catégorie décrivent la relation entre les courants membranaires neuronaux à l'étage d'entrée et la tension membranaire à l'étage de sortie. Cette catégorie comprend des modèles intégration-et-tir et des modèles biophysiques inspirés des travaux de Hodgkin-Huxley réalisé au début des années 1950 et lors desquels une membrane cellulaire était perforé pour permettre de créer une tension/un courant membranaire spécifique[4],[5],[6],[7].
La plupart des interfaces neuronales électriques modernes utilisent une stimulation électrique extracellulaire pour éviter la perforation de la membrane cellulaire qui peut entraîner la mort de la cellule et des lésions tissulaires. Les modèles décrivant les stimulation normale des neurones (c'est-à-dire intracellulaire), il n'est pas clair si les modèles de neurones électriques tiennent toujours pour la stimulation extracellulaire (voir par exemple [8] ).
Hodgkin–Huxley
| Propriété du modèle H&H | Les références |
|---|---|
| La forme d'une impulsion individuelle | [4],[5],[6],[7] |
| L'identité des ions impliqués | [4],[5],[6],[7] |
| Vitesse de pointe à travers l'axone | [4] |
Le modèle Hodgkin-Huxley (modèle H&H) [4],[5],[6],[7] est un modèle donnant la relation entre le courants ioniques traversant la membrane cellulaire et la tension de la membrane cellulaire[4],[5],[6],[7]. Il consiste en un ensemble d'équations différentielles non linéaires décrivant le comportement des canaux ioniques qui parcourent la membrane cellulaire de l'axone géant du calmar. Hodgkin et Huxley reçurent en 1963 le prix Nobel de physiologie ou médecine pour ce travail.
Dans ce modèle un neurone est représenté par la relation entre sa tension membranaire et plusieurs courants (dépendant de la tension) chargeant la membrane cellulaire de capacité Cm
L'équation ci-dessus correspond à la dérivée temporelle de la loi de comportement du condensateur Q = CV, où le changement de la charge totale correspond à la somme des courants. Chaque courant est donné par
où g(t,V) est la conductance ou la résistance inverse. On peut développer en un produit de la conductance maximale ḡ et des fractions d'activation et d' inactivation m et h, qui déterminent la quantité d'ions pouvant circuler à travers les canaux de membrane disponible. Cette expansion est donnée par
et les fractions suivent la cinétique du premier ordre
avec une dynamique similaire pour h, où soit τ et m∞ soit α et β peuvent être utilisés pour définir les fractions de porte ouverte.
Le modèle Hodgkin-Huxley peut être étendu pour inclure des courants ioniques supplémentaires. Typiquement, ceux-ci incluent les courants d'entrée Ca2+ et Na+ entrants, ainsi que plusieurs variétés de courants sortant K+ y compris un courant de « fuite ».
Le résultat final peut comporter 20 paramètres que l'on doit estimer ou mesurer pour avoir un modèle précis. Dans un modèle d'un système complexe de neurones, l'intégration numérique des équations est coûteuse en temps de calcul. Cela conduit à chercher des simplifications du modèle Hodgkin-Huxley.
Izhikevich
Le modèle d'Izhikevich est un modèle essayant de combiner la plausibilité biologique du modèle de Hodgkin-Huxley et l'efficacité algorithmique des modèle de type intégration-et-tir en simplifiant les equation du modèle de Hodgkin-Huxley à l'aide de la théorie des bifurcations[9].
Le potentiel de membrane est décrit par les équations :
avec :
avec la remise à zéro auxiliaire après le pic :
si , alors
, , et sont des paramètres du modèle qui permettent d'obtenir différentes dynamiques.
Théorie du câble linéaire
Tous les modèles déterministes ci-dessus sont des modèles de neurone ponctuel, c'est-à-dire qu'ils ne prennent pas en compte la structure spatiale d'un neurone. Cependant, la dendrite contribue à transformer l'entrée en sortie[10],[11]. Les modèles de neurones ponctuels sont une description valide dans trois cas. (i) Si le courant d'entrée est directement injecté dans le soma. (ii) Si l'entrée synaptique arrive principalement au niveau ou à proximité du soma (la proximité est définie par une échelle de longueur présentée ci-dessous. (iii) Si la synapse arrive n'importe où sur la dendrite, mais la dendrite est complètement linéaire. Dans le dernier cas, le câble agit comme un filtre linéaire ; ces propriétés de filtre linéaire peuvent être incluses dans la formulation de modèles d'intégration-et-tir généralisés tels que le modèle de réponse d'impulsion .
Les propriétés du filtre peuvent être calculées à partir d'une équation de Fourrier.
Considérons une membrane cellulaire sous la forme d'un câble cylindrique. La position sur le câble est indiquée par x et la tension à travers la membrane cellulaire par V. Le câble est caractérisé par une résistance longitudinale et une résistance longitudinale de membrane . Si tout est linéaire, la tension change en fonction du temps
-
(19)
Nous introduisons une échelle de longueur à gauche et constante de temps sur le côté droit. L'équation de la chaleur peut maintenant être écrite sous sa forme peut-être la plus connue :
-
(20)
L'équation de la chaleur ci-dessus est valable pour un seul câble cylindrique.
La théorie du câble linéaire décrit l'arbre dendritique d'un neurone comme une structure cylindrique subissant un schéma régulier de bifurcation, comme les branches d'un arbre. Pour un seul cylindre ou un arbre entier, la conductance d'entrée statique à la base (où l'arbre rencontre le corps de la cellule, ou toute autre limite) est définie comme
- ,
où L est la longueur électrotonique du cylindre qui dépend de sa longueur, de son diamètre et de sa résistance. Un algorithme récursif simple évolue linéairement avec le nombre de branches et peut être utilisé pour calculer la conductance effective de l'arbre. Ceci est donné par
où AD = πld est la surface totale de l'arbre de longueur totale l, et LD est sa longueur électrotonique totale. Pour un neurone entier dans lequel la conductance du corps cellulaire est GS et la conductance membranaire par unité de surface est Gmd = Gm / A, nous trouvons la conductance neuronale totale GN pour n arbres dendrites en additionnant toutes les conductances arborescentes et soma, donné par
où l'on peut trouver expérimentalement le Fdga GD = GmdADFdga .
Modèles compartimentaux
Le modèle de câble linéaire fait un certain nombre de simplifications pour donner des résultats analytiques fermés, à savoir que l'arbre dendritique doit se ramifier en paires décroissantes dans un motif fixe et que les dendrites sont linéaires. Un modèle compartimenté [11] permet toute topologie arborescente souhaitée avec des branches et des longueurs arbitraires, ainsi que des non-linéarités arbitraires. Il s'agit essentiellement d'une implémentation informatique discrétisée de dendrites non linéaires.
Chaque pièce individuelle, ou compartiment, d'une dendrite est modélisée par un cylindre droit de longueur arbitraire l et de diamètre d qui se connecte avec une résistance fixe à un nombre quelconque de cylindres de branchement. Nous définissons le rapport de conductance du i ème cylindre comme Bi = Gi / G∞, où et Ri est la résistance entre le compartiment courant et le suivant. Nous obtenons une série d'équations pour les rapports de conductance dans et hors d'un compartiment en apportant des corrections à la dynamique normale Bout,i = Bin,i+1, comme
où la dernière équation concerne les parents et les filles dans les branches, et . Nous pouvons itérer ces équations à travers l'arbre jusqu'à ce qu'à obtenir le point où les dendrites se connectent au corps cellulaire (soma), à cet endroit le rapport de conductance est alors Bin,stem . Ensuite, notre conductance neuronale totale pour l'entrée statique est donnée par
Cependant l'entrée statique est un cas très particulier. En biologie, les intrants dépendent du temps. De plus, les dendrites ne sont pas toujours linéaires.
Intégration-et-tir parfait
L'un des premiers modèles de neurone inventé fut le modèle parfait d'Intégration-et-tir ou intégration-et-déclenchement (de l'anglais integrate-and-fire), également appelé Intégration-et-tir sans fuite. Il fut étudié pour la première fois en 1907 par Louis Lapicque[12],[13]. Dans ce modèle un neurone est représenté par sa tension membranaire V qui évolue dans le temps lors de la stimulation avec un courant d'entrée I(t) selon
Cette équation est la dérivée temporelle de la loi de capacité, Q = CV . Lorsqu'un courant d'entrée est appliqué, la tension de membrane augmente avec le temps jusqu'à ce qu'elle atteigne un seuil constant Vth. Lorsque est atteint, une fonction delta pic est émise et la tension est remise à son potentiel de repos, après quoi le modèle continue de fonctionner. Ainsi, à mesure que le courant d'entrée augmente la fréquence de tir du modèle augmente aussi et cela linéairement sans limite.
Le modèle peut être rendu plus précis en introduisant une période réfractaire tref lors de laquelle le neurone ne peut pas décharger. Pour une entrée constante I(t)=I la tension de seuil est atteinte pour un temps d'intégration tint=CVthr/I après la réinitialisation. Après une réinitialisation, la période réfractaire introduit un temps mort où rien ne se passe, de sorte que le temps total jusqu'à la prochaine impulsion devient tref+tint .
On peut alors définir la fréquence de tir comme l'inverse de l'intervalle total entre les impulsions (y compris le temps mort). La fréquence de tir s'écrit alors
Un inconvénient de ce modèle est qu'il ne décrit ni l'adaptation neuronale, ni la fuite (la diffusion des ions à travers la membrane). Ainsi si on prend le cas de la fuite, si le modèle reçoit une courte impulsion de courant inférieure au seuil à un moment donné, il conservera cette augmentation de tension pour toujours - jusqu'à ce qu'une autre entrée le déclenche plus tard. Cette caractéristique n'est clairement pas en accord avec le comportement neuronal observé. Les extensions suivantes rendent le modèle d'intégration-et-tir plus plausible d'un point de vue biologique.
Intégration-et-tir avec fuite
Le modèle d'intégration-et-tir avec fuite (de l'anglais leaky integrate-and-fire) qui remonte à Louis Lapicque[13], rajoute au modèle d'intégration-et-tir parfait un terme de « fuite » dans l'équation du potentiel membranaire, reflétant la diffusion des ions à travers la membrane. L'équation du modèle est [1]
.jpg.webp)
où Vm est la tension aux bornes de la membrane cellulaire et Rm est la résistance membranaire. (On retrouve le modèle d'intégration-et-tir sans fuite quand Rm tend à l'infini, c'est-à-dire si la membrane est un isolant parfait). L'équation du modèle est valide jusqu'à ce qu'un seuil Vth soit atteint; par la suite, le potentiel de membrane est réinitialisé et l'équation est à nouveau valide.
Pour une entrée constante, l'intensité minimale pour atteindre le seuil est Ith = Vth / Rm . En supposant une réinitialisation, la fréquence de tir a la forme
et converge pour des courants d'entrée grand vers le modèle sans fuite avec période réfractaire vue précédemment[2]. Ce modèle peut également être utilisé pour les neurones inhibiteurs. [14],[15]
Le modèle de neurone d'intégration-et-tir avec fuite prend en compte les fuites du neurone mais ne tient toujours pas compte de l'adaptation neuronale, de sorte qu'il ne peut pas décrire un train d'impulsions mesuré expérimentalement en réponse à un courant d'entrée constant[16]. Cet inconvénient est supprimé dans les modèles d'intégration-et-tir généralisés qui contiennent également une ou plusieurs variables d'adaptation et sont capables de prédire les temps des potentiels d'actions des neurones corticaux sous injection de courant avec un degré de précision élevé[17],[18],[19].
Intégration-et-tir adaptatifs
| Modèle de modèle adaptatif d'intégration-et-tir | Les références |
|---|---|
| Tension inférieure au seuil pour le courant d'entrée dépendant du temps | [18],[19] |
| Temps d'allumage pour le courant d'entrée dépendant du temps | [18],[19] |
| Modèles de tir en réponse à l'entrée de courant de pas | [20],[21],[22] |
L'adaptation neuronale au phénomène d'augmentation des intervalles entre les pics de sortie en réponse à une injection de courant constant dans le soma. Pour prendre en compte ce phénomène un modèle intégration-et-tir adaptatif combine l'intégration-et-tir avec fuite avec une ou plusieurs variables d'adaptation wk (voir le chapitre 6.1. dans le manuel Neuronal Dynamics [23] )
où est le temps de la membrane est constant , wk le nombre de courant d'adaptation d'index k, la constante de temps du courant d'adaptation , le potentiel de repos et le temps de tir du neurone et désigne la fonction delta du Dirac. Lorsque la tension atteint le seuil de déclenchement, la tension redémarre à une valeur en dessous du seuil de déclenchement. La valeur de réinitialisation est l'un des paramètres importants du modèle. Le modèle le plus simple d'adaptation n'a qu'une seule variable d'adaptation w et la somme sur est retirée[24].

En plus de l'adaptation, les neurones d'intégration-et-tir avec une ou plusieurs variables d'adaptation peuvent expliquer une variété de modèles de potentiel d'action en réponse à une stimulation constante comme l'éclatement et l'éclatement initial[20],[21],[22]. De plus, les neurones adaptatifs d'intégration-et-tir avec plusieurs variables d'adaptation sont capables de prédire les temps de pics des neurones corticaux sous injection d'un courant dans le soma[18],[19].
Intégration-et-tir avec fuite d'ordre fractionnaire
Les progrès récents en analyse fractionnaire, tant sur le plan calculatoire que théorique, ont conduit à une nouvelle forme de modèle, appelée intégration-et-tir à fuite d'ordre fractionnaire[25],[26]. Un avantage de ce modèle est qu'il peut capturer les effets d'adaptation avec une seule variable. Le modèle a la forme suivante [26]
Comme dans les précédents modèles V est réinitialisée quand elle atteint le seuil Vth de déclenchement.
L'intégration fractionnelle a été utilisée pour tenir compte de l'adaptation neuronale dans les données expérimentales. [25]
« Intégration-et-tir exponentiel » et « intégration-et-tir exponentiel adaptatif »
| Intégrer et tirer exponentiel adaptatif | Les références |
|---|---|
| La relation courant-tension sous-seuil | [27] |
| Modèles de tir en réponse à l'entrée de courant de pas | [22] |
| Réfractarité et adaptation | [28] |
Dans le modèle exponentiel d'intégration-et-tir [29] la génération d'impulsions est exponentielle et suit l'équation :
où est le potentiel membranaire, le seuil de déclenchement, la constante de temps membranaire, le potentiel de repos, et la netteté de l'initiation du potentiel d'action (généralement autour de 1 mV pour les neurones pyramidaux corticaux)[27]. Une fois que le potentiel membranaire franchi , il diverge à l'infini en temps fini[30]. lors d'une simulation numérique, on arrête l'intégration quand le potentiel de membrane atteint un seuil arbitraire (choisis beaucoup plus grand que ) correspondant à l'amplitude du potentiel d'action. On remet ensuite le potentiel de membrane à une valeur Vr. La valeur de réinitialisation Vr est l'un des paramètres importants du modèle. On note que l'équation contient une non-linéarité qui peut être directement déterminé par les données expérimentales.[27] En ce sens, la non-linéarité exponentielle est fortement étayée par l'expérience.
Dans le modèle de neurone intégration-et-tir exponentiel adaptatif [28] la non-linéarité exponentielle de l'équation de tension est combinée avec une variable d'adaptation , ce qui donne le système d'équation suivant

où w désigne le courant d'adaptation de constante de temps . Les paramètres importants du modèle sont la valeur de réinitialisation de la tension Vr, le seuil intrinsèque , les constantes de temps et ainsi que les paramètres de couplage a et b . Le modèle d'intégration-et-tir exponentiel adaptatif hérite de la non-linéarité de tension[27] du modèle d'intégration-et-tir exponentiel (dérivée expérimentalement) et modélise également le phénomène l'adaptation. Mais rend aussi compte d'une variété de phénomènes de décharge neuronale en réponse à une stimulation constante comme l'éclatement et l'éclatement initial[22]. Cependant, l'adaptation étant sous forme de courant, une hyperpolarisation aberrante peut apparaître. Toutefois ce problème est résolu en l'exprimant comme une conductance[31].
Modèles didactiques
Les modèles de cette catégorie sont des modèles didactiques très simplifiés qui décrivent qualitativement la tension de la membrane en fonction de l'entrée. Ils sont principalement utilisés dans l'enseignement, mais ne sont pas considérés comme des modèles de neurones valides pour les simulations à grande échelle ou l'ajustement des données.
FitzHugh–Nagumo
Des simplifications radicales du modèle de Hodgkin-Huxley ont été introduites par FitzHugh et Nagumo en 1961 et 1962. Cherchant à décrire « l'auto-excitation régénérative » par une tension de membrane à rétroaction positive non linéaire et la récupération par une tension de grille à rétroaction négative linéaire, ils ont développé le modèle décrit par [32]
où nous avons à nouveau une membrane en forme de tension et de courant d'entrée avec une tension de grille plus lente générale w et les paramètres déterminés expérimentalement a = -0.7, b = 0.8, τ = 1/0.08 Bien qu'il ne soit pas clairement dérivé de la biologie, le modèle permet une dynamique simplifiée, immédiatement disponible, sans être une simplification triviale[33]. Le support expérimental est faible, mais le modèle est utile en tant qu'outil didactique pour introduire la dynamique de génération d'impulsions à travers l'analyse du plan de phase. Voir le chapitre 7 dans le manuel Methods of Neuronal Modeling [11].
Morris–Lecar
En 1981, Morris et Lecar ont combiné les modèles Hodgkin-Huxley et FitzHugh-Nagumo en un modèle de canal calcique voltage-dépendant avec un canal potassique à redresseur retardé, représenté par
où [2] . Le support expérimental du modèle est faible, mais le modèle est utile en tant qu'outil didactique pour introduire la dynamique de génération d'impulsions par l'analyse du plan de phase. Voir le chapitre 7 [34] dans le manuel Methods of Neuronal Modeling[11].
où [2] . Le support expérimental du modèle est faible, mais le modèle est utile en tant qu'outil didactique pour introduire la dynamique de génération d'impulsions par l'analyse du plan de phase. Voir le chapitre 7 [34] dans le manuel Methods of Neuronal Modeling[11].
Un modèle de neurone bidimensionnel très similaire au modèle Morris-Lecar peut être dérivé étape par étape à partir du modèle Hodgkin-Huxley. Voir le chapitre 4.2 dans le manuel Neuronal Dynamics[23].
Hindmarsh–Rose
En s'appuyant sur le modèle de FitzHugh-Nagumo, Hindmarsh et Rose ont proposé en 1984 [35] un modèle d'activité neuronale décrit par trois équations différentielles du premier ordre couplées :
avec r2 = x2 + y2 + z2, et r ≈ 10−2 pour que la z variable ne change que très lentement. Cette complexité mathématique supplémentaire permet une grande variété de comportements dynamiques pour le potentiel membranaire, décrits par la variable x du modèle, qui inclut la dynamique chaotique. Cela rend le modèle du neurone Hindmarsh–Rose très utile, car étant encore simple, il permet une bonne description qualitative des nombreux modèles de tir différents du potentiel d'action, en particulier l'éclatement, observés dans les expériences. Néanmoins, il reste un modèle didactique et n'a pas été adapté aux données expérimentales. Il est largement utilisé comme modèle de référence pour la dynamique d'éclatement[35].
Modèle thêta et intégration-et-tir quadratiques.
Le modèle thêta, ou modèle canonique de type I d'Ermentrout-Kopell, est mathématiquement équivalent au modèle quadratique d'intégration-et-tir qui à son tour est une approximation du modèle exponentiel d'intégration-et-tir et du modèle Hodgkin-Huxley. On l'appelle un modèle canonique car c'est l'un des modèles génériques pour une entrée constante proche du point de bifurcation, c'est-à-dire proche de la transition du tir silencieux au tir répétitif. [36],[37]
La formulation standard du modèle thêta est[23],[36],[37]
L'équation du modèle quadratique d'intégration-et-tir est (voir le chapitre 5.3 du manuel Neuronal Dynamics [23] ))
Un équivalence du modèle thêta et de l'intégration-et-tir quadratiques est par exemple examinée au chapitre 4.1.2.2 des modèles de neurones à impulsions. [1]
Pour une entrée I(t) dépendante du temps ou éloignée du point de bifurcation, il est préférable de travailler avec le modèle exponentiel d'intégration-et-tir (si l'on veut rester dans la classe des modèles de neurones unidimensionnels), parce que les vrais neurones présentent la non-linéarité du modèle exponentiel d'intégration-et-tir[27].
Modèles stochastiques de tension membranaire et de synchronisation d'impulsions
Les modèles de cette catégorie sont tous du type d'intégration-et-tir généralisés qui incluent des processus stochastiques. Expérimentalement les neurones corticaux répondent de manière fiable à une entrée dépendante du temps, bien qu'avec un faible degré de variation entre des stimuli consécutifs sur le même neurone[38],[39]. La stochasticité dans les neurones a deux sources importantes. Premièrement des canaux ioniques s'ouvrant et se fermant de manière stochastique [40], et entrainant une petite variabilité de la valeur exacte du potentiel membranaire et donc de la synchronisation exacte des impulsions de sortie. Deuxièmement, du bruit du réseau dans lequel le neurone cortical est situé, il est difficile de contrôler l'entrée exacte car la plupart des entrées proviennent de neurones non observés situés ailleurs dans le cerveau[23].
L'effet stochastique a été introduit dans les modèles de neurones à impulsions sous deux formes fondamentalement différentes : soit (i) un bruit au niveau du courant d'entrée est ajouté à l'équation différentielle du modèle de neurone[41] ; ou (ii) le processus de génération d'impulsion est bruyant. [42] Dans les deux cas, la théorie mathématique peut être développée pour le temps continu, et peut ensuite être utilisée dans des simulations informatiques, transformée en un modèle à temps discret.
Modèle d'entrée avec bruit (bruit diffusif)
Un neurone intégré dans un réseau reçoit des potentiels d'actions d'autres neurones. Les temps d'arrivées des pics n'étant pas contrôlés par un expérimentateur, ils peuvent être considérés comme stochastiques. Ainsi, un modèle d'intégration-et-tir (potentiellement non linéaire) avec une non-linéarité f(v) reçoit deux entrées : une entrée contrôlée par les expérimentateurs et un courant d'entrée bruyant qui décrit les bruit du réseau non contrôlable.
Le modèle de Stein [41] est le cas particulier d'un neurone d'intégration-et-tir avec fuite et d'un courant de bruit blanc stationnaire avec une moyenne nulle et une variance unitaire. Dans le régime sous le seuil de déclenchement, ces hypothèses donnent l'équation du processus Ornstein-Uhlenbeck
Cependant, contrairement au procédé classique Ornstein-Uhlenbeck, la tension de membrane est remise à zéro à chaque fois que atteint le seuil de déclenchement Vth [41] Pour une entrée constante avec un seuil de déclenchement le calcul de la distribution des intervalles de temps du modèle Ornstein-Uhlenbeck conduit à un problème de temps de premier passage[41],[43]. Le modèle de neurone de Stein et ses variantes ont été utilisés pour décrire des distributions d'intervalles de temps entre pics dans le cas où les trains de pics étaient générés par de vrais neurones soumis à un courant d'entrée constant[43].
Dans la littérature mathématique, l'équation du processus Ornstein-Uhlenbeck s'écrit sous la forme
où est l'amplitude du bruit d'entrée et correspond aux incréments d'un processus de Wiener. Pour les implémentations à temps discret avec pas de temps, la valeur de la tension est mise à jour de la manière suivante[23] :
où est tiré d'une distribution gaussienne de variance unitaire et de moyenne nulle. La tension est remise à zéro quand le seuil de déclenchement Vth est atteint.
Le modèle d'entrée bruyant peut également être utilisé dans des modèles d'intégration-et-tir généralisés. Par exemple, le modèle exponentiel d'intégration-et-tir avec des lectures d'entrée bruyantes
Pour une entrée déterministe constante il est possible de calculer la cadence de tir moyenne en fonction de [44] . Ceci est important car la relation fréquence-courant est souvent utilisée pour caractériser un neurone.
L'intégration-et-tir à fuite avec entrée bruitée a été largement utilisée dans l'analyse des réseaux de neurones à impulsions[45]. Le bruit d'entrée est également appelée «bruit diffusif» car il conduit à une diffusion du potentiel membranaire sous le seuil autour de la trajectoire sans bruit (Johannesma [46] )
Modèle de sortie bruyant (bruit d'échappement)
Dans les modèles déterministes d'intégration-et-tir, un potentiel d'action est généré si le potentiel membranaire V(t) atteint le seuil de déclenchement. Dans les modèles de sortie bruyants, le seuil strict est remplacé par un seuil bruyant. À chaque instant , un pic est généré de manière stochastique avec une intensité ou « taux d'échappement » [23]
où V(t) est la tension membranaire et le seuil[42]. Un choix commun pour le « taux d'échappement » (qui est cohérent avec les données biologiques [18] ) est
Pour les modèles en temps discret, un potentiel d'action est généré avec probabilité
et dépend donc de la différence entre la tension membranaire V au temps et le seuil [47]. Pour la fonction F on choisi souvent la fonction sigmoïde avec le paramètre de pente[42]. Cette fonction est aussi utilisée dans les réseaux de neurones artificiels comme fonction d'activation. F peut aussi être dérivée, en temps continu, du taux d'échappement introduit ci-dessus de la manière où est la distance au seuil de déclenchement[42].
Les modèles d'intégration-et-tir avec bruit de sortie peuvent être utilisés pour prédire l'histogramme séquentiel péristimulus de vrais neurones en réponse à une entrée arbitraire en fonction du temps. [18] Pour les neurones d'intégration-et-tir non adaptatifs, la distribution d'intervalle de temps en réponse à une stimulation constante peut être calculée à partir de la théorie du renouvellement stationnaire[23].
Modèle de réponse aux pics (SRM)
| Modèle de réponse aux pics | Les références |
|---|---|
| Tension inférieure au seuil pour le courant d'entrée dépendant du temps | [19],[18] |
| Temps d'allumage pour le courant d'entrée dépendant du temps | [19],[18] |
| Modèles de tir en réponse à l'entrée de courant de pas | [48],[49] |
| Distribution des intervalles entre les impulsions | [48],[42] |
| Potentiel postérieur au pic | [19] |
| réfractaire et seuil de déclenchement dynamique | [19],[18] |
Le modèle de réponse d'impulsions (SRM de l'anglais Spike Response Model) est composé d'un modèle linéaire général pour la tension de membrane et d'un processus de bruit de sortie non linéaire pour générer les impulsions. [42],[50],[48] La tension membranaire V(t) à l'instant t est donné par
.jpg.webp)
où tf est le temps de déclenchement du f-ième pic du neurone, Vrest la tension de repos en l'absence d'entrée, I(t-s) le courant d'entrée au temps ts et est un filtre linéaire (également appelé noyau) qui décrit la contribution d'une impulsion de courant d'entrée à l'instant ts à la tension à l'instant t. Les contributions à la tension causées par un pic au moment sont décrits par le noyau réfractaire . En particulier, décrit la réinitialisation après le pic et l'évolution dans le temps du potentiel post-pic suivant un pic. Elle exprime donc les conséquences de la réfractarité et de l'adaptation[42],[19]. La tension V(t) peut être interprétée comme le résultat d'une intégration de l'équation différentielle d'un modèle d'intégration-et-tir à fuite couplée à un nombre arbitraire de variables d'adaptation déclenchées par des impulsions. [20]
Le déclenchement d'impulsion est stochastique et se produit avec une intensité stochastique dépendante du temps (taux instantané)
avec un seuil dynamique donné par
Ici est le seuil de déclenchement d'un neurone inactif et décrit l'augmentation du seuil après un pic au temps [18],[19] . En cas de seuil fixe, on fixe =0. Pour le processus de seuil est déterministe. [23]
Les évolutions temporelles des filtres (qui modélise la réponse aux pics) peuvent être directement extraits des données expérimentales. [19] Avec des paramètres optimisés, le SRM décrit l'évolution dans le temps de la tension membranaire inférieure au seuil pour une entrée dépendante du temps avec une précision de 2 mV et peut prédire la synchronisation de la plupart des pics de sortie avec une précision de 4 ms. [18],[19] Le SRM est étroitement lié aux modèles linéaires-non linéaires en cascade de Poisson (également appelés modèle linéaire généralisé)[54].
.jpg.webp)
Le modèle de réponse d'impulsion est nommé ainsi parce que dans un réseau, le courant d'entrée pour le neurone i est généré par les impulsions d'autres neurones. Aussi dans le cas d'un réseau, l'équation de tension devient
où chaque correspond temps de déclenchement du neurone j (c'est-à-dire son train de pics), et décrit l'évolution dans le temps de l'impulsion et le post-potentiel du pic pour le neurone i, et décrivent l'amplitude et l'évolution dans le temps d'un potentiel postsynaptique excitateur ou inhibiteur causé par le pic du neurone présynaptique j. L'évolution temporelle du potentiel postsynaptique résulte de la convolution du courant postsynaptique causée par l'arrivée d'un pic présynaptique du neurone j avec le filtre à membrane [23] .
SRM0
Le SRM 0 [48],[55],[56] est un modèle de neurone stochastique lié à la théorie du renouvellement non linéaire dépendant du temps et à une simplification du Spike Renose Model (SRM). La principale différence avec l'équation de tension du SRM introduite ci-dessus est que dans le terme contenant le noyau réfractaire il n'y a pas de signe de sommation sur les pics passés : seul le pic le plus récent (indiqué par l'heure ) questions. Une autre différence est que le seuil est constant. Le modèle SRM0 peut être formulé en temps discret ou continu. Par exemple, en temps continu, l'équation à un seul neurone est
et les équations de réseau du SRM0 sont [48]
où est le dernier temps de décharge du neurone i. Notez que l'évolution temporelle du potentiel postsynaptique est également autorisé à dépendre du temps écoulé depuis le dernier pic du neurone i afin de décrire un changement de conductance membranaire au cours de la réfractarité[55]. La cadence de tir instantanée (intensité stochastique) est
où est un seuil de déclenchement fixe. Ainsi, le déclenchement du pic du neurone i ne dépend que de son entrée et du temps écoulé depuis que le neurone i a déclenché son dernier pic.
Avec le SRM0, la distribution d'intervalle entre les impulsions pour une entrée constante peut être mathématiquement liée à la forme du noyau réfractaire [42],[48] . De plus, la relation stationnaire fréquence-courant peut être calculée à partir du taux d'échappement en combinaison avec le noyau réfractaire [42],[48] . Avec un choix approprié des noyaux, le SRM0 se rapproche de la dynamique du modèle Hodgkin-Huxley avec un haut degré de précision[55]. De plus, l'histogramme séquentiel péristimulus à une entrée arbitraire dépendante du temps peut être prédite[48].
Modèle de Galves–Löcherbach
Le modèle de Galves-Löcherbach [57] est un modèle de neurone stochastique étroitement lié au modèle de réponse d'impulsion SRM0 [56],[48] et au modèle d'intégration-et-tir avec fuite. Il est intrinsèquement stochastique et, tout comme le SRM 0, lié à la théorie du renouvellement non linéaire dépendant du temps. Compte tenu des spécifications du modèle, la probabilité qu'un neurone donné déclenche une impulsion dans une période de temps peut être décrit par
où est un poids synaptique, décrivant l' influence du neurone sur le neurone , exprime la fuite, et fournit l'histoire des potentiels d'actions du neurone avant , selon
Il est important de noter que la probabilité de déclenchement du potentiel d'action du neurone ne dépend que de son entrée d'impulsions (filtrée avec un noyau pondéré par un facteur ) et du moment de son pic de sortie le plus récent (résumé par ).
Modèles de neurones pour les stimuli sensoriels ou pharmacologique
Les modèles de cette catégorie furent créés à la suite d'expériences impliquant une stimulation naturelle telle que la lumière, le son, le toucher ou l'odeur. Dans ces expériences, le motif d'impulsion en réponse à un même stimulus varie d'un essai à l'autre, mais la réponse moyenne de plusieurs essais converge souvent vers un motif clair. Les modèles de cette catégorie s'intéressent à établir une relation probabiliste entre le stimulus d'entrée et les occurrences des pics. Il est important de noter que les neurones enregistrés expérimentalement sont souvent situés plusieurs étapes de traitement après les neurones sensoriels. Ainsi les modèles résument les effets de la séquence d'étapes de traitement (par plusieurs neurones) et non pas le traitement direct d'un neurone.
Le modèle du processus de Poisson non homogène (Siebert)
Pour expliquer les résultats d'expériences sur le système auditif, Siebert [58],[59] modélisa les décharges des impulsions neuronales à l'aide d'un modèle de processus de Poisson non homogène[58],[59]. Dans ce modèle la probabilité d'un déclenchement d'impulsion dans l'intervalle de temps est proportionnel à une fonction définie sur , où est le stimulus brut.
Dans ces modèles plusieurs fonctions sont envisagées pour , comme par exemple pour les faibles intensités de stimulation.
La simplicité du modèle de Siebert est son principal avantage mais le modèle est incapable à refléter correctement les phénomènes suivants :
- L'amélioration transitoire de l'activité de décharge neuronale en réponse à un stimulus progressif.
- La saturation de la cadence de tir.
- Les valeurs des histogrammes d'intervalle inter-impulsions aux valeurs d'intervalles courts (proche de zéro).
Ces lacunes sont corrigées par le modèle de processus ponctuel dépendant de l'âge développé dans la partie suivante et le modèle de Markov à deux états développé plus loin[60],[61],[62].
Modèle de processus ponctuel en fonction de l'âge et de la réfractarité
Pour étudier la réfractarité neuronale, Berry et Meister [63] utilisèrent un modèle stochastique donnant une probabilité de déclenchement d'impulsion comme produit de deux termes : une fonction qui dépend du stimulus dépendant du temps ; et une fonction de récupération qui dépend du temps écoulé depuis le dernier pic
Ce modèle est également appelé processus d'intervalle de Markov inhomogène (IMI)[64]. Depuis de nombreuses années des modèles similaires sont utilisés en neurosciences auditives. [65],[66],[67] Le modèle conservant la mémoire du dernier pic, il n'est pas un processus de Poisson et appartient à la classe des modèles de renouvellement dépendant du temps.[23] Il est également étroitement lié au modèle SRM0 à taux d'échappement exponentiel[23]. Il est important de noter qu'on peut ajuster les paramètres du modèle de processus ponctuel dépendant de l'âge afin de décrire non seulement l'histogramme séquentiel péristimulus, mais également les statistiques d'intervalle entre les impulsions. [64],[65],[67]
Modèle en cascade de Poisson linéaire-non linéaire et MLG
Le modèle en cascade linéaire-non linéaire-Poisson est une cascade de trois étapes. La première étape consiste en un filtre linéaire, ou champ récepteur linéaire, qui décrit comment le neurone intègre l'intensité du stimulus dans l'espace et le temps. La sortie de ce filtre passe ensuite par une fonction non linéaire, qui donne en sortie le taux d'impulsions instantané du neurone. Enfin, le taux d'impulsions est utilisé pour générer des impulsions selon un processus de Poisson inhomogène[68]. Dans le cas d'un feedback des pics de sortie, via un processus de filtrage linéaire, nous arrivons à un modèle connu en neurosciences sous le nom de modèle linéaire généralisé (MLG)[54],[69]. Le MLG est mathématiquement équivalent au modèle de réponse d'impulsion (SRM) avec bruit d'échappement ; mais alors que dans le SRM, les variables internes sont interprétées comme le potentiel de membrane et le seuil de déclenchement, dans le MLG, les variables internes sont des quantités abstraites qui résument l'effet net de l'entrée (et des pics de sortie récents) avant que les pics ne soient générés à l'étape finale[23],[54].
Le modèle de Markov à deux états (Nossenson & Messer)
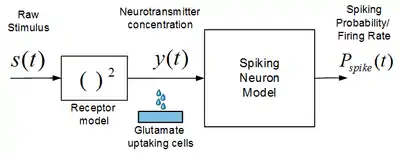
Nossenson & Messer [60],[61],[62] eurent l'idée d'un modèle de neurone à impulsions donne la probabilité qu'un neurone déclenche une impulsion en réponse à un stimulus externe ou pharmacologique[60],[61],[62]. Le modèle se compose, comme le montre la figure 4, d'une couche de récepteur et d'un neurone à impulsion en cascade. Le lien entre le stimulus externe et la probabilité de déclenchement d'un pic se fait en deux étapes : d'abord, un modèle de cellule réceptrice traduit le stimulus externe brut en une concentration de neurotransmetteur, puis, un modèle de neurone à impulsions relie entre eux la concentration de neurotransmetteur et le taux de décharge (probabilité de déclenchement d'un potentiel d'action). Le modèle de neurone à impulsions dépend donc en lui-même de la concentration de neurotransmetteurs à l'étape d'entrée[60],[61],[62].
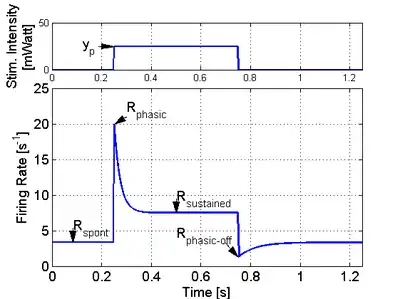
Une caractéristique importante de ce modèle est la prédiction du taux de décharge des neurones qui capture, en utilisant un faible nombre de paramètres libres, le bord accentué caractéristique de la réponse des neurones à un stimulus abrupte (comme le montre la figure 5). Le taux d'impulsions est une probabilité (normalisée) de décharge d'impulsion neuronales mais aussi une quantité, proportionnelle au courant de neurotransmetteurs libérés par la cellule. On peut écrire la cadence de tir sous la forme suivante :
où,
- P0 est la probabilité que le neurone soit "armé" et prêt à tirer. Elle est donnée par l'équation différentielle suivante :
On peut calculer P0 de manière récursive en utilisant la méthode d'Euler, mais dans le cas d'une d'un stimulus abrupte, cela donne une expression sous forme fermée simple[60].
- y ( t ) est l'entrée du modèle et est interprétée comme la concentration de neurotransmetteur sur la cellule environnante (dans la plupart des cas le glutamate). Pour un stimulus externe, il peut être estimé à l'aide du modèle de couche réceptrice :
avec une moyenne temporelle sur un temps court de la puissance de stimulation.
- R 0 correspond à la vitesse de décharge spontanée intrinsèque du neurone.
- R 1 est le taux de récupération du neurone de l'état réfractaire.
Les autres prédictions de ce modèle incluent :
- Le potentiel de réponse évoqué (ERP) moyenné en raison de la population de nombreux neurones dans des mesures non filtrées ressemble au taux de décharge[62].
- La variance de tension de l'activité due à l'activité de plusieurs neurones ressemble à la fréquence de tir (également connue sous le nom de puissance d'activité multi-unités ou MUA)[61],[62].
- La distribution de probabilité entre les intervalles de pics prend la forme d'une fonction de type distribution gamma[60],[70].
| Propriété du modèle par Nossenson & Messer | Les références |
|
|---|---|---|
| La forme de la cadence de tir en réponse à une impulsion de stimulus auditif | [71],[72],[73],[74],[75] | La cadence de tir a la même forme que la figure 5. |
| La forme de la cadence de tir en réponse à une impulsion de stimulus visuel | [76],[77],[78],[79] | La cadence de tir a la même forme que la figure 5. |
| La forme de la cadence de tir en réponse à une impulsion de stimulus olfactif | [80] | La cadence de tir a la même forme que la figure 5. |
| La forme de la cadence de tir en réponse à un stimulus somato-sensoriel | [81] | La cadence de tir a la même forme que la figure 5. |
| Le changement de taux de décharge en réponse à l'application de neurotransmetteurs (principalement du glutamate) | [82],[83] | Changement de cadence de tir en réponse à l'application de neurotransmetteurs (glutamate) |
| Dépendance carrée entre une pression de stimulus auditif et le taux de décharge | [84] | Dépendance carrée entre la pression du stimulus auditif et la cadence de tir (- Dépendance linéaire en carré de la pression (puissance)). |
| Dépendance carrée entre le champ électrique du stimulus visuel (volts) et la cadence de tir | [77] | Dépendance carrée entre le champ électrique du stimulus visuel (volts) - Dépendance linéaire entre la puissance du stimulus visuel et la cadence de tir. |
| La forme de la statistique Inter-Spike-Interval Statistics (ISI) | [85] | La forme ISI ressemble à la fonction gamma |
| L'ERP ressemble à la cadence de tir dans les mesures non filtrées | [86] | La forme du potentiel de réponse évoqué moyen en réponse au stimulus ressemble au taux de décharge (Fig. 5). |
| La puissance MUA ressemble à la cadence de tir | [62],[87] | La forme de la variance empirique des mesures extracellulaires en réponse à l'impulsion de stimulation ressemble à la cadence de tir (Fig. 5). |
Stimulus d'entrée pharmacologique
Les modèles de cette catégorie fournissent des prédictions pour des neurones répondant à une stimulation pharmacologique.
Transmission synaptique (Koch & Segev)
Selon le modèle de Koch et Segev[2], la réponse d'un neurone à des neurotransmetteurs individuels peut être modélisée comme une extension du modèle classique de Hodgkin-Huxley avec des courants cinétiques standard et non standard. Quatre neurotransmetteurs ont principalement une influence sur le SNC. Les récepteurs AMPA/kainate sont des médiateurs excitateurs rapides tandis que les récepteurs NMDA assurent la médiation de courants considérablement plus lents. Les courants inhibiteurs rapides passent par les récepteurs GABA A, tandis que les récepteurs GABA B médient par les canaux potassiques secondaires activés par la protéine G. Cette gamme de médiation produit les dynamiques actuelles suivantes :
où ḡ est le maximum [4],[2] conductance (environ 1 S ) et E le potentiel d'équilibre de l'ion donné ou du neurotransmetteur (AMPA, NMDA, Cl, ou K ), tandis que [O] représente la fraction des récepteurs ouverts. Pour la NMDA, il existe un effet significatif du bloc de magnésium qui dépend sigmoïdement de la concentration de magnésium intracellulaire, cette influence est représenté par B(V) . Pour GABA B, [G] est la concentration de la protéine G, et Kd décrit la dissociation de G lors de la liaison aux portes potassiques.
La dynamique de ce modèle, plus compliqué, a été étudiée expérimentalement et a produit des résultats importants en termes de potentialisation synaptique très rapide et de dépression, c'est-à-dire un apprentissage rapide et à court terme.
Le modèle stochastique de Nossenson et Messer traduit la concentration de neurotransmetteurs à l'étape d'entrée en probabilité de libération de neurotransmetteurs à l'étape de sortie[60],[61],[62]. Pour une description plus détaillée de ce modèle, voir la section Modèle de Markov à deux états ci-dessus.
Modèles avancés
Modèle de neurone HTM
Le modèle de neurone HTM, développé par Jeff Hawkins et des chercheurs de Numenta, est basé sur une théorie appelée Mémoire temportelle et hierarchique, initialement décrite dans le livre On Intelligence. Il est basé sur les neurosciences, la physiologie et l'interaction des neurones pyramidaux dans le néocortex du cerveau humain.
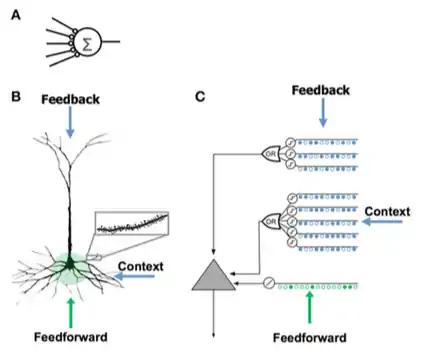
| - Peu de synapses
- Pas de dendrites - Somme entrée x poids - Apprend en modifiant les poids des synapses |
- Des milliers de synapses sur les dendrites
- Dendrites actives : la cellule reconnaît des centaines de motifs uniques - La co-activation d'un ensemble de synapses sur un segment dendritique provoque un pic NMDA et une dépolarisation au niveau du soma - Sources d'entrée à la cellule :
- Apprend en développant de nouvelles synapses |
- Inspiré des cellules pyramidales des couches néocorticales 2/3 et 5
- Des milliers de synapses - Dendrites actives : la cellule reconnaît des centaines de motifs uniques - Modéliser les dendrites et les impulsions NMDA avec chaque réseau de détecteurs coïncidents ayant un ensemble de synapses - Apprend en modélisant la croissance de nouvelles synapses |
Le régime de détection d'énergie basé sur les neurotransmetteurs
Le régime de détection d'énergie basé sur les neurotransmetteurs [62] suggère que le tissu neural exécute chimiquement une procédure de détection à la manière d'un radar.
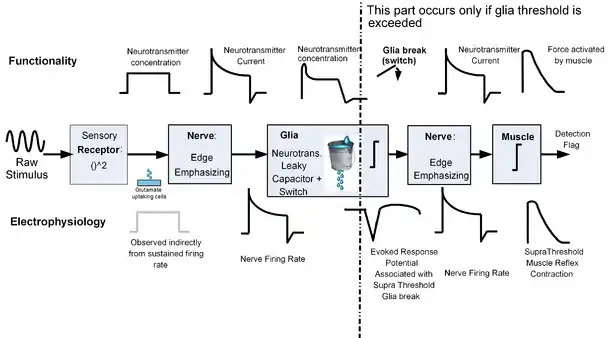
Comme le montre la figure 6, l'idée clé de la conjecture est de prendre en compte la concentration de neurotransmetteurs, la génération de neurotransmetteurs et les taux d'élimination des neurotransmetteurs comme des quantités importantes dans l'exécution de la tâche de détection, tout en se référant aux potentiels électriques mesurés comme effet secondaire qui ne coïncident que dans certaines conditions avec l'objectif fonctionnel de chaque étape. Le schéma de détection est similaire à une "détection d'énergie" de type radar car il comprend la mise au carré du signal, la sommation temporelle et un mécanisme de commutation de seuil, tout comme un détecteur d'énergie, mais il comprend également une unité qui met l'accent sur les fronts de stimulus et une longueur de mémoire variable ( mémoire variable). Selon cette conjecture, l'équivalent physiologique des statistiques de test d'énergie est la concentration en neurotransmetteurs, et le taux de décharge correspond au courant des neurotransmetteurs. L'avantage de cette interprétation est qu'elle conduit à une explication unitaire cohérente qui permet de faire le pont entre les mesures électrophysiologiques, les mesures biochimiques et les résultats psychophysiques.
Les preuves examinés dans[62] suggèrent les associations suivantes entre la fonctionnalité et la classification histologique:
- La quadrature du stimulus est susceptible d'être effectuée par les cellules réceptrices.
- L'accentuation des contours du stimulus et la transduction du signal sont effectuées par les neurones.
- L'accumulation temporelle de neurotransmetteurs est réalisée par les cellules gliales. Une accumulation à court terme de neurotransmetteurs est susceptible de se produire également dans certains types de neurones.
- La commutation logique est exécutée par les cellules gliales et résulte du dépassement d'un niveau seuil de concentration en neurotransmetteurs. Ce franchissement de seuil s'accompagne également d'une modification du taux de fuite des neurotransmetteurs.
- La commutation physique de tout ou non mouvement est due aux cellules musculaires et résulte du dépassement d'un certain seuil de concentration de neurotransmetteurs sur l'environnement musculaire.
Notez que bien que les signaux électrophysiologiques de la Fig.6 sont souvent similaires au signal fonctionnel (puissance du signal / concentration en neurotransmetteurs / force musculaire), il existe certaines étapes dans lesquelles l'observation électrique est différente de l'objectif fonctionnel de l'étape correspondante. En particulier, Nossenson et al. ont suggéré que le franchissement du seuil de la glie a un fonctionnement fonctionnel complètement différent par rapport au signal électrophysiologique rayonné, et que ce dernier pourrait n'être qu'un effet secondaire de la rupture de la glie.
Applications
Les modèles de neurones à impulsions sont utilisés dans une variété d'applications nécessitant un codage ou un décodage à partir de trains d"impulsions neuronales dans le contexte de neuroprothèses et d' interfaces cerveau-ordinateur telles que les prothèses rétiniennes[8],[88],[89],[90] : ou membres artificiels contrôle et sensation[91],[92],[93].
Relation entre les modèles de neurones artificiels et biologiques
Le modèle de neurone le plus basique, le neurone formel, consiste en une entrée associé à un vecteur de poids synaptique et une fonction d'activation ou une fonction de transfert déterminant la sortie du neurone. C'est la structure de base utilisée pour les neurones artificiels, qui dans un réseau de neurones artificiel ressemble souvent à
où yi est la sortie du i-ème neurone, xj est le j-ème signal de neurone d'entrée, wij le poids synaptique entre les neurones i et j et φ la fonction d'activation . Bien que ce modèle ait eu un grand succès dans les applications d'apprentissage automatique, il s'agit d'un modèle de neurones (biologiques) médiocre, car il ne rend pas compte des dépendances temporelles entre les entrées et les sorties.
Lorsqu'une entrée est activée à un instant t et maintenue constante par la suite, les neurones biologiques émettent un train d'impulsions. Il est important de noter que ce train d'impulsions n'est pas régulier mais présente une structure temporelle caractérisée par une adaptation, une explosion ou une explosion initiale suivie d'une augmentation régulière. Les modèles d'intégration-et-tir généralisés tel que le modèle d'intégration-et-tir exponentiel adaptatif, le modèle de réponse d'impulsion ou le modèle d'intégration-et-tir adaptatif (linéaire) sont capables de capturer ces modèles de potentiel d'action[20],[21],[22].
De plus, l'entrée neuronale dans le cerveau est dépendante du temps. L'entrée dépendante du temps est transformée par des filtres linéaires et non linéaires complexes en un train d'impulsions en sortie. À nouveau, le modèle de réponse d'impulsion ou le modèle adaptatif d'intégration-et-tir permettent de prédire le train d'impulsions de la sortie pour une entrée arbitraire en fonction du temps[18],[19], alors qu'un neurone artificiel ou un simple modèle intégration-et-tir avec fuite en sont incapables.
Si nous prenons le modèle de Hodkgin-Huxley comme point de départ, on peut obtenir les modèles d'intégration-et-tir généralisés par des procédures de simplification. Cela a été montré explicitement pour le modèle exponentiel d'intégration-et-tir [29] et le modèle de réponse d'impulsion[55] .
Dans le cadre de la modélisation d'un neurone biologique, des analogues physiques sont utilisés à la place d'abstractions telles que "poids" et "fonction de transfert". Un neurone est rempli et entouré d'eau contenant des ions, porteurs d'une charge électrique. Le neurone est lié par une membrane cellulaire isolante et peut maintenir une concentration d'ions chargés de chaque côté qui détermine une capacité Cm . Le déclenchement d'un neurone implique le mouvement des ions dans la cellule qui se produit lorsque les neurotransmetteurs provoquent l'ouverture des canaux ioniques sur la membrane cellulaire. Nous décrivons cela par un courant I(t) . Cela entraîne un changement de tension, ou la différence d'énergie potentielle électrique entre la cellule et son environnement, qui entraîne parfois un pic de tension appelé potentiel d'action qui parcourt la longueur de la cellule et déclenche la libération d'autres neurotransmetteurs. La tension, alors, est la quantité d'intérêt et est donnée par Vm(t)[15] .
Si le courant d'entrée est constant, la plupart des neurones émettent après un certain temps d'adaptation ou d'éclatement initial un train d'impulsions régulier. La fréquence d'impulsions régulières en réponse à un courant constant I est décrite par la relation fréquence-courant qui correspond à la fonction de transfert des réseaux de neurones artificiels. De même, pour tous les modèles de neurones à impulsion, la fonction de transfert peut être calculée numériquement (ou analytiquement).
Liens externes
- Neuronal dynamics : from single neurons to networks and models of cognition (W. Gerstner, W. Kistler, R. Naud, L. Paninski, Cambridge University Press, 2014)[23] . En particulier, les chapitres 6 à 10, version html en ligne .
- Spiking Neuron Models [1] (W. Gerstner et W. Kistler, Cambridge University Press, 2002)
Voir également
Références
- Spiking neuron models : single neurons, populations, plasticity, Cambridge, U.K., Cambridge University Press, (ISBN 0-511-07817-X, OCLC 57417395, lire en ligne)
- Methods in neuronal modeling: from ions to networks, Cambridge, Massachusetts, 2nd, , 687 p. (ISBN 978-0-262-11231-4, lire en ligne)
- (en) « New Types of Experiments Reveal that a Neuron Functions as Multiple Independent Threshold Units », Scientific Reports, vol. 7, no 1, , p. 18036 (PMID 29269849, PMCID 5740076, DOI 10.1038/s41598-017-18363-1, Bibcode 2017NatSR...718036S)
- « A quantitative description of membrane current and its application to conduction and excitation in nerve », The Journal of Physiology, vol. 117, no 4, , p. 500–44 (PMID 12991237, PMCID 1392413, DOI 10.1113/jphysiol.1952.sp004764)
- « Measurement of current-voltage relations in the membrane of the giant axon of Loligo », The Journal of Physiology, vol. 116, no 4, , p. 424–48 (PMID 14946712, PMCID 1392219, DOI 10.1113/jphysiol.1952.sp004716)
- « Currents carried by sodium and potassium ions through the membrane of the giant axon of Loligo », The Journal of Physiology, vol. 116, no 4, , p. 449–72 (PMID 14946713, PMCID 1392213, DOI 10.1113/jphysiol.1952.sp004717)
- « The components of membrane conductance in the giant axon of Loligo », The Journal of Physiology, vol. 116, no 4, , p. 473–96 (PMID 14946714, PMCID 1392209, DOI 10.1113/jphysiol.1952.sp004718)
- « Photovoltaic Retinal Prosthesis with High Pixel Density », Nature Photonics, vol. 6, no 6, , p. 391–397 (PMID 23049619, PMCID 3462820, DOI 10.1038/nphoton.2012.104, Bibcode 2012NaPho...6..391M)
- (en) E.M. Izhikevich, « Simple model of spiking neurons », IEEE Transactions on Neural Networks, vol. 14, no 6, , p. 1569–1572 (ISSN 1045-9227, DOI 10.1109/TNN.2003.820440, lire en ligne, consulté le )
- « Models of neocortical layer 5b pyramidal cells capturing a wide range of dendritic and perisomatic active properties », PLOS Computational Biology, vol. 7, no 7, , e1002107 (PMID 21829333, PMCID 3145650, DOI 10.1371/journal.pcbi.1002107, Bibcode 2011PLSCB...7E2107H)
- Methods in neuronal modeling : from ions to networks., [Place of publication not identified], 02, (ISBN 0-262-51713-2, OCLC 947133821, lire en ligne).
- Louis Lapicque, « Recherches quantitatives sur l’excitation electrique des nerfs traitee comme une polarization », Journal of Physiol Pathol Générale, , p. 620-635 (lire en ligne)
- « Lapicque's introduction of the integrate-and-fire model neuron (1907) », Brain Research Bulletin, vol. 50, nos 5–6, , p. 303–4 (PMID 10643408, DOI 10.1016/S0361-9230(99)00161-6, lire en ligne [archive du ])
- « Dynamics of sparsely connected networks of excitatory and inhibitory spiking neurons », Journal of Computational Neuroscience, vol. 8, no 3, , p. 183–208 (PMID 10809012, DOI 10.1023/A:1008925309027)
- « Simple capacitor-switch model of excitatory and inhibitory neuron with all parts biologically explained allows input fire pattern dependent chaotic oscillations », Scientific Reports, vol. 10, no 1, , p. 7353 (PMID 32355185, PMCID 7192907, DOI 10.1038/s41598-020-63834-7, Bibcode 2020NatSR..10.7353C)
- « Interpretation of the repetitive firing of nerve cells », The Journal of General Physiology, vol. 45, no 6, , p. 1163–79 (PMID 13895926, PMCID 2195242, DOI 10.1085/jgp.45.6.1163)
- « Minimal models of adapted neuronal response to in vivo-like input currents », Neural Computation, vol. 16, no 10, , p. 2101–24 (PMID 15333209, DOI 10.1162/0899766041732468, lire en ligne)
- « Predicting spike timing of neocortical pyramidal neurons by simple threshold models », Journal of Computational Neuroscience, vol. 21, no 1, , p. 35–49 (PMID 16633938, DOI 10.1007/s10827-006-7074-5, lire en ligne)
- « Temporal whitening by power-law adaptation in neocortical neurons », Nature Neuroscience, vol. 16, no 7, , p. 942–8 (PMID 23749146, DOI 10.1038/nn.3431, lire en ligne)
- « What matters in neuronal locking? », Neural Computation, vol. 8, no 8, , p. 1653–76 (PMID 8888612, DOI 10.1162/neco.1996.8.8.1653, lire en ligne)
- « Simple model of spiking neurons », IEEE Transactions on Neural Networks, vol. 14, no 6, , p. 1569–72 (PMID 18244602, DOI 10.1109/TNN.2003.820440)
- « Firing patterns in the adaptive exponential integrate-and-fire model », Biological Cybernetics, vol. 99, nos 4–5, , p. 335–47 (PMID 19011922, PMCID 2798047, DOI 10.1007/s00422-008-0264-7)
- Neuronal dynamics : from single neurons to networks and models of cognition, Cambridge, United Kingdom, (ISBN 978-1-107-06083-8, OCLC 861774542, lire en ligne)
- « From subthreshold to firing-rate resonance », Journal of Neurophysiology, vol. 89, no 5, , p. 2538–54 (PMID 12611957, DOI 10.1152/jn.00955.2002)
- « Fractional differentiation by neocortical pyramidal neurons », Nature Neuroscience, vol. 11, no 11, , p. 1335–42 (PMID 18931665, PMCID 2596753, DOI 10.1038/nn.2212)
- « Neuronal spike timing adaptation described with a fractional leaky integrate-and-fire model », PLOS Computational Biology, vol. 10, no 3, , e1003526 (PMID 24675903, PMCID 3967934, DOI 10.1371/journal.pcbi.1003526, Bibcode 2014PLSCB..10E3526T)
- « Dynamic I-V curves are reliable predictors of naturalistic pyramidal-neuron voltage traces », Journal of Neurophysiology, vol. 99, no 2, , p. 656–66 (PMID 18057107, DOI 10.1152/jn.01107.2007)
- « Adaptive exponential integrate-and-fire model as an effective description of neuronal activity », Journal of Neurophysiology, vol. 94, no 5, , p. 3637–42 (PMID 16014787, DOI 10.1152/jn.00686.2005, lire en ligne)
- « How spike generation mechanisms determine the neuronal response to fluctuating inputs », The Journal of Neuroscience, vol. 23, no 37, , p. 11628–40 (PMID 14684865, PMCID 6740955, DOI 10.1523/JNEUROSCI.23-37-11628.2003)
- « How connectivity, background activity, and synaptic properties shape the cross-correlation between spike trains », The Journal of Neuroscience, vol. 29, no 33, , p. 10234–53 (PMID 19692598, PMCID 6665800, DOI 10.1523/JNEUROSCI.1275-09.2009)
- « Conductance-Based Adaptive Exponential Integrate-and-Fire Model », Neural Computation, vol. 33, no 1, , p. 41–66 (PMID 33253029, DOI 10.1162/neco_a_01342)
- « Impulses and Physiological States in Theoretical Models of Nerve Membrane », Biophysical Journal, vol. 1, no 6, , p. 445–66 (PMID 19431309, PMCID 1366333, DOI 10.1016/S0006-3495(61)86902-6, Bibcode 1961BpJ.....1..445F)
- « FitzHugh-Nagumo model », Scholarpedia, vol. 1, no 9, , p. 1349 (DOI 10.4249/scholarpedia.1349, Bibcode 2006SchpJ...1.1349I)
- Methods in Neuronal Modeling, 251 p. (ISBN 978-0262517133), « Chapter 7: Analysis of Neural Excitability and Oscillations »
- Bursting, WORLD SCIENTIFIC, , 3–18 p. (ISBN 978-981-256-506-8, DOI 10.1142/9789812703231_0001), « The development of the hindmarsh-rose model for bursting »
- « Parabolic Bursting in an Excitable System Coupled with a Slow Oscillation », SIAM Journal on Applied Mathematics, vol. 46, no 2, , p. 233–253 (ISSN 0036-1399, DOI 10.1137/0146017)
- « Type I membranes, phase resetting curves, and synchrony », Neural Computation, vol. 8, no 5, , p. 979–1001 (PMID 8697231, DOI 10.1162/neco.1996.8.5.979)
- « Spike initiation by transmembrane current: a white-noise analysis », The Journal of Physiology, vol. 260, no 2, , p. 279–314 (PMID 978519, PMCID 1309092, DOI 10.1113/jphysiol.1976.sp011516)
- « Reliability of spike timing in neocortical neurons », Science, vol. 268, no 5216, , p. 1503–6 (PMID 7770778, DOI 10.1126/science.7770778, Bibcode 1995Sci...268.1503M)
- « Detecting and estimating signals in noisy cable structure, I: neuronal noise sources », Neural Computation, vol. 11, no 8, , p. 1797–829 (PMID 10578033, DOI 10.1162/089976699300015972, lire en ligne)
- « A Theoretical Analysis of Neuronal Variability », Biophysical Journal, vol. 5, no 2, , p. 173–94 (PMID 14268952, PMCID 1367716, DOI 10.1016/s0006-3495(65)86709-1, Bibcode 1965BpJ.....5..173S)
- « Associative memory in a network of 'spiking' neurons », Network: Computation in Neural Systems, vol. 3, no 2, , p. 139–164 (ISSN 0954-898X, DOI 10.1088/0954-898X_3_2_004, lire en ligne)
- « Estimation of the input parameters in the Ornstein–Uhlenbeck neuronal model », Physical Review E, vol. 71, no 1 Pt 1, , p. 011907 (PMID 15697630, DOI 10.1103/PhysRevE.71.011907, Bibcode 2005PhRvE..71a1907D)
- « Firing-rate response of linear and nonlinear integrate-and-fire neurons to modulated current-based and conductance-based synaptic drive », Physical Review E, vol. 76, no 2 Pt 1, , p. 021919 (PMID 17930077, DOI 10.1103/PhysRevE.76.021919, Bibcode 2007PhRvE..76b1919R)
- « Dynamics of sparsely connected networks of excitatory and inhibitory spiking neurons », Journal of Computational Neuroscience, vol. 8, no 3, , p. 183–208 (PMID 10809012, DOI 10.1023/A:1008925309027, lire en ligne)
- Neural Networks, Springer, , 116–144 p., « Diffusion models for the stochastic activity of neurons »
- « A model of the peripheral auditory system », Kybernetik, vol. 3, no 4, , p. 153–75 (PMID 5982096, DOI 10.1007/BF00290252)
- « Population dynamics of spiking neurons: fast transients, asynchronous states, and locking », Neural Computation, vol. 12, no 1, , p. 43–89 (PMID 10636933, DOI 10.1162/089976600300015899)
- « Coding and decoding with adapting neurons: a population approach to the peri-stimulus time histogram », PLOS Computational Biology, vol. 8, no 10, , e1002711 (PMID 23055914, PMCID 3464223, DOI 10.1371/journal.pcbi.1002711, Bibcode 2012PLSCB...8E2711N)
- « Why spikes? Hebbian learning and retrieval of time-resolved excitation patterns », Biological Cybernetics, vol. 69, nos 5-6, , p. 503–15 (PMID 7903867, DOI 10.1007/BF00199450)
- « Associative memory in a network of 'spiking' neurons », Network: Computation in Neural Systems, vol. 3, no 2, , p. 139–164 (ISSN 0954-898X, DOI 10.1088/0954-898X_3_2_004, lire en ligne)
- « Time structure of the activity in neural network models », Physical Review E, vol. 51, no 1, , p. 738–758 (PMID 9962697, DOI 10.1103/PhysRevE.51.738, Bibcode 1995PhRvE..51..738G)
- « A point process framework for relating neural spiking activity to spiking history, neural ensemble, and extrinsic covariate effects », Journal of Neurophysiology, vol. 93, no 2, , p. 1074–89 (PMID 15356183, DOI 10.1152/jn.00697.2004)
- « Spatio-temporal correlations and visual signalling in a complete neuronal population », Nature, vol. 454, no 7207, , p. 995–9 (PMID 18650810, PMCID 2684455, DOI 10.1038/nature07140, Bibcode 2008Natur.454..995P)
- (en) « Reduction of the Hodgkin-Huxley Equations to a Single-Variable Threshold Model », Neural Computation, vol. 9, no 5, , p. 1015–1045 (ISSN 0899-7667, DOI 10.1162/neco.1997.9.5.1015, lire en ligne)
- « Time structure of the activity in neural network models », Physical Review E, vol. 51, no 1, , p. 738–758 (PMID 9962697, DOI 10.1103/PhysRevE.51.738, Bibcode 1995PhRvE..51..738G, lire en ligne)
- « Infinite Systems of Interacting Chains with Memory of Variable Length — A Stochastic Model for Biological Neural Nets », Journal of Statistical Physics, vol. 151, no 5, , p. 896–921 (DOI 10.1007/s10955-013-0733-9, Bibcode 2013JSP...151..896G, arXiv 1212.5505)
- « Frequency discrimination in the auditory system: Place or periodicity mechanisms? », Proceedings of the IEEE, vol. 58, no 5, , p. 723–730 (ISSN 0018-9219, DOI 10.1109/PROC.1970.7727)
- « Some implications of the stochastic behavior of primary auditory neurons », Kybernetik, vol. 2, no 5, , p. 206–15 (PMID 5839007, DOI 10.1007/BF00306416)
- 2010 IEEE Sensor Array and Multichannel Signal Processing Workshop, (ISBN 978-1-4244-8978-7, DOI 10.1109/SAM.2010.5606761), « Modeling neuron firing pattern using a two state Markov chain »
- « Optimal sequential detection of stimuli from multiunit recordings taken in densely populated brain regions », Neural Computation, vol. 24, no 4, , p. 895–938 (PMID 22168560, DOI 10.1162/NECO_a_00257)
- « Detection of stimuli from multi-neuron activity: Empirical study and theoretical implications. », Neurocomputing 174 (2016): 822-837., vol. 174, , p. 822–837 (DOI 10.1016/j.neucom.2015.10.007)
- « Refractoriness and neural precision », The Journal of Neuroscience, vol. 18, no 6, , p. 2200–11 (PMID 9482804, PMCID 6792934, DOI 10.1523/JNEUROSCI.18-06-02200.1998)
- « A spike-train probability model », Neural Computation, vol. 13, no 8, , p. 1713–20 (PMID 11506667, DOI 10.1162/08997660152469314)
- « Stimulus and recovery dependence of cat cochlear nerve fiber spike discharge probability », Journal of Neurophysiology, vol. 48, no 3, , p. 856–73 (PMID 6290620, DOI 10.1152/jn.1982.48.3.856)
- « A statistical study of cochlear nerve discharge patterns in response to complex speech stimuli », The Journal of the Acoustical Society of America, vol. 92, no 1, , p. 202–9 (PMID 1324958, DOI 10.1121/1.404284, Bibcode 1992ASAJ...92..202M)
- « The transmission of signals by auditory-nerve fiber discharge patterns », The Journal of the Acoustical Society of America, vol. 74, no 2, , p. 493–501 (PMID 6311884, DOI 10.1121/1.389815, Bibcode 1983ASAJ...74..493J)
- « A simple white noise analysis of neuronal light responses », Network: Computation in Neural Systems, vol. 12, no 2, , p. 199–213 (PMID 11405422, DOI 10.1080/713663221)
- « Maximum likelihood estimation of cascade point-process neural encoding models », Network: Computation in Neural Systems, vol. 15, no 4, , p. 243–62 (PMID 15600233, DOI 10.1088/0954-898X_15_4_002)
- Erreur de script : le module « citation/CS1 » n’existe pas.
- « Somatosensory inputs modify auditory spike timing in dorsal cochlear nucleus principal cells », The European Journal of Neuroscience, vol. 33, no 3, , p. 409–20 (PMID 21198989, PMCID 3059071, DOI 10.1111/j.1460-9568.2010.07547.x)
- « Stimulus-specific adaptations in the gaze control system of the barn owl », The Journal of Neuroscience, vol. 28, no 6, , p. 1523–33 (PMID 18256273, PMCID 6671572, DOI 10.1523/JNEUROSCI.3785-07.2008)
- « Sustained firing in auditory cortex evoked by preferred stimuli », Nature, vol. 435, no 7040, , p. 341–6 (PMID 15902257, DOI 10.1038/nature03565, Bibcode 2005Natur.435..341W)
- « Response properties of single auditory nerve fibers in the mouse », Journal of Neurophysiology, vol. 93, no 1, , p. 557–69 (PMID 15456804, DOI 10.1152/jn.00574.2004)
- « Processing of learned information in paradoxical sleep: relevance for memory », Behavioural Brain Research, the Function of Sleep, vol. 69, nos 1–2, , p. 125–35 (PMID 7546303, DOI 10.1016/0166-4328(95)00013-J)
- « Quantitative analysis of cat retinal ganglion cell response to visual stimuli », Vision Research, vol. 5, no 11, , p. 583–601 (PMID 5862581, DOI 10.1016/0042-6989(65)90033-7)
- « The control of retinal ganglion cell discharge by receptive field surrounds », The Journal of Physiology, vol. 247, no 3, , p. 551–78 (PMID 1142301, PMCID 1309488, DOI 10.1113/jphysiol.1975.sp010947)
- « Adaptation and dynamics of cat retinal ganglion cells », The Journal of Physiology, vol. 233, no 2, , p. 271–309 (PMID 4747229, PMCID 1350567, DOI 10.1113/jphysiol.1973.sp010308)
- « Stimulus size and intensity alter fundamental receptive-field properties of mouse retinal ganglion cells in vivo », Visual Neuroscience, vol. 22, no 5, , p. 649–59 (PMID 16332276, DOI 10.1017/S0952523805225142)
- « Biophysical mechanisms underlying olfactory receptor neuron dynamics », Nature Neuroscience, vol. 14, no 2, , p. 208–16 (PMID 21217763, PMCID 3030680, DOI 10.1038/nn.2725)
- « Response of anterior parietal cortex to cutaneous flutter versus vibration », Journal of Neurophysiology, vol. 82, no 1, , p. 16–33 (PMID 10400931, DOI 10.1152/jn.1999.82.1.16)
- « Effects of the activity of the internal globus pallidus-pedunculopontine loop on the transmission of the subthalamic nucleus-external globus pallidus-pacemaker oscillatory activities to the cortex », Journal of Computational Neuroscience, vol. 16, no 2, , p. 113–27 (PMID 14758061, DOI 10.1023/B:JCNS.0000014105.87625.5f)
- « Glutamate evokes firing through activation of kainate receptors in chick accessory lobe neurons », Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural, and Behavioral Physiology, vol. 199, no 1, , p. 35–43 (PMID 23064516, DOI 10.1007/s00359-012-0766-6)
- « Rate-versus-level functions of primary auditory nerve fibres: evidence for square law behaviour of all fibre categories in the guinea pig », Hearing Research, vol. 55, no 1, , p. 50–6 (PMID 1752794, DOI 10.1016/0378-5955(91)90091-M)
- « Analysis of discharges recorded simultaneously from pairs of auditory nerve fibers », Biophysical Journal, vol. 16, no 7, , p. 719–34 (PMID 938715, PMCID 1334896, DOI 10.1016/s0006-3495(76)85724-4, Bibcode 1976BpJ....16..719J)
- « Comparative physiology of acoustic and allied central analyzers », Acta Oto-Laryngologica. Supplementum, vol. 532, no sup532, , p. 13–21 (PMID 9442839, DOI 10.3109/00016489709126139)
- « Progressive changes in auditory response patterns to repeated tone during normal wakefulness and paralysis », Brain Research, vol. 16, no 1, , p. 133–48 (PMID 5348845, DOI 10.1016/0006-8993(69)90090-0)
- « Update on retinal prosthetic research: the Boston Retinal Implant Project », Journal of Neuro-Ophthalmology, vol. 31, no 2, , p. 160–8 (PMID 21593628, DOI 10.1097/wno.0b013e31821eb79e)
- « The Artificial Synapse Chip: a flexible retinal interface based on directed retinal cell growth and neurotransmitter stimulation », Artificial Organs, vol. 27, no 11, , p. 975–85 (PMID 14616516, DOI 10.1046/j.1525-1594.2003.07307.x)
- « Microfluidic neurotransmiter-based neural interfaces for retinal prosthesis », Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEE Engineering in Medicine and Biology Society. Annual International Conference, vol. 2009, , p. 4563–5 (PMID 19963838, DOI 10.1109/IEMBS.2009.5332694)
- « Multichannel Intraneural and Intramuscular Techniques for Multiunit Recording and Use in Active Prostheses », Proceedings of the IEEE, vol. 98, no 3, , p. 432–449 (ISSN 0018-9219, DOI 10.1109/JPROC.2009.2038613)
- « Real-time control of hind limb functional electrical stimulation using feedback from dorsal root ganglia recordings », Journal of Neural Engineering, vol. 10, no 2, , p. 026020 (PMID 23503062, PMCID 3640462, DOI 10.1088/1741-2560/10/2/026020, Bibcode 2013JNEng..10b6020B)
- « BrainGate - Home », braingate2.org, (consulté le )
- Portail des neurosciences