Éthylène glycol
L'éthylène glycol ou glycol ou encore éthane-1,2-diol est le plus simple composé chimique de la famille des glycols.
Pour les articles homonymes, voir Glycol.
| Éthylène glycol | ||
 | ||
| Structure de l'éthylène glycol | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Éthane-1,2-diol | |
| Synonymes |
1,2-dihydroxyéthane |
|
| No CAS | ||
| No ECHA | 100.003.159 | |
| No CE | 203-473-3 | |
| PubChem | ||
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore, visqueux, hygroscopique[1]. | |
| Propriétés chimiques | ||
| Formule | C2H6O2 [Isomères] |
|
| Masse molaire[2] | 62,067 8 ± 0,002 6 g/mol C 38,7 %, H 9,74 %, O 51,55 %, |
|
| Propriétés physiques | ||
| T° fusion | −12,69 °C pur[3] −26 °C à 40% vol dans l'eau[réf. nécessaire] |
|
| T° ébullition | 197,3 °C[3] | |
| Solubilité | Miscible avec l'eau, le glycérol, la pyridine, l'acétone, les aldéhydes, l'acide acétique. Peu sol dans l'éther (1 pour 200). Pratiquement insol dans le benzène, les huiles. | |
| Paramètre de solubilité δ | 29,9 MPa1/2 (25 °C)[4]; 32,4 J1/2 cm−3/2 (25 °C)[5] |
|
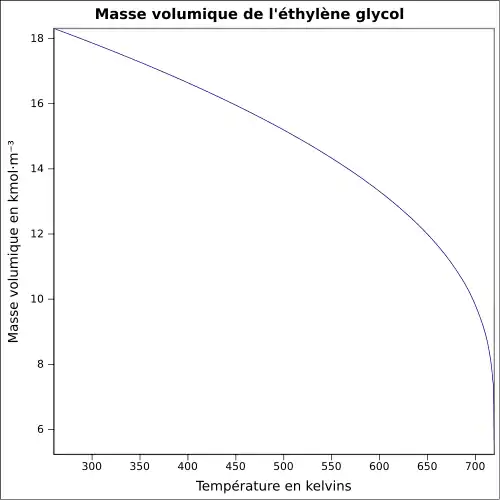
| Masse volumique | 1,127 4 g cm−3 (0 °C) 1,120 4 g cm−3 (10 °C) 1,113 5 g cm−3 (20 °C) 1,106 5 g cm−3 (30 °C) |
|
| T° d'auto-inflammation | 398 °C[1] | |
| Point d’éclair | 111 °C (coupelle fermée)[1]. | |
| Limites d’explosivité dans l’air | 3,2–15,3 % vol[1] | |
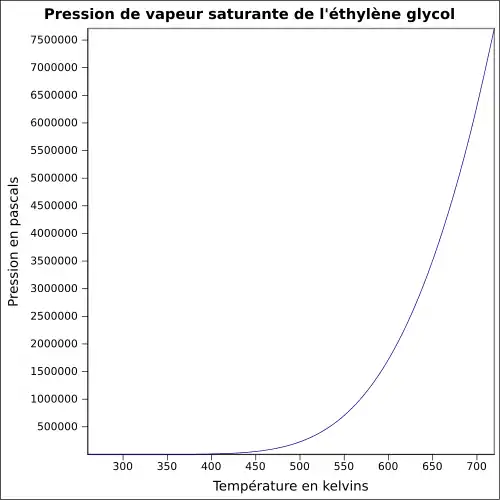
| Pression de vapeur saturante | à 20 °C : 7 Pa[1]
|
|
| Viscosité dynamique | (16,06 × 10−3 Pa s à 25 °C)[7] | |
| Point critique | 8 MPa, 446,85 °C[8] | |
| Vitesse du son | 1 658 m s−1 à 25 °C[9] | |
| Thermochimie | ||
| S0gaz, 1 bar | 303,8 J mol−1 K−1[10] | |
| S0liquide, 1 bar | 163,2 J mol−1 K−1[10] | |
| ΔfH0gaz | −392,2 kJ mol−1[10] | |
| ΔfH0liquide | −460,0 kJ mol−1[10] | |
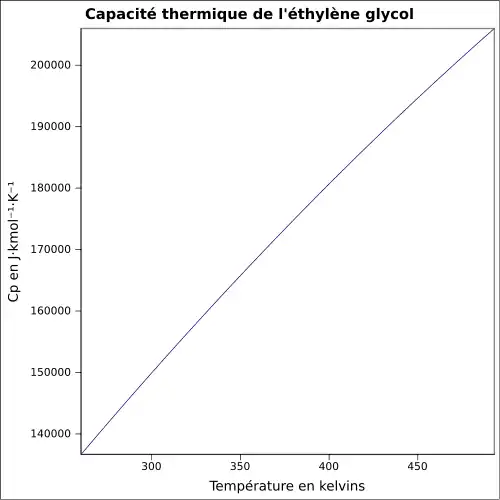
| Cp | ||
| PCS | 1 189,2 kJ mol−1[12] (liquide) | |
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 10,16 eV (gaz)[13] | |
| Cristallographie | ||
| Classe cristalline ou groupe d’espace | P 212121[14] | |
| Paramètres de maille | a = 5,013 Å b = 6,915 Å |
|
| Volume | 321,38 Å3[14] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,431 8[3] | |
| Précautions | ||
| SGH[15] | ||
  Attention |
||
| SIMDUT[16] | ||
 D2A, |
||
| NFPA 704 | ||
| Inhalation | Vomissements, paralysie | |
| Écotoxicologie | ||
| DL50 | 8,54 g kg−1 (rat, oral) 6,61 (cochon d'Inde, oral) 13,79 ml kg−1 (souris, oral) | |
| Valeur d'exposition | 10 mL m−3, 26 mg m−3 | |
| autre | S'enflamme au contact de KMnO4 après 10 à 20 s. | |
| LogP | −1,93[1] | |
| Seuil de l’odorat | bas : 0,08 ppm haut : 25 ppm[17] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
Sa formule semi-développée est HO—CH2—CH2—OH et sa formule brute C2H6O2 (c'est le plus simple des diols). L'éthylène glycol est fréquemment employé en tant qu'antigel, dans le liquide de refroidissement des automobiles. À température ambiante, c'est un liquide visqueux incolore et sans odeur, avec un goût sucré. L'éthylène glycol est toxique et son ingestion nécessite des soins médicaux urgents.
Nom
« Éthane-1,2-diol » est le nom systématique défini par la nomenclature des composés organiques pour une molécule avec deux atomes de carbone (préfixe éth-) ayant une liaison simple entre eux (suffixe -ane) et attaché à deux groupes hydroxyle sur chacun des deux carbones (suffixe -1,2-diol). « Éthylène glycol » est l'appellation triviale communément utilisée pour l'éthane-1,2-diol.
Histoire
L'éthylène glycol est synthétisé pour la première fois en 1859 par le chimiste français Charles Adolphe Wurtz via la saponification du diacétate d'éthylène glycol par l'hydroxyde de potassium, d'une part[18], et par l'hydratation de l'oxyde d'éthylène d'autre part[19]. Il fut produit en petite quantité durant la Première Guerre mondiale comme réfrigérant et comme constituant d'explosifs. Sa production industrielle débuta en 1937, dès lors que son précurseur, l'oxyde d'éthylène, fut lui-même produit en quantité industrielle à bas prix.
Il provoqua une petite révolution dans le monde de l'aéronautique en remplaçant l'eau du système de refroidissement. Sa température d'ébullition élevée permit ainsi de diminuer la taille du radiateur, et donc son poids et sa traînée aérodynamique. Avant que l'éthylène glycol ne soit disponible, les systèmes de refroidissement utilisaient en effet de l'eau à haute pression ; ces systèmes étaient encombrants et peu fiables, et en cas de combat aérien, facilement touchés par les balles ennemies.
Propriétés physico-chimiques
L'éthylène glycol est le plus simple des diols vicinaux, et possède des propriétés physico-chimiques particulières du fait de sa structure comprenant deux groupes hydroxyle adjacents le long de la chaîne hydrocarbonée.
C'est un liquide incolore, inodore, peu volatil et hygroscopique avec une faible viscosité (16,06 × 10−3 Pa s à 25 °C)[7]. Il est complètement miscible avec de nombreux solvants polaires, comme l'eau, les alcools et l'acétone, et très peu soluble dans les solvants apolaires, comme le benzène, le toluène, le dichloroéthane ou le chloroforme[20].
L'éthylène glycol a une constante molaire cryoscopique de 3,11 K kg mol−1[21] et une constante molaire ébullioscopique de 2,26 K kg mol−1[22].
 Température de gel.
Température de gel. Viscosité du mélange avec l'eau.
Viscosité du mélange avec l'eau. Viscosité en fonction de la température.
Viscosité en fonction de la température.
Production
Il est synthétisé à partir d'éthylène, via un intermédiaire d'oxyde d'éthylène qui réagit avec l'eau, selon l'équation :
C2H4O + H2O → C2H6O2
Cette réaction peut être catalysée en milieu acide ou basique, ou bien encore à haute température. En milieu acide et avec un excès d'eau, le rendement de la réaction peut atteindre 90 %. Les oligomères d'éthylène glycol (diéthylène glycol, triéthylène glycol, tétraéthylène glycol) peuvent être obtenus de la même manière.
Il peut aussi être produit par des vers de cire, lors de leur ingestion de polyéthylène (HDPE). Cette digestion est possible par l'intermédiaire d'une bactérie présente dans le système digestif du vers.[23]
Réactivité et réactions
L'utilisation de l'éthylène glycol est limitée par quelques précautions :
- éviter tout contact avec les oxydants forts, l'aluminium, le chlorure de chromyle, les hydroxydes alcalins, l'acide perchlorique ;
- l'éthylène glycol est combustible, hygroscopique, incompatible avec les différentes matières synthétiques. Il peut exploser au contact de l'air après chauffage sous forme de vapeur ou de gaz.
L'éthylène glycol est utilisé comme groupe protecteur des groupes carbonyle au cours des réactions de synthèse des composés organiques. Le traitement d'un aldéhyde ou d'une cétone avec de l'éthylène glycol en présence d'un catalyseur acide (par exemple acide p-toluène sulfonique ; trifluorure de bore) donne le 1,3-dioxolane correspondant, qui est résistant à l'action des bases et les autres composés nucléophiles. En outre, le groupe protecteur 1,3-dioxolanne peut ensuite être éliminé par hydrolyse acide. Dans cet exemple, l'isophorone est protégée par l'éthylène glycol et l'acide p-toluènesulfonique à faible rendement. L'eau a été éliminée par distillation azéotropique pour déplacer l'équilibre vers la droite.
Il est utilisé pour la protection des fonctions carbonyle, dans la réaction d'acétalisation.

Utilisation
L'éthylène glycol fut surtout connu et employé en tant qu'antigel et fluide réfrigérant[24]. Son point de fusion étant bas, il a aussi été utilisé comme dégivrant pour les pare-brise et pour les moteurs à réaction. L'éthylène glycol est principalement une base chimique dans le domaine des industries pétrochimiques, où il permet la production de fibres textiles et de résines de polyesters, dont le polytéréphtalate d'éthylène, principal matériau des bouteilles en plastique. Ses propriétés antigel en font aussi un constituant important des solutions destinées à la conservation de tissus organiques à basse température.
La température d'ébullition élevée de l'éthylène glycol et sa grande affinité pour l'eau en font un déshydratant idéal pour la production de gaz naturel. Dans les tours de déshydratation, on fait ainsi se rencontrer l'éthylène glycol liquide coulant du haut de la tour avec le mélange d'eau et d'hydrocarbures gazeux s'échappant du bas. Le glycol capte l'eau et s'écoule au fond, tandis que les vapeurs d'hydrocarbures sont récupérées au sommet. On réinjecte ensuite l'éthylène glycol pour renouveler l'opération.
Intoxication au produit
Le principal danger de l'éthylène glycol provient de sa toxicité en cas d'ingestion. À cause de son goût sucré, les enfants et les animaux peuvent ingérer une grande quantité d'éthylène glycol si on le laisse à leur portée et les cas sont loin d'être rares (plus de 7 000 intoxications suspectées aux États-Unis en 2011[25]). La toxicité est essentiellement due à ses métabolites et non pas à l'éthylène glycol lui-même. La progression des symptômes d'une intoxication se fait en plusieurs étapes. La première est l'apparition de symptômes neurologiques. La victime peut paraître légèrement intoxiquée, se plaindre d'étourdissements et avoir l'air confus. Ensuite, le corps convertit l'éthylène glycol en une autre toxine, l'acide oxalique qui va précipiter dans les reins, causant une insuffisance rénale aiguë[26].
En cas d'intoxication, il peut y avoir une élévation importante du taux de lactates sanguins, qui est, en fait, une fausse élévation due à la proximité chimique entre le lactate et les produits de dégradation du glycol : le glycolate et le glyoxylate. Ces derniers donnent en effet des réactions croisées avec certains systèmes de mesure de la concentration en lactate[27]. Il existe également un « trou osmolaire » avec une osmolalité mesurée bien supérieure à celle évaluée par la mesure de la natrémie, de la glycémie et de l'urémie[27].
L'éthylène glycol peut être mortel pour les adultes. Dans tous les cas, des soins médicaux urgents sont nécessaires. Si la victime est encore consciente, il faut si possible lui faire boire 100 mL (un verre) d'un alcool fort à 45°[28]. L'éthanol remplace en effet l'éthylène glycol auprès des enzymes qui dégradent ce dernier en composés plus toxiques, ce qui limite la production de toxines (on parle d'inhibiteur compétitif). Il convient également d'amener la personne dans un hôpital où l'on pourra lui administrer, plutôt que de l'éthanol, d'autres inhibiteurs de l'alcool déshydrogénase, enzyme responsable chez l'homme de la transformation de l'éthanol en éthanal, et l'éthylène glycol en aldéhyde oxalique, qui se transformera (grâce à d'autres déshydrogénases) finalement en oxalate, qui lui est toxique. L'un de ces inhibiteurs est le fomépizole[29].
À cause de sa toxicité, l'éthylène glycol a déjà fait parler de lui dans les médias :
- en 2007, on a découvert du glycol dans des dentifrices en provenance de Chine. Les fabricants qui ont accepté de répondre à des journalistes ont expliqué que le glycol permet à la pâte d'avoir la bonne consistance. En principe, on n'avale pas de dentifrice en se lavant les dents, mais en pratique cela peut très bien arriver, surtout en ce qui concerne les enfants.[réf. nécessaire]
Sécurité
Inflammabilité
Peu inflammable à l'état liquide, l'éthylène glycol peut se montrer explosif à l'état gazeux. Il est donc indispensable de le manipuler dans des locaux bien aérés (concentration inférieure à 100 mg m−3).
L'électrolyse de l'éthylène glycol avec une anode en argent produit une réaction exothermique[réf. nécessaire].
Précautions
Les vapeurs d'éthylène glycol sont irritantes avant d'être dangereuses. L'exposition chronique est toutefois la source de pathologies reconnues, en France, comme maladies professionnelles par le code de la Sécurité sociale[28].
Notes et références
- ETHYLENE - GLYCOL, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- D. R. Lide, 2007, chap. 3 (« Physical Constants of Organic Compounds »), p. 232.
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- D. R. Lide, 2007, chap. 15 (« Practical Laboratory Data »), p. 17.
- D. R. Lide, 2007, chap. 6 (« Fluid Properties »), p. 49.
- D. R. Lide, 2007, chap. 14 (« Geophysics, Astronomy, and Acoustics »), p. 40.
- D. R. Lide, 2007, chap. 5 (« Thermochemistry, Electrochemistry, and Kinetics »), p. 22.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-857-8)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89
- D. R. Lide, 2007, chap. 10 (« Atomic, Molecular, and Optical Physics »), p. 213.
- « Ethylene glycol », sur reciprocalnet.org (consulté le )
- FDS établie par Sigma-Aldrich
- « Éthylène glycol » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- « Ethylene glycol », sur hazmap.nlm.nih.gov (consulté le )
- C. A. Wurtz, « Mémoire sur les glycols ou alcools diatomiques », Annal. Chim. Phys., 3e série, vol. 55, , p. 400-478 (lire en ligne).
- C. A. Wurtz, « Synthèse du glycol avec l'oxyde d'éthylène et l'eau », C.R. Hebd. Séances Acad. Sci., vol. XLIX, no 21, , p. 813-815 (lire en ligne).
- H. Yue, 2012.
- D. R. Lide, 2007, chap. 15 (« Practical Laboratory Data »), p. 28.
- D. R. Lide, 2007, chap. 15 (« Practical Laboratory Data »), p. 27.
- (en) Jeff Kart, « ‘Mysterious’ Worms Eat Plastic And Poop Alcohol », sur Forbes (consulté le )
- http://xotxim.ru/etilenglikol/
- Bronstein AC, Spyker DA, Cantilena LR, Rumack BH et Dart RC, 2011 annual report of the American Association of Poison Control Centers’ National Poison Data System (NPDS): 29th annual report, Clin. Toxicol. (Phila), 2012, 50:911-1164
- Guo C, Cenac TA, Li Y et McMartin KE, Calcium oxalate, and not other metabolites, is responsible for the renal toxicity of ethylene glycol, Toxicol. Lett., 2007, 173:8-16
- Oostvogels R, Kemperman H, Hubeek I et ter Braak EW, The importance of the osmolality gap in ethylene glycol intoxication, BMJ, 2013, 347:f6904
- INRS, « Fiche toxicologique n° 25 », septembre 2016
- Brent J, McMartin K, Phillips S et al., Fomepizole for the treatment of ethylene glycol poisoning, N. Engl. J. Med., 1999, 340:832-838
Voir aussi
Bibliographie
- (en) H. Yue, Y. Zhao et al., « Ethylene glycol: properties, synthesis, and applications », Chem. Soc. Rev., vol. 41, , p. 4218-4244 (ISSN 0306-0012, DOI 10.1039/C2CS15359A).
- (en) D. R. Lide (dir.), CRC Handbook of Chemistry and Physics, Boca Raton, FL, CRC Press, , 88e éd., 2640 p. (ISBN 978-0-8493-0488-0).
Articles connexes
Liens externes
- Portail de la chimie