Hydrogénosulfure de sodium
L'hydrogénosulfure de sodium est un composé inorganique ionique de formule brute NaHS, c'est-à-dire constitué de cation Na+ et d'anion hydrogénosulfure HS−, base conjuguée de l'acide sulfure d'hydrogène H2S. NaHS est un réactif utilisé en synthèse organique et inorganique, parfois sous forme solide mais le plus souvent sous forme de solution aqueuse. À l'état pur et anhydre, NaHS est incolore et sent le sulfure d'hydrogène, H2S, ceci étant dû à son hydrolyse par l'humidité de l'air en général. Contrairement au sulfure de sodium, Na2S, qui est insoluble dans les solvants organiques, NaHS, étant un sel 1:1, est plus soluble. En synthèse, NaHS peut-être remplacé par la réaction d'H2S avec une amine pour produire un hydrogénosulfure d'ammonium. Ces solutions d'hydrogénosulfures sont aussi sensibles à l'oxygène qui produit leur conversion en polysulfure, visible par l'apparition d'une couleur jaune.
| Hydrogénosulfure de sodium | |
Formule développée de NaHS 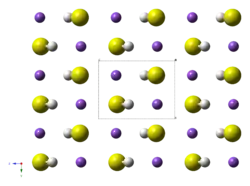 structure monoclinique (P21/m) de l'hydrogénosulfure de sodium à basse température (< −159 °C (114 K)) |
|
| Identification | |
|---|---|
| Nom UICPA | hydrogénosulfure de sodium |
| Nom systématique | hydrogénosulfure de sodium |
| Synonymes |
sulfure acide de sodium, hydrosulfure de sodium, bisulfure de sodium, sulfhydrate de sodium, sulfure d'hydrogène et de sodium, (en) sodium mercaptan, (en) sodium mercaptide ((fr) mercapture), sulfure de sodium (Na(HS)), sulfure de sodium (Na(SH)) |
| No CAS | [1],[2] |
| No ECHA | 100.037.056 |
| No CE | 240-778-0 |
| No RTECS | WE1900000 |
| PubChem | 28015 |
| SMILES | |
| InChI | |
| Apparence | hydrate : cristaux déliquescents incolores à jaunes avec une odeur d'œuf pourri (H2S)[1] |
| Propriétés chimiques | |
| Formule | NaHS |
| Masse molaire[5] | 56,063 ± 0,005 g/mol H 1,8 %, Na 41,01 %, S 57,2 %, |
| pKa | 11[1] |
| Propriétés physiques | |
| T° fusion | 350 °C (anhydre)[1] 52 à 54 °C (hydrate)[4] |
| Solubilité | eau : ~500 g·l-1 à 22 °C[1] |
| Masse volumique | 1,79 g·cm-3 à ? °C (dihydrate)[1] |
| Point d’éclair | 90 °C[4] |
| Précautions | |
| SGH[1] | |
   |
|
| Transport[1],[3],[4] | |
| Écotoxicologie | |
| DL50 | 200 mg/kg (souris, s.c.)[2] 18 mg/kg (souris, i.p.)[2] 14 600 ug/kg (rat, i.p.)[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Préparation
La synthèse d'hydrogénosulfure de sodium anhydre en laboratoire habituellement utilisée implique une réaction acido-basique du méthanolate de sodium, NaOMe, avec du sulfure d'hydrogène[6] :
- NaOMe + H2S → NaHS + MeOH.
L'éthanolate de sodium peut être aussi utilisé à la place du méthanolate[7]. Industriellement, l'hydroxyde de sodium, NaOH, est utilisé comme base. La concentration en NaHS peut être dosée par titrage iodométrique, en exploitant la capacité de HS− de réduire I2.
Structure et propriétés
L'hydrogénosulfure de sodium cristallin présente deux transitions de phase. À des températures supérieures à 360 K (87 °C), NaHS adopte une structure cubique du type NaCl, ce qui implique que les HS− se comportent comme des anions sphériques en raison de leur rotation rapide conduisant chaque HS− à une occupation égale de huit positions équivalentes. En dessous de 360 K, une structure rhomboédrique apparaît et HS− donne l'image d'une forme discoïde. En dessous de 114 K (−159 °C), la structure devient monoclinique. Les hydrogénosulfures de potassium et de rubidium adoptent le même comportement[8].
L'hydrogénosulfure de sodium anhydre se présente sous la forme d'une poudre granulaire, cristalline, blanche, très hygroscopique et qui est très soluble dans l'eau et peu dans l'éthanol. Dissous de l'acide chlorhydrique, NaHS développe un vigoureux dégagement de sulfure d'hydrogène, H2S. Le NaHS anhydre a un point de fusion relativement bas à 350 °C. Le trihydrate perd ses molécules d'eau de cristallisation à 22 °C tandis que le dihydrate perd les siennes vers 55 °C. En fondant, NaHS forme un liquide noir[1].
Utilisation
Des milliers de tonnes de NaHS sont produites annuellement. Il est techniquement utilisé dans certains procédés :
- comme agent de flottation pour l'extraction du cuivre où il est utilisé pour activer différents oxydes minéraux ;
- dans la fabrication du papier en tant que substitut du soufre dans le procédé kraft (élimination de la lignine des copeaux de bois) ;
- dans l'industrie du cuir où il sert à éliminer les poils des peaux[1] ;
- comme produit de précipitation des métaux lourds dans les stations d'épuration ;
- réactif pour la production de rayonne (viscose), du sulfate de sodium, de l'acide thioglycolique, de l'acide thiobenzoïque, de la thiourée et de matières colorantes[1].
Dans une variante de la réaction d'Asinger (réaction multi-composés), de l'hydrogénosulfure de sodium réagit avec un α-haloaldéhyde, (R1,R2,R3)CX-CHO, de l'ammoniac, NH3, et un autre composé carbonylé (aldéhyde ou cétone) pour former des 3-thiazolines[9].
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Sodium hydrosulfide » (voir la liste des auteurs) et en allemand « Natriumhydrogensulfid » (voir la liste des auteurs).
- Entrée « Sodium hydrosulfide hydrate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 8/3/2014 (JavaScript nécessaire)
- (en) « Hydrogénosulfure de sodium », sur ChemIDplus.
- Fiche Sigma-Aldrich du composé Sodium hydrosulfide monohydrate, technical, ≥90%, consultée le 8/3/2014.
- Fiche Sigma-Aldrich du composé Sodium hydrosulfide hydrate, consultée le 8/3/2014.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- R. I. Eibeck, Ralph A. Zingaro, Raymond E. McGlothlin, Sodium Hydrogen Sulfide, Inorg. Synth., 1963, Inorganic Syntheses 7, p. 128–31. DOI:10.1002/9780470132388.ch35. (ISBN 978-0-470-13238-8).
- G. Brauer, Handbook of Preparative Inorganic Chemistry, 1963, 2e éd., vol. 1, Academic Press, p. 357–358.
- F. Haarmann, H. Jacobs, E. Roessler, J. Senker, Dynamics of anions and cations in hydrogensulfides of alkali metals (NaHS, KHS, RbHS): A proton nuclear magnetic resonance study, J. Chem. Phys., 2002, vol. 117(3), p. 1269–1276. DOI:10.1063/1.1483860.
- Jürgen Martens, Heribert Offermanns, Paul Scherberich, Facile synthesis of racemic cysteine, Angewandte Chemie International Edition English, 1981, vol. 20 (8), p. 668. DOI:10.1002/anie.198106681.
- Portail de la chimie

