Neutron
Le neutron est une particule subatomique de charge électrique nulle.
Pour les articles homonymes, voir neutron (homonymie).

| Classification |
Particule composite (baryon) |
|---|---|
| Composition | |
| Famille | |
| Groupe | |
| Interaction(s) | |
| Symbole |
n, n0 |
| Antiparticule |
| Masse | |
|---|---|
| Charge électrique |
0 C |
| Moment dipolaire |
< 2,9 × 10−26 e cm |
| Polarisabilité électrique |
1,16(15) × 10−3 fm3 |
| Moment magnétique |
−1,913 042 7(5) μN |
| Polarisabilité magnétique |
3,7(20) × 10−4 fm3 |
| Charge de couleur |
0 |
| Spin |
½ |
| Isospin |
-½ |
| Parité |
+1 |
| Durée de vie |
880,3 ± 1,1 s |
| Forme condensée |
-½ |
| Prédiction |
Ernest Rutherford (1920) |
|---|---|
| Découverte |
1932 |
| Découvreur |
Les neutrons sont présents dans le noyau des atomes, liés avec des protons par l'interaction forte. Alors que le nombre de protons d'un noyau détermine son élément chimique, le nombre de neutrons détermine son isotope. Les neutrons liés dans un noyau atomique sont en général stables mais les neutrons libres sont instables : ils se désintègrent en un peu moins de 15 minutes (880,3 secondes). Les neutrons libres sont produits dans les opérations de fission et de fusion nucléaires.
Le neutron n'est pas une particule élémentaire mais une particule composite composée de l'assemblage de trois composants : un quark up et deux quarks down, liés par des gluons.
Caractéristiques
Description
Le neutron est un fermion de spin ½. Il est composé de trois quarks (deux down et un up), ce qui en fait un baryon de charge électrique nulle. Ses quarks sont liés par l'interaction forte, transmise par des gluons.
La masse du neutron est égale à environ 1,008 665 549 16 u, soit à peu près 939,565 379 MeV/c2[2] ou 1,675 × 10−27 kg[4]. Le neutron est 1,001 4 fois plus massif que le proton. Sa charge électrique est nulle. Tout comme le proton, le neutron est un nucléon, et peut être lié à d'autres nucléons par la force nucléaire à l'intérieur d'un noyau atomique. Le nombre de protons d'un noyau (son numéro atomique, noté Z) détermine les propriétés chimiques de l'atome et donc quel élément chimique il représente ; le nombre de neutrons (usuellement noté N) détermine en revanche l'isotope de cet élément. Le nombre de masse (noté A) est le nombre total de nucléons du noyau : A = Z + N.
Le modèle standard de la physique des particules prédit une légère séparation des charges positive et négative à l'intérieur du neutron, conduisant à un moment dipolaire électrique permanent[5]. La valeur prédite est cependant trop petite pour être mesurée avec les instruments actuels.
Le neutron possède une antiparticule, l'antineutron.
Stabilité
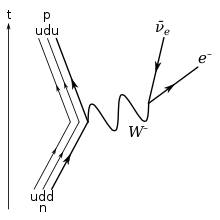
Selon les contraintes du modèle standard de la physique des particules, comme le neutron est composé de trois quarks, son seul mode de désintégration possible (sans modifier le nombre baryonique) suppose le changement de saveur d'un quark, par l'intermédiaire de l'interaction faible. La désintégration d'un quark down, de charge -1/3, en un quark up, de charge +2/3, est réalisée par l'émission d'un boson W− ; de cette façon, le neutron se désintègre en un proton (qui contient un quark down et deux quarks up), un électron et un antineutrino électronique.
- n → p + e− + antineutrino + 782 keV
À l'extérieur d'un noyau atomique, le neutron libre est instable et sa durée de vie moyenne est de 880,3 ± 1,1 s (soit un peu moins de 15 minutes ; la demi-vie correspondante est de 880,3 × ln (2) = 610,2 s, soit un peu plus de 10 minutes)[4]. Il se désintègre suivant le processus décrit ci-dessus. Ce processus, nommé désintégration bêta, peut également transformer un neutron à l'intérieur d'un noyau atomique instable.
Ces durées de vie (moyenne et demi-vie) sont très supérieures aux durées de vie des neutrons observées dans un réacteur nucléaire, ce qui fait que la disparition des neutrons par désintégration peut être négligée dans le bilan neutronique (production/disparition) du réacteur.
À l'intérieur d'un noyau atomique, un proton peut se transformer en neutron par un processus de désintégration bêta inverse. La transformation provoque également l'émission d'un positron (un antiélectron) et d'un neutrino électronique.
- p + 782 keV? → n + positron + neutrino
Dans un noyau atomique, l'instabilité du neutron est contrebalancée par celle qui serait acquise par le noyau dans son ensemble si un proton additionnel participait aux interactions répulsives des autres protons déjà présents. De cette façon, si les neutrons libres sont instables, les neutrons liés ne le sont pas forcément. En astrophysique, on précise que la stabilité du neutron peut être obtenue non plus par l’interaction forte, mais par la gravitation. Une étoile à neutrons est un astre extrêmement dense, dont la composition interne est majoritairement faite de neutrons maintenus ensemble par le très fort champ gravitationnel qu'ils génèrent du fait de leur grand nombre et de leur haute densité. La désintégration du neutron est cette fois rendue impossible par le principe d'exclusion de Pauli qui empêche les électrons ainsi produits de coexister en grand nombre.
Radioactivité
La radioactivité produit des neutrons libres. Ces neutrons peuvent être absorbés par les noyaux d'autres atomes qui peuvent alors devenir instables. Ils peuvent aussi provoquer une fission nucléaire par collision avec un noyau lourd fissile (plutonium 239, uranium 235...).
Le neutron étant globalement neutre, il ne produit pas directement d'ionisations en traversant la matière. En revanche, il peut avoir de nombreuses réactions avec les noyaux des atomes (capture radiative, diffusion inélastique, réactions produisant des particules α ou d'autres neutrons, fission du noyau, etc.), produisant chacune des rayonnements ionisants. À ce titre, les neutrons sont considérés comme un rayonnement ionisant, soit un rayonnement qui produit des ionisations dans la matière qu'il traverse.
Historique
Défauts du modèle proton-électron du noyau
William Draper Harkins est le premier à prédire en 1920 l'existence du neutron[6],[7].
Ayant découvert l'existence du noyau atomique en 1911, Ernest Rutherford émet en 1920 l’hypothèse de l’existence du neutron comme une association proton-électron. James Chadwick, l’assistant de Rutherford et l’un de ses plus brillants disciples, entendit Rutherford, dans le cercle des habitués des Bakerian Lectures de la Royal Society, formuler l’idée d’une sorte d’atome de masse 1 et de charge 0 qui n’était pas l’hydrogène : cet objet n’est pas sujet aux répulsions électriques que subissent les protons et les particules alpha et doit pouvoir s’approcher des noyaux et y pénétrer facilement. Chadwick se souvint douze ans plus tard de cette communication, quand il eut à interpréter les résultats de ses expériences.
Pendant toutes les années 1920, les physiciens supposent que le noyau atomique est composé des protons et électrons nucléaires[8],[9]. Par exemple, le noyau de 14N contenait supposément 14 protons et 7 électrons nucléaires, en plus des 7 électrons orbitaux à l'extérieur du noyau. Cependant des difficultés de ce modèle proton-électron deviennent évidents. Le modèle est difficile à réconcilier avec le principe d'incertitude de Heisenberg. Le paradoxe de Klein, découvert par Oskar Klein en 1928, soulève encore d'autres objections au confinement d'un électron léger à l'intérieur d'un volume aussi petit qu'un noyau.
En plus, les propriétés observées des atomes et des molécules ne sont pas cohérentes avec le spin nucléaire prévu par le modèle proton-électron. Par exemple, si le noyau 14N contenait vraiment un total de 21 particules (protons et électrons), chacun de spin ½ ħ, son spin devrait être un multiple demi-entier de ħ. Cependant les spectres moléculaires de N2 indiquent que le vrai spin de 14N est de 1(ħ), ce qui implique un nombre pair de particules constituantes.
Découverte du neutron
La découverte du neutron a résulté de trois séries d’expériences, faites dans trois pays différents, l’une entraînant l’autre. En ce sens elle est exemplaire de la recherche de la connaissance.
En 1930, en Allemagne, Walther Bothe et Herbert Becker, spécialistes du rayonnement cosmique observent que les éléments légers lithium, béryllium et bore, bombardés par des particules α, émettent des rayons « ultra pénétrants » qu’ils supposent être des rayons gamma beaucoup plus énergiques que ceux émis par des noyaux radioactifs ou accompagnant les transmutations nucléaires.
En 1931, en France, Irène et Frédéric Joliot-Curie intrigués par ces résultats cherchent à comprendre la nature de ce rayonnement et découvrent qu’il a la propriété de mettre en mouvement des noyaux atomiques et en particulier des protons… Ils supposent qu’il s’agit là d’un effet Compton entre des gamma dont ils estiment l’énergie à environ 50 MeV (une énergie très élevée pour l’époque) et de l’hydrogène.
En 1932, en Angleterre, aussitôt ces résultats parus, James Chadwick fait un test confirmant les résultats et va plus loin et mesurant avec précision l’énergie des noyaux projetés en utilisant la réaction nucléaire 4He(α) + 9Be → 12C + 1n, il peut affirmer que le rayonnement « ultra pénétrant » ne peut être un rayonnement gamma, d’énergie très élevée, mais doit être composé de particules de masse 1 et de charge électrique 0 : c’est le neutron.
Chacune des trois équipes avait travaillé avec les appareils dont elle disposait, mais aussi avec ses connaissances et avait baigné dans la tradition de son laboratoire. Il n’est pas étonnant que ce soit au laboratoire de Cambridge, dirigé par Ernest Rutherford que le neutron ait été découvert. Depuis 1920, Rutherford, en effet, avait émis l’hypothèse de l’existence du neutron comme une association proton-électron. Cependant l'explication des propriétés nucléaires oblige de reconnaître que le neutron est plutôt une particule aussi élémentaire que le proton[10].
Werner Heisenberg développe rapidement un modèle proton-neutron du noyau constitué des protons et neutrons, ce qui réussit à expliquer les valeurs observées des spins nucléaires. De plus, en 1934 Enrico Fermi explique la radioactivité β comme la transformation d'un neutron par l'émission d'un électron (créé au moment de son émission) ainsi qu'un neutrino (qui restait encore à découvrir une vingtaine d'années plus tard). Aussi Fermi effectue le bombardement des éléments lourds avec les neutrons afin d'induire la radioactivité aux éléments de numéros atomiques élevés.
En 1935, Chadwick et son étudiant Maurice Goldhaber font la première mesure précise de la masse du neutron. La même année Chadwick gagne le Prix Nobel de physique pour la découverte du neutron. En apprenant cette nouvelle, Rutherford dira, selon Emilio Segrè : « Pour le neutron, c’est Chadwick tout seul. Les Joliot-Curie sont tellement brillants qu’ils le mériteront vite pour quelque chose d’autre ! »
En 1938, Fermi reçoit le prix Nobel en physique pour avoir démontré l'existence de nouveaux éléments radioactifs produits par l'irradiation neutronique, ainsi que pour la découverte des réactions nucléaires induites par des neutrons lents. Cette dernière découverte amène Otto Hahn, Lise Meitner, et Fritz Strassmann à la découverte de la fission nucléaire induite par les neutrons lents.
Ont également étudié les propriétés du neutron : Jean-Louis Destouches[11], Igor Tamm, Franz N. D. Kurie.
Détection
Les particules atomiques et subatomiques sont détectées par la signature qu'elles produisent par interaction avec leur environnement. Ces interactions résultent de leurs caractéristiques fondamentales. Du fait notamment de sa charge globalement nulle, le neutron est généralement détecté par interaction nucléaire, c'est-à-dire par l'utilisation de réactions nucléaires spécifiques.
Applications
Les neutrons sont utilisés pour la diffusion neutronique, processus permettant d'étudier de la matière à l'état condensé. Ce rayonnement pénétrant permet de voir les intérieurs des corps, comme des métaux, des minerais, des fluides et permet d'examiner leur structure à l'échelle atomique par diffraction. Un autre avantage des neutrons réside dans leur sensibilité magnétique due à leur spin, ce qui permet d'étudier la structure magnétique des matériaux. La spectroscopie neutronique permet d'étudier d'une manière unique les excitations des corps, comme les phonons, les vibrations atomiques et les magnons. Les neutrons sont également utilisés pour radiographier des objets spéciaux (éléments pyrotechniques de moteurs fusée par exemple, ou encore barres de combustible irradié). On parle dans ce cas de neutronographie. Dans ces utilisations, le rayonnement neutronique est complémentaire des rayons X.
Les neutrons sont également utilisés pour leur aptitude à provoquer des réactions nucléaires (fissions, capture radiative ou diffusion inélastique). Une application en est le contrôle nucléaire de procédé, qui permet de mesurer quantitativement et qualitativement le contenu de mélanges de matière fissile (uranium, plutonium, actinides mineurs) dans le processus de traitement du combustible usé (usine de La Hague notamment).
Sources
Les sources de neutrons à haut flux sont soit des réacteurs nucléaires destinés à la production de ce rayonnement, soit des sources de spallation, grands accélérateurs de protons qui envoient un faisceau de protons accélérés sur une cible évaporant des neutrons. Typiquement, les sources de neutrons rassemblent un parc d'instrumentation formant de grands centres d'utilisateurs nationaux ou internationaux.
Centres de recherche
- L'ANSTO (en) opère le réacteur historique HIFAR (en) et met en service un des plus modernes centres neutroniques OPAL (en).
Europe :
- L'institut Laue-Langevin est le plus grand centre du monde autour d'un réacteur neutronique.
Notes et références
- Maurice Jacob, Au cœur de la matière : la physique des particules élémentaires, Odile Jacob, , 400 p. (ISBN 978-2-7381-0980-4, lire en ligne), p. 37.
- Eric Simon, « La différence de masse entre proton et neutron obtenue par calcul pour la première fois », sur ca-se-passe-la-haut.fr, (consulté le ).
- CODATA 2010
- (en) [PDF] « The Review of Particle Physics », Particle Data Group,
- (en) « Pear-shaped particles probe big-bang mystery », Université du Sussex,
- (en) « William Draper Harkins | American chemist », Encyclopedia Britannica, mise-à-jour 2018 (lire en ligne, consulté le )
- (en) Patrick Coffey, Cathedrals of Science : The Personalities and Rivalries That Made Modern Chemistry, Oxford University Press, , 400 p. (ISBN 978-0-19-988654-8, lire en ligne)
- (en) Laurie M. Brown, « The idea of the neutrino », Physics Today, vol. 31, no 9, , p. 23 (DOI 10.1063/1.2995181, Bibcode 1978PhT....31i..23B)
- (en)Friedlander G., Kennedy J.W. and Miller J.M. (1964) Nuclear and Radiochemistry (2nd edition), Wiley, p. 22–23 and 38–39
- En effet le proton et le neutron sont considérés comme « particules élémentaires » jusqu'aux années 1960, lorsqu'on admettra que le proton et le neutron sont composés de trois quarks chaque.
- Jean-Louis Destouches État actuel de la théorie du neutron, Paris, 1932
Voir aussi
Articles connexes
Liens externes
- « Neutron : pas si neutre », La Méthode scientifique, France Culture, 16 novembre 2021.
- [PDF] (fr) Élémentaire no 2 (Revue d'information scientifique de l'IN2P3, du LAL, du P2I et du synchrotron SOLEIL sur le neutron).
- [PDF] (en) Caractéristiques du neutron (Particle Data Group)
- (en) Neutronsources.org (Site d'informations sur les sources de neutrons)
- (en) NMI3 - Integrated Infrastructure Initiative of Neutron scattering and Muon Spectroscopy (Projet de la commission européenne)
- Portail de la physique
- Portail des sciences des matériaux
- Portail de la chimie