Nitramide
Le nitramide est un composé chimique de formule H2N–NO2, isomère de l'acide hyponitreux HON=NOH. Les dérivés organiques du nitramide, de la forme R-N(NO2)-R’, où R et R’ peuvent représenter les deux côtés d'un cycle, sont appelés nitramines et constituent notamment une famille de puissants explosifs, à l'image du tétryl, du RDX, du HMX et du CL-20.
| Nitramide | |
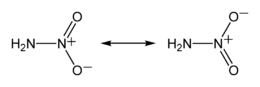 Mésomérie du nitramide |
|
| Identification | |
|---|---|
| No CAS | |
| PubChem | 24534 |
| ChEBI | 29273 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | H2N2O2 [Isomères] |
| Masse molaire[1] | 62,028 1 ± 0,001 1 g/mol H 3,25 %, N 45,16 %, O 51,59 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
La molécule de nitramide serait plane à l'état solide cristallisé mias non plane en phase gazeuse[2].
La synthèse originale de Thiele et Lachman impliquait l'hydrolyse du nitrocarbamate de potassium :
- K2(O2NNCO2) + 2 H2SO4 → H2NNO2 + CO2 + 2 KHSO4.
D'autres voies vers le nitramide passent par l'hydrolyse de l'acide nitrocarbamique :
- O2NNHCOOH → O2NNH2 + CO2,
la réaction du sulfamate de sodium avec l'acide nitrique :
ou encore la réaction du pentoxyde de diazote avec deux équivalents d'ammoniac :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) J.K. Tyler, « Microwave spectrum of nitramide », Journal of Molecular Spectroscopy, vol. 11, nos 1-6, , p. 39-46 (lire en ligne) DOI:10.1016/0022-2852(63)90004-3
- Portail de la chimie