Isotopes de l'oxygène
L'oxygène possède 17 isotopes connus de nombre de masse variant de 12 à 28. Trois d'entre eux sont stables, 16O, 17O et 18O, le premier étant ultra-majoritaire dans la nature (plus de 99,75 % de l'oxygène naturel). On attribue à l'oxygène une masse atomique standard de 15,9994(3) u.
Les 10 autres isotopes sont radioactifs, tous à courte durée de vie, 15O étant celui avec la plus longue demi-vie (122,24 secondes) et 12O celui à la plus courte (580(30)×10−24 seconde).
Histoire des isotopes de l'oxygène
Les premières tentatives de séparation isotopique de 16O et 18O remontent à 1935 quand Harold Clayton Urey a cherché à séparer les différentes formes isotopiques de l'eau avec une colonne de distillation à bande tournante[1].
Parmi les premières utilisations de ces isotopes ont été l'étude des mécanismes en chimie organique, en particulier pour les mécanismes d'estérification et d'hydrolyse.
Isotopes stables
Oxygène naturel
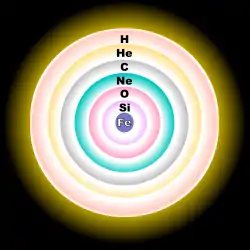
L'oxygène naturel est constitué des trois isotopes stables 16O, 17O et 18O, 16O étant le plus abondant. L'importante abondance relative et absolue de 16O s'explique par le fait qu'il est un produit principal de l'évolution des étoiles ainsi qu'un isotope primaire, c'est-à-dire qu'il peut être produit par des étoiles qui étaient initialement uniquement composées d'hydrogène[2]. La plupart de 16O est synthétisé à la fin du processus de fusion de l'hélium dans les étoiles ; la réaction triple alpha crée du carbone 12 (12C) qui capture un noyau supplémentaire d'hélium 4 (4He) pour produire 16O. La fusion du néon produit aussi 16O[2] . 17O et 18O sont tous les deux des isotopes secondaires, c'est-à-dire que leur nucléosynthèse requiert un « noyau graine ». 17O est principalement produit par la fusion de l'hydrogène en hélium lors du cycle CNO, faisant de lui un isotope commun dans les zones de l'étoile brûlant de l'hydrogène[2]. 18O est lui principalement produit quand 14N (abondant lors du cycle CNO) capture un noyau de 4He (autrement dit, une particule alpha) faisant de 18O un isotope commun dans les zones de l'étoile riches en hélium[2]. Environ un milliard de degrés Celsius sont nécessaires pour que deux noyaux d'oxygène subissent une fusion nucléaire pour former des isotopes plus lourds de soufre[3].
Les molécules d'eau contenant l'isotope le plus léger sont plus susceptibles de s'évaporer et de retomber sous la forme de précipitations[4], ainsi l'eau de glacier et la glace polaire contiennent légèrement moins (0,1981 %) de l'isotope lourd 18O que l'air (0,204 %) ou l'eau de mer (0,1995 %). Cette disparité permet des analyses de températures anciennes via l'étude de carottes de glace ou la détermination d'isoscapes (en) pour le traçage géographique de matériel archéologique[5].
| Isotope | Abondance
(pourcentage molaire) |
Gamme de variations |
|---|---|---|
| 16O | 99,757 (16) % | 99,738 – 99,776 |
| 17O | 0,038 (1) % | 0,037 – 0,04 |
| 18O | 0,205 (14) % | 0,188 – 0,222 |
Oxygène 16
L'oxygène 16 (16O) est l'isotope de l'oxygène dont le noyau est constitué de 8 protons et de 8 neutrons. C'est l'isotope le plus abondant (99,8 %) ce qui fait qu'en pratique, lorsqu'on parle d'oxygène, on parle de cet isotope, en particulier chez les physiciens qui s'y réfèrent systématiquement, alors que les chimistes désignent sous le terme oxygène le mélange d'isotopes naturellement abondant, ce qui menait à des échelles de masse légèrement différentes dans les deux disciplines à l'époque (jusqu'en 1959) où l'unité de masse atomique était définie comme 1⁄16 de la masse d'un atome d'« oxygène ». Cette dualité a disparu en 1959/1960 lorsque l'UICPA et l'UIPPA se sont mises d'accord pour prendre comme unité de masse atomique unifiée, ou dalton, la douzième partie de la masse atomique du carbone 12 (12C)[6].
Oxygène 17
L'oxygène 17 (17O) est l'isotope de l'oxygène dont le noyau est constitué de 8 protons et de 9 neutrons. C'est un isotope peu abondant (0,0373 % dans l'eau de mer, approximativement deux fois plus que le deutérium). Son spin de 5/2+ fait qu'il est le seul isotope stable pouvant être utilisé en études RMN.
Oxygène 18
L'oxygène 18 (18O) est l'isotope de l'oxygène dont le noyau est constitué de 8 protons et de 10 neutrons. C'est un isotope peu abondant (0,204 %). Il est utilisé en radiopharmacologie sous forme d'eau enrichie en espèces H218O pour produire, par bombardement de protons — ions hydrogène H+ — accélérés dans un cyclotron ou dans un accélérateur linéaire, du fluor 18, lequel est, par exemple, utilisé sous forme de fluorodésoxyglucose (18F) (18F-FDG) dans le cadre de la tomographie par émission de positons. En paléoclimatologie, le ratio noté δ18O, correspondant au rapport 18O/16O, permet, relevé dans les carottes de glace en Arctique ou en Antarctique, de déterminer la température des précipitations à travers les âges.
Radioisotopes
14 radioisotopes ont été caractérisés, les plus stables étant 15O avec une demi-vie de 122,24 s et 14O avec une demi-vie de 70,606 s[7]. Tous les autres isotopes ont des demi-vies inférieures à 27 s et la majorité d'entre eux inférieure à 83 millisecondes (ms)[7].
Les isotopes plus légers que les isotopes stables se désintègrent principalement par désintégration β+ en isotopes de l'azote[8],[9],[10], les plus lourds principalement par désintégration β− en isotopes du fluor. Les isotopes à nombre de masse supérieur à 24 (25O, 26O, 27O et 28O) sont au-delà de la limite de stabilité neutron et sont donc particulièrement instables, se désintégrant par émission de neutron en l'isotope avec un neutron de moins, avec une demi-vie de quelques dizaines de nanosecondes.
En est annoncée, par une équipe de l'Université de Washington (États-Unis), la découverte du plus léger isotope de l'oxygène, (11O)[11].
Oxygène 13
L'oxygène 13 (13O) est l'isotope de l'oxygène dont le noyau est constitué de 8 protons et de 5 neutrons. C'est un isotope instable de spin 3/2−. Sa masse atomique est de 13,0248 uma. Il se désintègre en azote 13 par capture électronique avec une demi-vie de 8,58 ms et une énergie de désintégration de 17,765 MeV[12]. Il est produit par désintégration du fluor 14[13].
Oxygène 15
L'oxygène 15 (15O) est l'isotope de l'oxygène dont le noyau est constitué de 8 protons et de 7 neutrons et une masse atomique de 15,0030654 uma. Sa demi-vie est de 122 secondes[14]. Il est fréquemment utilisé en tomographie par émission de positrons.
Table des isotopes
| Symbole de l'isotope |
Z (p) | N (n) | Masse isotopique (u) | Demi-vie | Mode(s) de désintégration[15] |
Isotope(s)-fils[n 1] | Spin nucléaire |
|---|---|---|---|---|---|---|---|
| 12O | 8 | 4 | 12,034405(20) | 580(30)×10−24 s [0,40(25) MeV] |
2p (60,0 %) | 10C | 0+ |
| p (40,0 %) | 11N | ||||||
| 13O | 8 | 5 | 13,024812(10) | 8,58(5) ms | β+ (89,1 %) | 13N | (3/2-) |
| β+, p (10,9 %) | 12C | ||||||
| 14O | 8 | 6 | 14,00859625(12) | 70,598(18) s | β+ | 14N | 0+ |
| 15O | 8 | 7 | 15,0030656(5) | 122,24(16) s | β+ | 15N | 1/2- |
| 16O[n 2] | 8 | 8 | 15,99491461956(16) | Stable | 0+ | ||
| 17O[n 3] | 8 | 9 | 16,99913170(12) | Stable | 5/2+ | ||
| 18O[n 2],[n 4] | 8 | 10 | 17,9991610(7) | Stable | 0+ | ||
| 19O | 8 | 11 | 19,003580(3) | 26,464(9) s | β− | 19F | 5/2+ |
| 20O | 8 | 12 | 20,0040767(12) | 13,51(5) s | β− | 20F | 0+ |
| 21O | 8 | 13 | 21,008656(13) | 3,42(10) s | β− | 21F | (1/2,3/2,5/2)+ |
| 22O | 8 | 14 | 22,00997(6) | 2,25(15) s | β− (78,0 %) | 22F | 0+ |
| β−, n (22,0 %) | 21F | ||||||
| 23O | 8 | 15 | 23,01569(13) | 82(37) ms | β−, n (57,99 %) | 22F | 1/2+# |
| β− (42,0 %) | 21F | ||||||
| 24O | 8 | 16 | 24,02047(25) | 65(5) ms | β−, n (57,99 %) | 23F | 0+ |
| β− (42,01 %) | 24F | ||||||
| 25O | 8 | 17 | 25,02946(28)# | 5,2×10−8s | n | 24O | (3/2+)# |
| 26O | 8 | 18 | 26,03834(28)# | 4,0×10−8 s | β− | 26F | 0+ |
| n | 25O | ||||||
| 27O | 8 | 19 | 27,04826(54)# | < 260 ns | n | 26O | (3/2+)# |
| 28O | 8 | 20 | 28,05781(64)# | < 260 ns | n | 27O | 0+ |
- Isotopes stables en gras.
- Le ratio 16O /18O est utilisé pour déduire des températures anciennes.
- Peut être utilisé pour des études RMN de voies métaboliques.
- Peut être utilisé dans l'étude de certaines voies métaboliques.
Remarques
- La précision de l'abondance isotopique et de la masse atomique est limitée par des variations. Les échelles de variations données sont normalement valables pour tout matériel terrestre normal.
- Les valeurs marquées # ne sont pas purement dérivées des données expérimentales, mais aussi au moins en partie à partir des tendances systématiques. Les spins avec des arguments d'affectation faibles sont entre parenthèses.
- Les incertitudes sont données de façon concise entre parenthèses après la décimale correspondante. Les valeurs d'incertitude dénotent un écart-type, à l'exception de la composition isotopique et de la masse atomique standard de l'IUPAC qui utilisent des incertitudes élargies.
Notes
- Milton H. Wahl and Harold C. Urey (1935). J. Chem. Phys. 3, 411. The Vapor Pressures of the Isotopic Forms of Water. « http://jcp.aip.org/resource/1/jcpsa6/v3/i7/p411_s1 »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
- B. S. Meyer (September 19–21, 2005). « Nucleosynthesis and galactic chemical evolution of the isotopes of oxygen » dans Workgroup on Oxygen in the Earliest Solar System Proceedings of the NASA Cosmochemistry Program and the Lunar and Planetary Institute.
- Emsley, John (2001). "Oxygen". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. pp. 297–304. (ISBN 0-19-850340-7).
- Dansgaard, W (1964) Stable isotopes in precipitation. Tellus 16, 436-468
- (en) Clément Bataille, Klervia Jaouen et al., « Triple sulfur-oxygen-strontium isotopes probabilistic geographic assignment of archaeological remains using a novel sulfur isoscape of western Europe », PLOS One, (lire en ligne), accès libre.
- BIPM, Brochure sur le SI (texte en français) (PDF), annexe 4 (« Notes historiques »), p. 104 (consulté le )
- (en) K. L. Barbalace, « Periodic Table of Elements: O - Oxygen », EnvironmentalChemistry.com (consulté le )
- (en) « NUDAT 13O » (consulté le )
- (en) « NUDAT 14O » (consulté le )
- (en) « NUDAT 15O » (consulté le )
- https://www.futura-sciences.com/sciences/actualites/physique-nouvelle-forme-oxygene-poids-plume-decouverte-75653/
- http://environmentalchemistry.com/yogi/periodic/O-pg2.html
- http://environmentalchemistry.com/yogi/periodic/F-pg2.html#14
- http://medical-dictionary.thefreedictionary.com/oxygen+15
- (en)Universal Nuclide Chart
Références
- Pour la table
- Masse des isotopes depuis :
- (en) G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon, « The NUBASE evaluation of nuclear and decay properties », Nuclear Physics A, vol. 729, , p. 3–128 (DOI 10.1016/j.nuclphysa.2003.11.001, Bibcode 2003NuPhA.729....3A, lire en ligne [archive du ])
- Compositions isotopiques et masses atomiques standards :
- (en) J. R. de Laeter, J. K. Böhlke, P. De Bièvre, H. Hidaka, H. S. Peiser, K. J. R. Rosman and P. D. P. Taylor, « Atomic weights of the elements. Review 2000 (IUPAC Technical Report) », Pure and Applied Chemistry, vol. 75, no 6, , p. 683–800 (DOI 10.1351/pac200375060683, lire en ligne)
- (en) M. E. Wieser, « Atomic weights of the elements 2005 (IUPAC Technical Report) », Pure and Applied Chemistry, vol. 78, no 11, , p. 2051–2066 (DOI 10.1351/pac200678112051, résumé, lire en ligne)
- Demi-vie, spin et données sur les isomères sélectionnés depuis les sources suivantes :
- (en) G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon, « The NUBASE evaluation of nuclear and decay properties », Nuclear Physics A, vol. 729, , p. 3–128 (DOI 10.1016/j.nuclphysa.2003.11.001, Bibcode 2003NuPhA.729....3A, lire en ligne [archive du ])
- (en) National Nuclear Data Center, « NuDat 2.1 database », Brookhaven National Laboratory (consulté en )
- (en) N. E. Holden et D. R. Lide (dir.), CRC Handbook of Chemistry and Physics, CRC Press, , 85e éd., 2712 p. (ISBN 978-0-8493-0485-9, lire en ligne), « Table of the Isotopes », Section 11
- Pour la partie texte
- (en) Gerhard A. Cook, Carol M. Lauer et Clifford A. Hampel (dir.), The Encyclopedia of the Chemical Elements, New York, Reinhold Book Corporation, , 499–512 p., « Oxygen »
- (en) John Emsley, Nature's Building Blocks : An A-Z Guide to the Elements, Oxford, England, UK, Oxford University Press, , 297–304 p. (ISBN 0-19-850340-7, lire en ligne), « Oxygen »
- (en) G. D. Parks et J. W. Mellor, Mellor's Modern Inorganic Chemistry, Londres, Longmans, Green and Co, , 6e éd.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Isotopes of oxygen » (voir la liste des auteurs).
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
- Portail de la physique
- Portail de la chimie