Phosphine
La phosphine[alpha 1], hydrure de phosphore, phosphure d'hydrogène, ou phosphane (nomenclature IUPAC) est un composé inorganique du phosphore et de l'hydrogène, de formule PH3.
| Phosphine | ||
| ||
 | ||
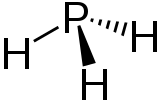
| Structure de la phosphine | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Phosphane | |
| Synonymes |
Phosphine |
|
| No CAS | ||
| No ECHA | 100.029.328 | |
| No CE | 232-260-8 | |
| Apparence | gaz comprimé liquéfié incolore[1]. | |
| Propriétés chimiques | ||
| Formule | PH3 | |
| Masse molaire[2] | 33,997 58 ± 0,000 21 g/mol H 8,89 %, P 91,11 %, |
|
| Moment dipolaire | 0,574 0 ± 0,000 3 D[3] | |
| Propriétés physiques | ||
| T° fusion | −133 °C[1] | |
| T° ébullition | −87,7 °C[1] | |
| Solubilité | dans l'eau à 17 °C : 26 ml/100 ml[1] | |
| Masse volumique | 0,8 g·cm-3[1] | |
| T° d'auto-inflammation | 38 °C[1] | |
| Point d’éclair | Gaz Inflammable[1] | |
| Limites d’explosivité dans l’air | en volume % dans l'air : LIE 1.6-LSE 98 (estimation de l'INRS)[1] | |
| Pression de vapeur saturante | à 20 °C : 4 186 kPa[1] | |
| Point critique | 65,4 bar, 51,35 °C[4] | |
| Thermochimie | ||
| ΔvapH° | 14,6 kJ·mol-1 (1 atm, −87,75 °C)[5] | |
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 9,869 ± 0,002 eV (gaz)[6] | |
| Cristallographie | ||
| Symbole de Pearson | [7] | |
| Classe cristalline ou groupe d’espace | P213 (n°198)[7] | |
| Strukturbericht | D1[7] | |
| Structure type | NH3[7] | |
| Précautions | ||
| SGH[8] | ||
     Danger |
||
| SIMDUT[9] | ||
   A, B1, D1A, |
||
| NFPA 704 | ||
| Transport | ||
| Écotoxicologie | ||
| Seuil de l’odorat | bas : 0,01 ppm haut : 5 ppm[11] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
À température et pression ordinaires, la phosphine est un gaz hautement écotoxique, phytotoxique[12], hautement toxique pour les mammifères (dont l'être humain), et « pour lequel il n'existe pas d'antidote »[13].
La phosphine est utilisée comme pesticide, et serait le plus utilisé dans le monde comme fumigant, bien qu'un nombre croissant de souches d'espèces ciblées y soient devenues résistantes. Selon la base e-phy[12] en 2016, ce produit n'est plus autorisé dans l'agriculture en France.
Description
Il s'agit d'un gaz incolore, légèrement plus lourd que l'air, mortellement toxique et extrêmement inflammable (utilisé pour ces raisons comme agent de fumigation à des fins biocides).
Son point d'ébullition est de −88 °C à 1 atm. Elle est soluble dans l'eau (26 ml/100 ml à 17 °C) et dans différents solvants organiques.
La phosphine pure est inodore, mais la « phosphine technique » a une odeur extrêmement déplaisante évoquant l'ail ou le poisson pourri, à cause de la présence de « phosphine substituée » et de diphosphine (P2H4).
Sa formule est PH3. Elle peut par exemple résulter de l'action d'un acide sur un sel d'aluminium (phosphure d'aluminium) ou de magnésium (phosphure de magnésium) ou tout simplement d'une réaction de ces sels avec l'eau où le sel est hydrolysé.
Exemple : AlP+ 3H2O → PH3 + Al(OH)3
Phosphure d'aluminium + eau → phosphine (gaz) + hydroxyde d'aluminium.
Utilisation
- Armes chimiques (maintenant interdites par un traité international).
- Rodenticide utilisé pour tuer des taupes ou d'autres micromammifères jugés « nuisibles ».
- Dopant dans l'industrie des semi-conducteurs.
- Destruction d'insectes (insecticide) et d'acariens (acaricide) dans les denrées et semences stockées (fûts, silos, cales de bateaux, etc).
- On lui a aussi trouvé dans les années 1980 des propriétés fongicides[14].
Précautions
La phosphine est corrosive pour les métaux et moindrement pour les plastiques (qui ne sont pas attaqués si l'air contient de la phosphine, mais sont totalement déshydratés).
Les sels de phosphure d'aluminium et de tous autres métaux, doivent être placés de telle façon à ce qu'ils n'aient pas accès à de l'humidité ambiante, de l'eau ou un acide.
En tant que biocide, ce produit ne peut être appliqué que par des entreprises et du personnel agréé et en France sous le contrôle des services de la protection des végétaux (SRPV).
En cas d'incendie, le dioxyde de carbone, les mousses, les poudres chimiques ou l'eau pulvérisée peuvent être utilisés comme agent extincteur mais seulement si on est certain de pouvoir stopper l'émission de gaz (extrêmement toxique). Dans le cas contraire, il est recommandé d'écarter tout matériau combustible, d'éloigner les personnes et animaux et de laisser brûler le gaz.
Historique
Au XXe siècle, PH3 a été considéré comme un composé d’origine exclusivement industrielle.
Son existence sur Terre était uniquement attribuée à une origine extraterrestre, comme la schreibersite des météorites (Fe,Ni)3P.
En 1783, dans un mémoire présenté à l'Académie des sciences, le chimiste Philippe Gengembre, élève d'Antoine Lavoisier, isole le PH3, qu'il avait découvert en chauffant du phosphore dans une solution de carbonate de potassium[15].
En 1968, Iverson a détecté du phosphure de fer (Fe2P) biogénique, généré par des processus de corrosion bactérienne du fer. Par la suite, du PH3 naturel gazeux a été mis en évidence parmi les constituants de l’atmosphère des planètes (Jupiter, en 1974, et Saturne, en 1975).
La phosphine n’a pas été détectée sur Terre avant 1988.[réf. nécessaire] Du PH3 sous forme gazeuse ou complexée a par la suite été trouvé dans des sites d’émission de méthane et dans divers environnements tels que les zones humides et marécageuses, les matières en suspension dans l'eau et les sédiments (fluviaux et marins), ainsi que dans certains excréments et le fumier (Gassmann et al., 1996).
Une étude publiée en suggère que la présence de phosphine dans les atmosphères de planètes de type tellurique serait un indicateur prometteur pour la détection d'une possible présence de vie extraterrestre, en l'absence de sources abiotiques connues capables de produire la phosphine en proportions suffisantes pour sa détection par spectroscopie[16]. En , une autre étude annonce que le grand réseau d'antennes millimétrique/submillimétrique de l'Atacama et le James Clerk Maxwell Telescope ont observé la signature de la phosphine dans le spectre de l'atmosphère de Vénus, avec une concentration estimée à environ 20 ppb (parties par milliard)[17]. Mais cette observation est ensuite contestée, notamment en raison d'erreurs de calibration du télescope[18].
Chimie
La phosphine peut être préparée de différentes manières. Industriellement, elle s'obtient par réaction du phosphore et de l'eau en milieu acide ou en voie basique par la réaction du phosphore blanc avec l'hydroxyde de sodium, formant par la même réaction de l'hypophosphite de sodium.
- P4 + 4H2O → H3PO4 + PH3 + H2
ou
- P4 + 3NaOH + 3H2O → 3NaH2PO2 + PH3
Elle peut s'obtenir par hydrolyse d'un phosphure métallique comme le phosphure d'aluminium ou le phosphure de calcium.
La phosphine pure PH3, sans trace de diphosphine P2H4, peut s'obtenir par action de l'hydroxyde de potassium sur l'iodure de phosphonium (PH4I).
On appelle aussi « phosphines » les dérivés de PH3 tels que des dérivés alkylés ou arylés, tout comme les amines sont des dérivés de l'ammoniac.
Toxicologie, écotoxicologie
Mode d'action sur les organismes : Il est systémique mais principalement dû au fait que la phosphine dénature l'oxyhémoglobine et interfère avec la synthèse de protéines et d'enzymes de la respiration cellulaire.
Elle est toxique par inhalation pour le poumon, le foie et les reins. Elle induit également une irritation respiratoire et des signes de dépression du système nerveux central.
Le principal danger pour l'Homme réside en l'inhalation d'une dose dépassant le seuil de toxicité, qui provoque rapidement des troubles neurologiques (coma, convulsions) et cardiaques (foyers de nécrose du myocarde). Le temps de contact a une importance : la mort peut survenir après l'inhalation de 400 ppm durant 30 à 60 minutes ; et des effets graves résulter d'expositions de quelques heures à 5-10 ppm.
Usages en chimie industrielle
Parmi les exemples courants, la triphénylphosphine ((C6H5)3P) et le BINAP, sont tous deux utilisés comme ligands dans des complexes métalliques (catalyseur de Wilkinson).
De telles phosphines sont souvent présentées comme co-catalyseurs dans des réactions telles que le couplage de Sonogashira.
Utilisation comme agent fumigant gazeux biocide
Pour l'utilisation en biocide agricole, on utilise de la phosphine gazeuse pure ou en mélange avec un gaz inerte, dioxyde de carbone ou azote pour supprimer le risque d'inflammabilité ou d'explosivité, des pastilles de phosphure d'aluminium, de calcium ou de zinc qui relâchent de la phosphine au contact de l'eau atmosphérique (ou de l'acide de l'estomac des rongeurs). Ces pastilles contiennent aussi des agents pour réduire le potentiel d'inflammation ou d'explosion de la phosphine produite.
Elle est plus facile d'emploi que le bromure de méthyle, plus efficace (active à des températures de 10 à 15 °C, et pour une durée de 5 à 15 jours alors que le bromure était actif surtout autour à 5 °C et pour 24 h seulement).
À la suite du bannissement progressif du bromure de méthyle (antérieurement le plus utilisé mais toxique, écotoxique, gaz à effet de serre et destructeur de la couche d'ozone, et concerné à ce titre par le cadre du protocole de Montréal), la phosphine est devenue le fumigène le plus utilisé au monde, largement utilisé, économique, et réputé réagir rapidement et sans laisser de résidus sur les produits engrangés (surtout sous sa forme gazeuse, et quand il est correctement utilisé)[19].
Cet usage généralisé et fréquent a favorisé l'apparition de souches de parasites et d'espèces dites nuisibles résistantes à la phosphine, devenues aujourd'hui courantes en Asie, Australie et au Brésil.
De telles résistances sont selon la FAO préoccupantes et probables dans d'autres régions ne faisant pas l'objet d'études.
Réglementation
En France
Selon la base e-phy[12], en 2016, ce produit n'est plus autorisé en France.
Dans ce pays sept spécialités commerciales ont une mise sur le marché autorisée, et des arrêtés imposent une certification pour les applicateurs intervenant dans les opérations de fumigation contre les taupes, avec une formation préalable à renouveler tous les cinq ans (voir ci-dessous).
La commission d'étude de la toxicité a ensuite estimé insuffisantes ces mesures notamment au vu des risques encourus par les utilisateurs et de détournement de produits pour des usages potentiellement malveillants. Le gouvernement a donc décidé d'une professionnalisation obligatoire des opérateurs, des stockages, transport et manipulation sécurisés avec une traçabilité complète des produits[13]. Depuis, seuls les taupiers titulaires d'un certificat de qualification au gazage agréé par la Direction régionale de l'agriculture et de la forêt (DRAF) sont autorisés à utiliser ce produit contre les taupes.
- un arrêté du 4 août 1986, J.O. du , relatif aux conditions d'emploi de certains fumigants en agriculture et dispositions particulières visant le bromure de méthyle, le phosphure d'hydrogène et l'acide cyanhydrique, constitue la charte de la fumigation en France[19].
- un arrêté du relatif aux conditions particulières de délivrance et d'emploi du phosphure d'hydrogène pour la lutte contre la taupe
- un décret 88-448 du , JO du 27/04/1988, relatif à la protection des travailleurs exposés aux gaz destinés aux opérations de fumigation, précise certaines conditions de sécurité[19].
Les teneurs maximales en résidus de phosphure d'hydrogène (PH3) étaient en France en 1986[20] fixées à :
et la concentration en phosphure d'hydrogène dans l'air inhalé par un travailleur ne doit pas dépasser respectivement :
- En tant que polluant diffus, ce produit donne lieu à une écotaxe.
Au Canada
Au Canada, ce produit a été réévalué en 2015 par l'ARLA, Agence de réglementation de la lutte antiparasitaire), avec des précautions renforcées[21]. En effet l'agence de santé canadienne « exige la mise en œuvre de mesures de réduction des risques supplémentaires pour tous les sites fumigés dans le but de limiter le potentiel d'exposition des travailleurs et des particuliers »[21].
Notes et références
Notes
Références
- PHOSPHINE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1420066791), p. 9-50
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « The Ammonia (NH3, D1) Structure », sur cst-www.nrl.navy.mil (consulté le )
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Phosphine » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Entrée du numéro CAS « 7803-51-2 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 novembre 2008 (JavaScript nécessaire)
- « Phosphine », sur hazmap.nlm.nih.gov (consulté le ).
- « e-phy », sur e-phy.agriculture.gouv.fr, Ministère de l'Agriculture (consulté le ).
- Utilisation du PH3 dans la lutte contre les taupes 12e législature Question écrite no 13968 de M. Georges Mouly (Corrèze - RDSE) publiée dans le JO Sénat du 07/10/2004 - page 2262 et réponse du Ministère de l'agriculture et de la pêche publiée dans le JO Sénat du 01/12/2005 - page 3094
- Bailly J.R, Leitao J & Cabrol-Telle A.M (1985) Effet antifongique du phosphure d'hydrogene sur diverses moisissures isolees de produits alimentaires. Sci Aliments, 5, 251-256.
- (de) Gengembre, « Über eine neue Luft, welche man durch die Wirkung von Laugensalzen auf Kunckels Phosphor erhält », In: Crells Chemische Annalen, Band 11, 1789, S. 450–457.
- (en) Clara Sousa-Silva, Sara Seager, Sukrit Ranjan et Janusz Jurand Petkowski, « Phosphine as a Biosignature Gas in Exoplanet Atmospheres », Astrobiology, vol. 20, no 2, , p. 235–268 (ISSN 1531-1074, DOI 10.1089/ast.2018.1954, lire en ligne, consulté le ).
- (en) Jane S. Greaves, Anita M. S. Richards, William Bains et Paul B. Rimmer, « Phosphine gas in the cloud decks of Venus », Nature Astronomy, , p. 1–10 (ISSN 2397-3366, DOI 10.1038/s41550-020-1174-4, lire en ligne, consulté le ).
- (en) Paul Voosen, « Potential signs of life on Venus are fading fast », Science, vol. 370, no 6520, , p. 1021 (DOI 10.1126/science.370.6520.1021).
- Base de documents Désinsectisation des grains par fumigation globale ou localisée à l'hydrogène phospore, FAO
- arrêté du 4 août 1986, J.O. du 22 août, relatif aux conditions d'emploi de certains fumigants en agriculture et dispositions particulières visant le bromure de méthyle, le phosphure d'hydrogène et l'acide cyanhydrique
- Décision de réévaluation RVD2015-03, Phosphure d'aluminium, phosphure de magnésium et phosphine
Voir aussi
Bibliographie
- E. Fluck, The chemistry of phosphine, Topics in Current Chemistry Vol. 35, 64 pp (1973)
- A.D.F. Toy, The Chemistry of Phosphorus, Pergamon Press, Oxford, UK (1973)
- WHO (World Health Organisation), Phosphine and selected metal phosphides, Environmental Health Criteria. Published under the joint sponsorship of UNEP, ILO and WHO, Geneva, Vol. 73, 100 pp (1988)
- FDA factsheet :http://www.epa.gov/opprd001/factsheets/phosphine.pdf
- W.R. Iverson, Nature Vol. 217, p. 1265 (1968)
- G. Gassmann, J.E.E. van Beusekom et D. Glindemann, Offshore atmospheric phosphine, Naturwissenschaften Volume 83 129-131 (1996), doi:10.1007/BF01142178
- Clara Sousa-Silva et al., « Phosphine as a Biosignature Gas in Exoplanet Atmospheres », arxiv, (arXiv 1910.05224)


