Phagothérapie
La phagothérapie est l'utilisation de virus bactériophages (généralement appelés bactériophages ou simplement phages) lytiques afin de traiter certaines maladies infectieuses d’origine bactérienne.
Le traitement bactériophagique a été largement utilisé dans le monde avant la découverte des antibiotiques. Si elle a été progressivement abandonnée par les pays occidentaux séduits par les avantages de l’antibiothérapie, la phagothérapie traditionnelle est toujours employée et développée dans les pays de l'ancienne Union soviétique[1].
Mais depuis les années 1990, l’utilisation des bactériophages est reconsidérée dans de nombreux pays devant le double constat du développement inquiétant des infections nosocomiales à bactéries multirésistantes et de l’absence de nouveaux antibiotiques efficaces. Le début de ce renouveau d'intérêt de l'Occident pour les phages peut être situé en 1994, lorsqu’il a été démontré (dans un modèle animal) que l'utilisation de phages pouvait améliorer le succès des greffes de peau en réduisant l'infection sous-jacente par Pseudomonas aeruginosa. De nombreuses études récentes ont apporté des éléments complémentaires à l'appui de ces résultats[1].
À partir des années 2000, des applications apparaissent non seulement dans le domaine médical, avec le développement accéléré de médicaments bactériophagiques, mais aussi dans les secteurs dentaire, vétérinaire, agricole et environnemental[1].
Des associations et groupements de patients et de médecins militent pour une plus large utilisation en France ou aident les patients à accéder aux traitements bactériophagiques étrangers.
Historique

Découverte
Félix d'Hérelle raconte sa découverte dans son autobiographie[2]. En juillet 1915, d'Hérelle est chargé d'étudier une épidémie de dysenterie qui sévissait sur un escadron de dragons. Il reproduit avec les selles des malades une expérience qu'il avait faite avec des bacilles responsables d'une maladie de sauterelles : il filtre sur bougie de porcelaine une émulsion de selles dysentériques dans du bouillon, ce qui élimine les bacilles dysentériques, puis mélange le filtrat avec une culture de bacilles dysentériques. Après quelques heures d'incubation à 37 °C, il en étale une partie sur la gélose d'une boîte de Petri. À deux reprises, il trouve des taches vierges sur la gélose, comme celles qu'il avait découvertes en cultivant les bactéries des sauterelles. Sans bien comprendre le phénomène des taches vierges, d'Hérelle réussit de temps en temps à le reproduire. Jusqu'à ce qu'il réalise en septembre 1915 que c'est toujours en utilisant le filtrat de la dernière selle avant convalescence naturelle qu'il obtenait des taches vierges.
Jusque-là, il avait cru que la cause de ces taches était liée à la maladie ou en était l'origine, mais il réalise que la cause des taches est peut-être liée au contraire à la guérison. Il décide alors de reproduire quotidiennement l'expérience avec les selles d'une malade, ensemençant chaque jour une culture de bacilles bien trouble avec du filtrat du malade. Le quatrième jour c'est la révélation : alors que la culture témoin est toujours aussi trouble que la veille, la culture trouble ensemencée la veille est d'une limpidité parfaite. En un éclair, rapporte d'Hérelle, il comprit qu'il avait découvert un virus qui détruisait les bactéries et provoquait la guérison. Il courut à l'hôpital et on lui confirma la guérison de la malade.
Un peu plus tard, d'Hérelle propose au Pr Hutinel de l'Hôpital des Enfants Malades de tenter de soigner de jeunes malades. Pour rassurer Hutinel, il commence par avaler lui-même une culture de bactériophage. Les internes puis Hutinel finissent par y goûter aussi. Il traite alors quelques cas graves, toujours en faisant ingérer 2 cm3 de culture de bactériophages aux enfants. À chaque fois, dès le lendemain, les symptômes avaient disparu.
Les premiers traitements de masse eurent lieu au Brésil et en 1925 l'Institut Oswaldo Cruz publia les résultats obtenus sur les 10 000 premiers cas : il n'y eut qu'un insuccès et encore le malade avait finalement guéri[2].
Après la découverte des bactériophages par Félix d'Hérelle en 1917, l’utilisation des phages a été rapidement reconnue par un grand nombre de scientifiques comme étant une voie possible pour combattre les infections bactériennes et le phagothérapie a commencé son développement dans plusieurs pays[3].
En France

Durant l'entre-deux-guerres, d'Hérelle partit étudier les épidémies en Asie et publia en France de nombreux articles et ouvrages scientifiques sur les bactériophages et sur l'utilisation de la phagothérapie qui démontraient son efficacité.
Mais d'Hérelle n'était pas le seul Français à travailler sur la recherche en phagothérapie. À cet égard les Annales de l'Institut Pasteur de mai 1932 publient une recherche des Dr Couvy, Lambert et Dufour sur l'utilisation thérapeutique du bactériophage du bacille de Yersin, cause de la peste bubonique, qui inclut des centaines de cas sur plusieurs années. La conclusion de ces essais thérapeutiques mentionne que « L'action curative d'un pestiphage approprié est incontestable et rapide même dans la peste septicémique ». L'étude se termine par la présentation de 66 des 119 cas de guérisons obtenus en 1931[4].
Après le départ de d'Hérelle de l'Institut Pasteur en 1921, la pratique de la phagothérapie s'est développée en France selon deux axes.

D'une part Félix d'Hérelle ouvrait les Laboratoires du Bactériophage (initialement financés par Robert et Carrière, laboratoire à l'origine de Synthélabo lui-même absorbé en 1998 par Sanofi-Aventis) qui commercialisaient des cocktails phagiques conditionnées sous forme d'ampoules buvables. Les bactériophagiques des Laboratoires du Bactériophage ont été disponibles en France de 1928 jusqu'à la fin des années 1970 et figuraient dans le dictionnaire Vidal jusqu'en 1977, en pages 194 et 195. Comme tout médicament, ils étaient visés par les autorités de santé, avec par exemple le visa 22 SV 1.023 pour le Bacté-pyo-phage. Ils étaient distribués par les pharmacies.
Les produits des Laboratoires du Bactériophage étaient largement employés dès avant la Seconde Guerre mondiale. En 1936 la revue La Médecine publia une monographie de 60 pages sur les applications thérapeutiques et qui s'appuyait sur des centaines de cas traités par phagothérapie dans plusieurs spécialités (dermatologie, chirurgie, urologie...) en utilisant notamment les bactériophagiques des Laboratoires du Bactériophage[5].

Les Laboratoires du Bactériophage ont finalement cessé leur activité au grand dam des médecins de ville qui se retrouvèrent du jour au lendemain sans aucun phagique en pharmacie pour leurs patients. Le Dr Raiga-Clemenceau fit d'ailleurs paraître en 1978 dans Panorama du Médecin une pétition pour alerter les autorités sanitaires, en vain[6].
D'autre part les chercheurs de l'Institut Pasteur continuaient l'étude des bactériophages et de la mise en pratique de la phagothérapie, notamment avec le Dr Eugène Wollman, qui en 1940, crée le Service des Bactériophages de l'Institut Pasteur. Le Dr. Pierre Nicolle, fils du prix Nobel et pasteurien Charles Nicolle, succédera au Dr Wollman à la tête du Service des Bactériophages de l'Institut Pasteur en 1943, après la déportation de Wollman à Auschwitz. Puis ce seront le Dr Léon Le Minor en 1969 assisté de Michel Faguet et le Pr. JF Vieu en 1971. Le Pr JF Vieu était par ailleurs secrétaire général de la Société française de microbiologie. En 1952 se tenait à Royaumont le premier Colloque International sur le Bactériophage sous la houlette de l'Institut Pasteur[7].
Les Instituts Pasteur de Paris puis de Lyon et de Strasbourg constituèrent une collection de phages qui servaient à assembler des cocktails à la demande sur requête des praticiens de ville et des hôpitaux. En 1979 Pierre Nicolle témoigne que « au cours des années 1930 à 1940 la thérapeutique par les bactériophages a connu une période de grands succès, en particulier, comme j'ai pu le constater, lors de mon séjour dans le service du Professeur Gougerot, à l'Hôpital Saint-Louis » et souligne les résultats « parfois même spectaculaires ». Il retient de surprenants résultats obtenus en utilisant comme méthode d'administration une « perfusion très lente (plusieurs heures) du bactériophage spécifique de l'agent infectieux fortement dilué » par voie intra-veineuse. À cette époque le service répond à l'appel de nombreux médecins en préparant des bactériophages thérapeutiques, exclusivement par adaptation aux souches des malades[8]. Cette activité s'est maintenue jusqu'à la fin des années 1980 et en 1988 l'Institut Pasteur de Lyon obtenait de l'Académie de Médecine un avis favorable à la demande des pharmaciens de cet institut d'en renouveler l'autorisation qui avait été accordée dans le passé () à M. le Pr A. Bertoye, qui, parti à la retraite, avait été remplacé dans cette activité par Mlle le Dr F. Guillermet. À l'époque de cette demande de renouvellement, l'activité de l'Institut Pasteur de Lyon en la matière s'était réduite à la fabrication d'une cinquantaine de cocktails bactériophagiques par an à destination des hôpitaux du sud-est de la France[9].
Après la double disparition des bactériophages en France avec la fermeture des Laboratoires du bactériophage en 1978 et la cessation de l'activité de bactériophages thérapeutiques à l'Institut Pasteur vers 1990, quelques médecins français, tels le Dr Paul-Hervé Riche à Montpellier, continuèrent à dispenser des traitements bactériophagiques en utilisant des produits russes et géorgiens[10]. En 2012 les Dr Olivier Patey et Alain Dublanchet firent savoir publiquement les résultats obtenus à l'hôpital de Villeneuve Saint Georges, mais ils durent arrêter cette thérapeutique sous la pression des autorités de santé françaises et de la Commission Européenne qui impose pour les bactériophages la réglementation des médicaments[11]. Le Dr Dublanchet explique en effet : « Nous avons subi très clairement des pressions et nous sommes amenés à refuser des demandes précises de patients qui sont décédés d'infections que nous savons très bien guérir[12]. » De son côté le Dr Jérôme Larché de Montpellier témoigne lors du 20e Evergreen Phage Meeting à Olympia aux États-Unis avoir fait deux requêtes successives en 2012 auprès de l'ANSM pour pouvoir utiliser des phages étrangers, toutes deux refusées, ce qui a conduit au décès du patient[13]. En 2013 le Dr Riche publie un Manuel de phagothérapie pratique à l'usage des médecins du XXIe siècle afin de transmettre l'héritage de son expérience et des enseignements reçus du Dr Raiga-Clémenceau[10].
En raison de l'augmentation de la résistance aux antibiotiques et des progrès de la connaissance scientifique, un renouveau d'intérêt se fait jour à l'échelle mondiale concernant la capacité de la phagothérapie d'éradiquer et de prévenir les infections bactériennes en association avec d'autres stratégies[14]. Sous la pression des associations de patients (Phages sans Frontières, AVIBEP, Vaincre la Mucoviscidose, Le Lien), de médecins (Phag Espoirs) et de la Société de pathologie infectieuse de langue française (SPILF), l'ANSM assouplit sa position en 2019 et autorise les traitements compassionnels au cas par cas avec des bactériophagiques étrangers dans un cadre compassionnel hors de la procédure habituelle des ATUn mais le nombre de patients traités reste anecdotique[15]. En juin 2022, l'ANSM permet l'accès aux traitements bactériophagiques au travers du système E-Saturne, portail de l'accès compassionnel pour les médecins hospitaliers, mais en le restreignant à deux bactériophagiques destinés aux infections ostéo-articulaires par Staphyloccoque Doré[16].
Hors de France
Après la guerre de 14, Behring en Allemagne, ainsi que de grands laboratoires américains tels que Parke-Davis, Abbott, Squibb, Eli Lilly ont produit et distribué des bactériophagiques[17],[18] mais cela n'a duré que quelques années, la phagothérapie étant disqualifiée par deux revues successives de la littérature médicale américaine, réalisées par Eaton et Bayne-Jones. Ces revues défendaient des hypothèses qui se sont révélées plus tard erronées, telles que de nier la nature virale du principe bactériophage, mais le mal était fait et la phagothérapie fut discréditée, malgré les critiques de d'Hérelle concernant la mauvaise qualité des phagiques américains et leur mauvaise utilisation[19],[20],[21]. Dans ces pays les antibiotiques prirent rapidement le relais après la seconde guerre mondiale.
Cependant, outre Félix d’Hérelle qui n’a cessé de propager la phagothérapie et la phagoprophylaxie à travers le monde, le Géorgien George Eliava (en)[22], qui avait travaillé à l'Institut Pasteur de Paris (en 1918, 1921 et 1926) avec Félix d'Hérelle, fonda en 1923 à Tbilissi (Géorgie) un institut de virologie[23], l'Institut Georges Eliava, qui existe encore aujourd'hui. C’est ensemble, dans des locaux adaptés, que d'Hérelle et Eliava ont développé à partir de 1930 l’étude des bactériophages et l’application de la phagothérapie pour l’ensemble de l’Union soviétique.
L’Institut George Eliava en Géorgie a ainsi rassemblé une grande collection de bactériophages thérapeutiques[24]. Les phagothérapeutes géorgiens ont accumulé quatre-vingt-dix ans d'expérience clinique dans ce domaine. Ils reçoivent maintenant des patients du monde entier.
En URSS la phagothérapie se développa avec des hauts et des bas non seulement en Géorgie mais aussi à Moscou, à Leningrad, où elle fut employée durant la Seconde Guerre mondiale, et à Kharkov[25].
En Russie et dans toute la zone d'influence russe, le groupe russe Microgen commercialise une large gamme de préparations bactériophagiques sous forme de cocktails disponibles en pharmacie sans ordonnance. Ces cocktails bactériophagiques sont mis à jour chaque année avec les nouveaux germes prévalents dans les infections. Plus d'un milliard de boîtes sont consommées chaque année en Russie[26],[27]. La Phagothérapie y est utilisée en libéral et à l'hôpital.
En Pologne, un institut d’immunologie et de thérapie expérimentale à Wrocław (Instytut Immunologii i Terapii Doświadczalnej PAN im. Ludwika Hirszfelda we Wrocławiu) a également poursuivi, depuis 1952, jusqu’à nos jours l’utilisation de la phagothérapie. Moins ouvert sur le monde extérieur que l’Institut Eliava, il n’en a pas moins publié un bilan dans une série d’articles rédigés en anglais[28],[29],[30].
Au Canada, le Centre de référence pour virus bactériens Félix d'Hérelle de l'Université Laval a conservé une banque de phages mais n'organise pas de traitement[31].
En Belgique une réglementation spéciale a été adoptée, permettant d'utiliser les bactériophages dans le cadre d'une préparation pharmaceutique magistrale et depuis 2007 l'hôpital militaire de la Reine Astrid accepte des patients dans un service spécialisé sur la phagothérapie[32].
Depuis les années 1970 le nombre de publications scientifiques concernant l'utilisation des bactériophages pour la médecine, mais aussi par l'agriculture et le secteur de l'eau a augmenté exponentiellement, passant de quelques articles à environ 15 000 (de 1970 à 2018) ; à un rythme parallèle à celui des séquencages de phages (passé de 0 à 25 000 sur la même période d'un demi-siècle)[33].
Devant l'absence de solution par le circuit classique de soins, des organisations de patients ont été créées en France pour faciliter l'accès à la phagothérapie[34],[35],[36].
Particularité des bactériophages
Les bactériophages présentent plusieurs particularités qui conditionnent la phagothérapie.
Activité spécifique
Les bactériophages ont une activité beaucoup plus spécifique que la plupart des médicaments tels que les antibiotiques. Un phage lytique ne détruira qu’une seule souche bactérienne, voire plusieurs souches d’une espèce donnée (Staphylococcus aureus, par exemple), beaucoup plus rarement toutes les espèces des souches appartenant à un genre (Staphylococcus). C’est cette sélectivité de son « hôte », la bactérie, qui est utilisée en épidémiologie pour réaliser un test appelé « lysotypie ». Par conséquent, plus impérativement qu’avec les antibiotiques dont certains ont un spectre très large, la spécificité des phages impose que l’on connaisse précisément la bactérie responsable de l’infection avant de les appliquer dans un traitement. Il est donc nécessaire de prélever, pour les analyser, des échantillons biologiques chez le malade infecté de manière à cultiver et identifier la ou les bactéries responsables de l'infection. Secondairement, il est essentiel de disposer d’un ou plusieurs phages appropriés capables de lyser la ou les bactéries qui sont à l’origine de l’infection.
La technique d’étude de l’activité d’un ensemble de plusieurs bactériophages sur une bactérie est assez comparable à celle qui permet de vérifier l’activité des antibiotiques et que l’on appelle antibiogramme. On vérifie quels sont les bactériophages testés qui empêchent la croissance de la bactérie.
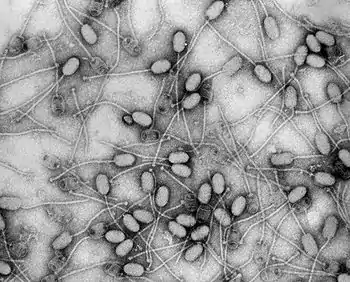
(coloration : acétate d'uranyl ; grossissement : x92 400)
À défaut de satisfaire à ces exigences (absence de bactérie isolée, urgence à commencer un traitement), une option consiste à utiliser des préparations de mélanges polyvalents (ou « cocktails ») de phages afin d'augmenter les probabilités de succès.
Aspects éco-évolutifs
La phagothérapie a beaucoup de points communs avec la lutte biologique, car elle consiste à utiliser un organisme (le phage) pour contrer une peste. Les connaissances de dynamique des populations sont donc essentielles pour mettre au point des thérapies efficaces et durables[37]. Un second paramètre essentiel est la dynamique évolutive[38]. Non seulement les populations bactériennes peuvent évoluer pour devenir résistantes à l'infection par certains phages, mais les phages aussi peuvent évoluer. La phagothérapie engendre donc un processus coévolutif entre virus et bactéries.
Essais cliniques à l'étranger et en France
En 2007, des essais cliniques de phase 2a[39] ont fait l'objet de rapports à l'Hôpital Royal National d'Otorhinolaryngologie de Londres concernant des infections par Pseudomonas aeruginosa (otites). La documentation relative à l'étude de phase 1 et de phase 2a n'est pas disponible actuellement. Des essais cliniques de phase 1 sont en cours au Centre régional de Traitement des Blessures à Lubbock (Texas), concernant un cocktail bactériophagique homologué orienté en particulier vers Pseudomonas aeruginosa, Staphylococcus aureus et Escherichia coli[40]. D’autres essais sont en cours en Inde, en Europe, etc.[41].
En 2012, la Direction Générale de l’Armement, accepte de financer un projet de recherche pour évaluer l’intérêt des bactériophages contre les brûlures infectées résistantes aux antibiotiques. Un laboratoire a reçu à cet effet un financement de 900 000 euros. « Le projet vise à explorer la place et le potentiel des bactériophages comme moyen de lutte contre les infections bactériennes, en particulier contre les bactéries multirésistantes aux antibiotiques. Il s’agit également de promouvoir l’utilisation des phages comme solution de rechange et complément crédible aux antibiotiques[42]. »
En 2016, dans le Biotechnology Journal, un article[43] réfléchit au chemin à suivre pour une utilisation généralisée des bactériophages. Il identifie les causes des délais dans l'acceptation et l'utilisation des bactériophages comme étant à la fois scientifiques (manque d'essais cliniques aux normes occidentales), réglementaires (la force des phages réside dans leur adaptabilité et leur multiplicité lesquelles s'opposent aux réglementations qui demandent un produit stable et unique), financières (difficulté de déposer des brevets pour des organismes vivants) et éducatives (manque d'information du milieu médical et crainte du public envers les virus). L'article propose enfin un ensemble de standards de qualité pour la production future de bactériophages[43].
En 2013, le Ministère de la Défense français coordonne un consortium européen dans le cadre d'un projet de recherche du 7e PCRDT, financé par l'Union européenne, portant sur des essais cliniques de phase I et II. Le projet consiste à évaluer la phagothérapie, c’est-à-dire l’usage thérapeutique des bactériophages, prédateurs naturels destructeurs de bactéries, pour traiter les infections cutanées provoquées par les bactéries Escherichia coli et Pseudomonas aeruginosa chez les patients brûlés[44],[45].
En 2019, les résultats d'un essai en phase 2[46], randomisé, montrent que le traitement peut être efficace et bien toléré (par rapport à une crème contenant une émulsion de sulfadiazine à 1 % d'argent mais que certaines bactéries se montrent également résistantes aux faibles doses de phages qui ont été utilisées dans ce cas. Les effets de concentrations plus élevées en phages et des phagogrammes accrus, dans un panel de participants plus large sont encore nécessaires selon les auteurs[46].
Deux programmes de recherche sont également financés à l’Institut Pasteur en collaboration avec l’association Phagespoirs. Les deux concernent les infections à Pseudomonas aeruginosa multirésistantes : chez les personnes atteintes de mucoviscidose, « MucoPhage », et dans les services de réanimation, « RéapyoPhage ». Phagespoirs, à l’initiative de ces projets, est une association loi de 1901 visant à promouvoir d’une part la recherche et l’utilisation des bactériophages dans le domaine diagnostique et thérapeutique, et d’autre part visant à soutenir les patients désirant en savoir davantage sur les bactériophages.
Production
Les bactéries d'une même espèce peuvent présenter de nombreuses différences d'une région (ou collectivité médicale) à l'autre ou même dans une même région d’un moment à l’autre, ou encore d'une personne à l’autre en fonction de son histoire médicale. Dans ces conditions, la formulation de préparations bactériophagiques normalisées stables est difficilement envisageable. L’ubiquité des phages dans la nature pose des problèmes particuliers pour la protection des droits car il est impossible de faire la différence entre les phages trouvés dans l’environnement et ceux qui sont contenus dans les ampoules du commerce (qui en proviennent d’ailleurs).
Deux voies sont utilisées :
Production industrielle à grande échelle
La stratégie actuelle des producteurs identifiés[réf. souhaitée] est d’élaborer des cocktails polyphagiques à large spectre d’hôtes. C’est ce que proposent les producteurs des pays de l’Est pour le traitement d’une pathologie donnée. En Russie la production se fait à grande échelle avec une consommation de plus d'un milliard de boîtes de phagiques par an[47].
Le dépôt de brevets (visant des organismes vivants) pourrait être envisagé après modification génétique par celui qui souhaiterait avoir des droits exclusifs sur son « invention ». À l'inverse, les phages prélevés dans la nature ne sont pas brevetables. Cela ne pousse pas à l’investissement de capitaux pour cette production ni à la commercialisation par une personne morale (laboratoire pharmaceutique). Cependant, la technique issue de Crispr semble, au moins in vitro, la technique de choix pour utiliser les phages pour lutter contre l'antibiorésistance[48]. Le passage in vivo pourra se faire dans la mesure où le passage à travers des biofilms bactériens sera maîtrisé (Préparation bactériophagique).
Production individuelle à la demande
Par ailleurs, en raison de la spécificité des phages individuels et afin d'augmenter les chances de succès, c'est souvent un mélange de phages qui est appliqué. Cela implique que des banques contenant de nombreux phages différents doivent exister et doivent régulièrement mettre à jour leurs stocks avec de nouveaux phages, ce qui rend les essais réglementaires de sécurité difficiles et coûteux, et finalement impossibles dans la pratique avec la réglementation actuelle qui exige des essais cliniques pour une production industrielle.[réf. nécessaire]
Par contre, aux termes de l'article L.5121-1 du code de la santé publique, rien ne s'oppose à la réalisation extemporanée de préparations bactériophagiques magistrales par des pharmaciens, au cas par cas sur ordonnance. En Belgique, il a même été précisé que des bactériophages peuvent être utilisés par un pharmacien en tant que principe actif pharmaceutique d'une préparation magistrale bactériophagique réalisée en pharmacie sous certaines conditions[49].
Pratique de la phagothérapie : produits, administration, et indications
Les phages ayant une étroite spécificité avec leur hôte (bactério-spécifiques), il est nécessaire, le plus souvent, de réaliser un prélèvement sur le patient et de le cultiver avant traitement. L'isolement de phages thérapeutiques peut cependant nécessiter plusieurs jours voire semaines de travail. La conservation par les laboratoires de collections d’échantillons des bactériophages correspondant aux souches bactériennes les plus courantes localement (phagothèques) permet de raccourcir ce délai.
Phagogramme
La manière traditionnelle développée par Félix d'Hérelle pour mesurer l'action des bactériophages sur des bactéries est de procéder à une culture de bactérie sur plaque de gélose, puis d'y déposer des gouttes de différentes concentrations d'une solution contenant le phage à tester et réputée active. Après quelques heures on remarque l'apparition de taches claires dans les couches de bactéries (plage de lyse), là où les concentrations de phages les plus grandes ont été déposées. Plus les taches claires sont étendues et moins la concentration de phages déposés est importante, plus le phage est actif. La rapidité de l'apparition des taches peut aussi être relevée. Si le phage est inactif ou si la concentration est insuffisante, aucune tache n'apparaît. On utilise en général 5 gouttes diluées chacune dix fois plus que la précédente[1].
Formes galéniques (présentations)
Les bactériophages, comme beaucoup de virus, ne sont pas fragiles. Ils supportent la dessiccation, le froid. Ils peuvent être conservés à 4 °C (réfrigérateur) plusieurs mois, voire plusieurs années. Les notices du fabricant russe Microgen mentionnent qu'ils peuvent être transportés à une température de 9 à 25 °C pendant 1 mois maximum. Congelés, ils se conservent encore plus longtemps, presque indéfiniment. Les principales conditions physico-chimiques hostiles sont la chaleur (au-dessus de 55 °C), l’acidité et la lumière. Les phages sont altérés progressivement, mais certaines substances comme les antiseptiques peuvent les détruire rapidement. La forme liquide (suspension) est la plus fréquente. Les flacons ou ampoules sont habituellement conservés au réfrigérateur.
La lyophilisation permet de fabriquer des comprimés sans que l'efficacité soit diminuée.
Il est aussi envisageable (et envisagé[réf. souhaitée]) d’imprégner des matériels médicaux (sondes, sutures, cathéters), de décontaminer des locaux (services d’hospitalisation, blocs opératoires) et même les personnes : le nez des chirurgiens, la peau des opérés, les porteurs sains…
Modes d’administration
En pratique, l’administration thérapeutique se fait par voie orale, ou localement sur des blessures infectées (plaie, brûlure, fracture) par irrigation ou dispersion en surface, ou encore lors de procédures chirurgicales en introduction par un drain laissé en place après une intervention. L'application locale utilise aussi souvent des gazes ou des mèches imprégnées puis appliquées sur la zone à traiter après élimination du pus et des débris tissulaires en évitant les antiseptiques. La nébulisation est aussi envisageable pour les formes pulmonaires, les instillations pour les infections ORL et des yeux.[réf. nécessaire]
L'injection intraveineuse était courante lors de l'âge d'or de la phagothérapie. En 1979 le Pr Pierre Nicolle, après vingt ans d'expérience de phagothérapie en tant que Chef du Service des Bactériophages à l'Institut Pasteur, retient les résultats surprenants d'une perfusion très lente (plusieurs heures) du bactériophage spécifique de l'agent infectieux fortement dilué par voie intra-veineuse[8].
Actuellement l'injection par voie intraveineuse ou dans des cavités comme le péritoine (intra-péritonéale), demeure possible, mais l'expérience s'en est perdue. Elle est rarement utilisée de crainte que les préparations récentes puissent contenir des substances indésirables (lysat bactérien, composants du milieu de culture) introduites lors de l'amplification bactérienne. Il faut aussi tenir compte de la réaction du système immunitaire qui pourrait reconnaître ces substances et les virus introduits comme des substances étrangères.
Toutefois, les preuves expérimentales s'accumulent pour démontrer que les phages ont la capacité de diffuser dans un organisme. Ils traversent la barrière méningée afin de combattre des pathologies telles que les méningites bactériennes ou vont détruire in vivo certaines bactéries comme Klebsiella pneumoniae par injection de phages à distance du foyer, par voie intra-péritonéale, intraveineuse ou intranasale[50].
Par voie orale, pour préserver les phages lors de leur passage par l'estomac, il est préférable d’administrer un anti-acide (tel que le bicarbonate de soude, les eaux de Vichy).[réf. nécessaire]
Les notices des fabricants indiquent la voie orale comme voie d'administration principale ou en complément dans tout un tas d'infections, y compris urinaires ou locales[51].
Indications
La phagothérapie a été appliquée pour le traitement de diverses maladies infectieuses, dans les spécialités médicales suivantes :
- ORL : laryngite, sinusite, otite[52] ;
- stomatologie : parodontite, gingivite[53]
- ophtalmologie : conjonctivite[54],[55] ;
- dermatologie : dermatite, brûlures, ulcères[52] ;
- gastro-entérologie : troubles diarrhéiques dus à E. coli, Shigella (dysenterie) ou Vibrio (choléra)[52] ;
- pneumologie : pleurésies purulentes, surinfection en cas de mucoviscidose[52] ;
- urologie : infection urinaire, cystite, prostatique, aspermie[56],[50] ;
- chirurgie (toutes spécialités) : infections diverses provoquées par des pathogènes facultatifs de la peau comme les staphylocoques et les streptocoques[52].
Le Dr Alain Dublanchet, l'un des pionniers de la réintroduction de cette thérapie en France, déclarait le lors d'un colloque à Paris : « La phagothérapie pourrait être utilisée dans les infections qui touchent les os et les articulations, mais également dans d'autres infections, urinaires, pulmonaires, oculaires[57]. »
Phagoprophylaxie
« Prophylaxie médicale » désigne tout processus qui prévient l'apparition ou la propagation d'une maladie. La phagoprophylaxie est l'utilisation de bactériophages (ou phages) lytiques afin d'éviter l’apparition de certaines maladies infectieuses bactériennes. L’idée n’est pas nouvelle puisqu’elle a été utilisée il y a très longtemps pour enrayer certaines épidémies, dont celle du choléra en Inde (dans le cadre plus général du biocontrôle[58]). L'universitaire indien Shah M. Faruque (en) a d'ailleurs montré qu'une épidémie de choléra apparaissait à la suite d'un déséquilibre entre populations bactériennes (Vibrio cholerae) et populations de phages spécifiques[59].
Efficacité
L'efficacité de la phagothérapie lors de ses premières années de mise en œuvre par Félix d'Hérelle n'était guère contestée[17]. Après la guerre, Pasteur et Robert et Carrière en France, Behring en Allemagne, ainsi que de grands laboratoires américains tels que Parke-Davis, Abbott, Squibb, Eli Lilly[17],[18] se sont mis eux aussi à assembler et commercialiser des cocktails bactériophagiques, tandis qu'en Géorgie soviétique l'Institut des Bactériophages en assurait le développement et qu'en France d'Hérelle ouvrait ses Laboratoires du Bactériophage. D'Hérelle publiait parallèlement de nombreux ouvrages scientifiques sur les bactériophages et sur l'utilisation de la phagothérapie qui démontraient son efficacité.
Mais d'Hérelle n'était pas seul à démontrer l'efficacité de la phagothérapie. À cet égard les Annales de l'Institut Pasteur de mai 1932 publient une recherche sur l'utilisation thérapeutique du bactériophage du bacille de Yersin, cause de la peste bubonique. Après avoir rappelé les résultats discordants des études sur l'utilisation de la phagothérapie pour soigner les pestiférés, les auteurs publient une recherche documentée sur 4 phages et leur utilisation thérapeutique sur des malades atteints par différentes souches de bacille pesteux. Cette étude inclut des centaines de cas sur plusieurs années. La conclusion mentionne que « L'action curative d'un pestiphage approprié est incontestable et rapide même dans la peste septicémique ». L'étude se termine par la présentation de 66 des 119 cas de guérisons obtenus en 1931[4].
En 1938 survint une épidémie de Choléra en Afghanistan près de la frontière soviétique. Pour éviter que l'épidémie ne se développe en URSS, des cocktails de phages furent distribués aux populations locales et déversés dans les puits et autres sources d'eau. Il en résulta que pas un cas de choléra ne fut observé en URSS. De même lors de la guerre Russo-Finlandaise de 1939-1940, il fut constaté que les bactériophages utilisés dans les premières heures sur la blessure infectée pouvaient stériliser la plaie chez 30 % à 40 % des patients et permettre de refermer la plaie par chirurgie une semaine plus tôt. Enfin lors de la bataille de Stalingrad, le choléra fut combattu avec succès grâce aux bactériophages[47].
Les troupes allemandes n'étaient pas en reste et les unités de l'Afrika Korps de Rommel étaient munies de cocktails bactériophagiques à utiliser pour les situations d'urgence sur la ligne de front[60]. Les Japonais les utilisèrent aussi pendant la Seconde Guerre Mondiale[61].
Malgré ces bons débuts, l'efficacité des bactériophages fut mise en doute par manque d'études cliniques incluant des placebo. Devant la controverse naissante, le Council on Pharmacy and Chemistry of the American Medical Association fit faire en 1934 une revue de la littérature médicale, réalisée par Eaton et Bayne-Jones. La conclusion était défavorable à la phagothérapie et le rapport reprochait à d'Hérelle de prétendre que les principes impliqués dans la phagothérapie étaient des virus et non pas des enzymes. 7 ans plus tard, Albert Krueger and Jane Scribner firent un rapport complémentaire justifié par l'accumulation de nouvelles données sur les phages et sur leur utilité clinique. Leur conclusion était que les phages étaient une protéine de haut poids moléculaire formée à partir d'un précurseur originaire de la bactérie, ce qui avait été soutenu dès les années 1920 par le prix Nobel français Jules Bordet[19], et non pas des virus comme le soutenait d'Hérelle depuis 1917. Surtout il leur paraissait évident que les solutions de phages ne possèdent aucun degré mesurable de supériorité par rapport aux préparations bien connues et acceptées. Enfin, en 1945, un dernier rapport de Morton HE et Engley FB Jr., bien que reconnaissant cette fois-ci la nature virale des phages, se montrait dubitatif sur les résultats thérapeutiques. Après ces rapports les recherches cessèrent aux États-Unis et la phagothérapie disparut peu à peu d'autant que les antibiotiques prenaient le relais[20].
Plusieurs raisons expliquent le manque de résultat thérapeutique convaincant dont témoignent ces rapports. D'une part la mauvaise qualité des bactériophagiques: dans les années 1930 d'Hérelle et ses collègues analysèrent de nombreux bactériophagiques et la plupart, sinon tous, ne contenaient aucun bactériophage actif. Ce manque de qualité était imputable à la purification insuffisante du cocktail de tout débris bactérien, aux contaminants chimiques, aux conservateurs employés (phénol, merthiolate)[21]. D'autre part la mauvaise compréhension de ce qu'est un bactériophage et de ce qu'il peut traiter: par exemple les Medical Biological Laboratories de Londres commercialisaient un bactériophagique pouvant soi-disant soigner l'Herpès (maladie virale), l'urticaire (facteur immunitaire) et les calculs biliaires[62].
D'autres raisons semblent avoir aussi remis en cause la croyance en l'efficacité de la phagothérapie. Autodidacte, d'Hérelle n'était pas toujours considéré comme un scientifique sérieux par ses pairs, bien qu'il ait posé les bases de ce qui deviendra la biologie moléculaire, et qu'il ait initié des méthodologies de laboratoire toujours appliquées de nos jours en virologie[17]. Par ailleurs les théories originales de d'Hérelle lui valurent de nombreux ennemis dans le monde médical, particulièrement chez les immunologistes. Pour d'Hérelle, l'immunité loin d'être la cause de la guérison en était la conséquence. De plus l'utilisation des bactériophages à des fins thérapeutiques pouvait remettre en cause certaines pratiques, telles que l'isolation des malades. En effet, d'Hérelle note qu'avec les phages : « Si la maladie est contagieuse, la guérison l'est aussi ; si tout malade est un centre d'infection, tout convalescent est un centre de guérison »[17],[63]. Enfin la phagothérapie fut rapidement perçue comme une médecine soviétique, sans valeur comparée aux antibiotiques occidentaux[17],[21].
La phagothérapie ayant été abandonnée en Occident, sauf par quelques rares médecins, et ayant de ce fait progressivement perdu son statut de médecine officielle puis sombré dans l'oubli, la plupart des études scientifiques récentes sur son efficacité viennent soit de Russie, soit de Pologne ou de Géorgie.
Ces études n'ont généralement pas été conduites sous le standard occidental du double aveugle où ni le patient ni le médecin prescripteur ne savent si le patient a reçu le bactériophagique ou bien un placebo. Une des raisons en est que lorsqu'un patient risque l'amputation ou la mort, et que la phagothérapie est la seule solution, il est difficilement concevable de lui expliquer qu'on va peut-être juste lui donner un placebo. Les études évaluent donc généralement le taux de succès de la phagothérapie en % de patients guéris[27].
Toutefois les médecins occidentaux contemporains défenseurs de la phagothérapie qui l'ont utilisée, par exemple dans le cadre hospitalier, témoignent de son efficacité, au moins dans les cas désespérés où ils l'ont employée. Le Manuel de phagothérapie à l'usage des médecins du XXIe siècle du Dr Paul Hervé Riche[10] mentionne de nombreux cas, de même le Dr Patey dans sa présentation de 2017 à l'Observatoire des Médicaments, Dispositifs Médicaux et Innovations Thérapeutiques[61] ou le Dr Alain Dublanchet dans La phagothérapie au XXIe siècle. Deuxième partie : expérience actuelle[64]. Ce dernier témoignait en 2012 sur Télé Matin « sur les quelques patients récents traités par phagothérapie, nous n'avons jamais eu d'échec »[65].
L'efficacité in vitro et in vivo n'est pas forcément identique. Ainsi une étude parue dans le journal Nature a montré que les bactériophages pouvaient être plus efficaces sur la bactérie Clostridium difficile lorsque cette bactérie colonise des cellules humaines que lorsqu'elle est simplement cultivée in vitro[66].
Plusieurs études ont été conduites sur les bactériophagiques disponibles en vente libre en pharmacie en Russie et dans les autres pays de l'URSS. Elles ont démontré que les cocktails bactériophagiques sont actifs in vitro sur les bactéries multi-résistantes[67],[68][source secondaire nécessaire]. En 2020 une étude russe, Efficacy of Commercial Bacteriophage Products Agains Eskape Pathogens, compare l'efficacité des cocktails disponibles là-bas en pharmacie sur de très nombreuses souches différentes des principales espèces de germes pathogènes et conclut à une large efficacité des 7 cocktails, principalement sur P. aeruginosa et S. aureus mais avec une efficacité moins homogène sur K.pneumoniae[69][source secondaire nécessaire].
Les nombreuses études scientifiques publiées dans les pays de l'ex bloc soviétique ont donné lieu à plusieurs synthèses d'analyse documentaire à caractère scientifique en anglais : Minireview Bacteriophage Therapy[70], Bacteriophage Therapy of Bacterial Infections: an Update of Our Institute’s Experience[71], Phage Therapy in Clinical Practice: Treatment of Human Infections[72], Phage treatment of human infections[27], Phage therapy of pulmonary infections[73], Applications of Bacteriophages in the Treatment of Localized Infections in Humans[74]. Aucune ne remet en cause l'efficacité de la phagothérapie.
Lieux de pratique de la phagothérapie en France
La phagothérapie est pratiquée à titre compassionnel dans plusieurs hôpitaux français :
- Villeneuve Saint Georges[75] ;
- Lyon Croix Rousse[76] ;
- Hôpital Neuro-chirurgical de Bron[77] ;
- Pitié Salpêtrière à Paris[78] ;
- CHRU de Nantes ;
- CHU Pellegrin à Bordeaux[79].
Plusieurs hôpitaux militaires travaillent sur les phages et/ou la phagothérapie :
- Hôpital d'instruction des Armées de Percy[80] ;
- Hôpital d'instruction des Armées Sainte-Anne de Toulon.
Dans le cadre de projets européens, ils travaillent avec l'Hôpital Militaire Reine Astrid à Bruxelles[81].
Options pour les patients
Acheter un bactériophagique en pharmacie se fait sans ordonnance en Russie, en Géorgie et dans certains autres pays de l'ex bloc soviétique.
Les patients français souhaitant se faire soigner par phagothérapie ont quatre options[82] :
- aller dans un pays proposant un traitement par bactériophage et s’y faire traiter par le corps médical local (Russie, Géorgie, Pologne, Belgique) ;
- aller dans un pays proposant un traitement par bactériophage, y acheter un cocktail bactériophagique et se traiter soi-même sur place ou en rapportant le traitement en France ; une ordonnance n'est pas requise pour rapporter le traitement avec soi ;
- acheter le traitement phagique par correspondance (internet) et le faire venir en France en dehors du système médical français, mais accompagné d'une ordonnance d'un médecin du pays d'expédition ;
- se faire traiter par phagothérapie en France par le corps médical français dans le cadre d'un essai clinique ou d'une Autorisation Temporaire d'Utilisation nominative accordée par l'ANSM ou dans un autre cadre compassionnel.
Ces quatre options sont légales selon la réglementation française. Ce qui n'est pas légal serait qu'un médecin français prescrive ou utilise un bactériophagique étranger sans accord préalable de l'ANSM. Les associations de patients et de médecins (AVIBEP, Europhages, Phages Sans Frontières, Phag Espoirs) conseillent et aident les patients selon l'option qui leur est préférable.
Réglementation de la phagothérapie médicale
Réglementation européenne et française applicables
L'ANSM a précisé plusieurs fois que le phagothérapie n'est pas interdite en France[83],[15]. Mais aucun médicament bactériophagique ne bénéficie d'une Autorisation de Mise sur le Marché (AMM) faute d'entreprise intéressée.
L'Agence Médicale Européenne propose deux cadres qui peuvent s'appliquer à la phagothérapie en l'absence de bactériophagiques disposant d'une Autorisation de Mise sur le Marché: le traitement compassionnel et le traitement sur une base individuelle. Ces deux cadres sont du ressort des états membres[84]. La réglementation européenne ne peut donc être invoquée pour s'opposer à l'emploi de la phagothérapie dans ces cadres. Ceci a d'ailleurs été confirmé par l'ANSM lors du CSST du [15]. Un troisième cadre juridique est enfin possible: la préparation magistrale.
Le traitement compassionnel
L'usage compassionnel permet à un groupe de patients d'utiliser un médicament industriel non autorisé. Sous des conditions strictes un produit en phase de développement peut être mis à disposition de groupes de patients atteints d'une maladie qui ne peut pas être traitée de manière satisfaisante avec les thérapies autorisées et qui ne peuvent pas entrer dans un essai clinique.
Selon la réglementation européenne, les programmes compassionnels sont du ressort des états membres, qui mettent en place leurs propres règles. Selon la réglementation européenne, ces programmes nationaux ne peuvent être mis en place que si le médicament est supposé aider les patients atteints de pathologie les mettant en danger de mort, ou de longue durée, ou profondément handicapantes et qui ne peuvent être traitées avec aucun médicament autorisé.
Le médicament doit de plus être en phase d'essai clinique ou en demande d'autorisation de mise sur le marché. Il a généralement été soumis à de premières études scientifiques, même si son profil de risque et les recommandations de dosage ne sont pas encore pleinement fixés[84],[85].
Les autorités de santé nationales doivent informer l'Agence Européenne du Médicament lorsqu'elles accordent une autorisation d'usage compassionnel au bénéfice d'un groupe de patients.
En France le traitement compassionnel est réglementé par l'ANSM sous le vocable d'Autorisation Temporaire d'Utilisation de cohorte. La Phagothérapie n'est pas autorisée dans ce cadre pour l'instant bien que des associations de patients militent pour que ce soit le cas[35].
Pour un traitement compassionnel, la législation actuelle n'interdit pas le recours à des produits étrangers, y compris d'origine extérieure à l'Union européenne.
Le traitement sur une base individuelle nominative
Le traitement compassionnel tel que défini ci-dessus ne doit pas être confondu avec les traitements individuels nominatifs. Pour ceux-ci le médecin obtient le médicament directement du fabricant qui doit être ici aussi un industriel. Ceci est fait sur une base individuelle et nominative sous la responsabilité directe du médecin, et l'agence européenne du médicament n'a pas à être informée[84].
En France le traitement individuel nominatif se fait dans le cadre d'une autorisation temporaire d'utilisation nominative (ATUn) accordée par l'ANSM au cas par cas, uniquement dans un cadre hospitalier. C'est sous ce statut général que se pratiquait la phagothérapie en France depuis le CSST organisé par l'ANSM en et jusqu'en 2019[83].
Lors du CSST de 2019, l'ANSM a fait savoir que l'utilisation sous ATUn n'était plus possible car il suppose que le produit utilisé soit fabriqué selon des standards de qualité et de production industrielle BPF, ce qui n'est pas le cas avec les seuls produits reconnus par l'ANSM, ceux fabriqués par la société Pherecydes. L'ANSM a alors indiqué que les préparations de Pherecydes seraient dorénavant considérées préparations magistrale[15].
Pour un traitement sur une base nominative, la législation française n'interdit pas le recours à des produits étrangers, y compris d'origine extérieure à l'Union européenne.
L'ANSM a toutefois précisé que pour une utilisation de produits étrangers par une Pharmacie à Usage Intérieur, c'est-à-dire une pharmacie d'hôpital, il faut réunir les conditions suivantes :
- que le fabricant fournisse à l’ANSM des données documentant la qualité ;
- que le produit soit fourni à la PUI par un établissement pharmaceutique ou par un établissement autorisé par l’ANSM pour l’importation de substances actives ;
- que les autorités du pays d’origine attestent par un certificat que les normes de fabrication applicables au site de production sont au moins équivalentes aux normes européennes[15].
En juin 2022, après la réforme de 2021 qui remplace les ATUn par les Autorisation d'Accès Compassionnel (AAC)[86], afin de permettre aux patients qui ne peuvent pas participer à un essai clinique d’accéder à la phagothérapie dans un cadre sécurisé, l'ANSM autorise l’accès compassionnel (AAC) à deux bactériophages anti-Staphylococcus aureus (PP1493 et PP1815), pour le traitement d’infections osseuses et ostéo-articulaires graves documentées à Staphylococcus aureus[87].
La préparation magistrale
Il s'agit d'un médicament préparé extemporanément selon une prescription médicale destinée à un malade déterminé en raison de l'absence de spécialité pharmaceutique[88]. La préparation magistrale bactériophagique peut répondre à une demande compassionnelle mais ne prévoit pas d’autorisation préalable de l’ANSM contrairement aux ATUn ou AAC. D'après l'article L.5121-1 du Code de la Santé Publique, rien n'oblige à ce qu'une préparation magistrale soit fabriquée selon les indications de la pharmacopée et en conformité avec les bonnes pratiques de fabrication, contrairement aux préparations hospitalières[88]. C'est sous ce statut que depuis le CSST 2019 l'ANSM qualifie désormais les préparations de Pherecydes utilisées à titre compassionnel.
L'ANSM précise lors du CSST de 2019 : « L'ANSM ne peut être amenée à octroyer des ATU en l'absence à ce jour de phages répondant à des standards de qualité et de production industrielles ». Désormais elle les autorise comme Préparation Magistrale dans un cadre compassionnel et confirme « l'ANSM n'interdit pas les phages et procède à un accompagnement au cas par cas de l'usage compassionel de phages en milieu hospitalier ». Dans les faits cela n'a rien changé et l'ANSM exige toujours que les demandes passent par elle comme s'il s'agissait d'ATUn[15].
Le CSST Phagothérapie du 24 mars 2016
En mars 2016, le pôle Maladies infectieuses de l'Agence Nationale de Sécurité du Médicament et des Produits de Santé a mis en place un Comité scientifique spécialisé temporaire Phagothérapie (CSST)[89]. Participent à ce CSST principalement des personnels de l'ANSM, des représentants d'associations de patients et de médecins, et des dirigeants de la société Pherecydes. Le Dr Dublanchet avait été pressenti pour faire partie du CSST, mais récusé pour cause de conflit d'intérêt car au conseil scientifique de Pherecydes[90]. Participent néanmoins au CSST le Président du Directoire de Pherecydes et le Directeur Général de Pherecydes, MM. Guy-Charles Fanneau de La Horie et Jérôme Gabard.
Après un état des lieux auprès des intervenants, le CSST statue sur trois demandes d'ATUn par phagothérapie pour des cas particuliers. Les trois cas sont rejetés pour des raisons différentes. Le premier, un patient auquel il ne reste qu'un rein, se voit refuser un phage de Pherecydes pourtant actif sur sa bactérie au motif de l'absence d'impasse thérapeutique. Les deux autres cas sont rejetés car les bactéries Pseudomonas Aeruginosa des patients n'étaient pas sensibles aux phages de Pherecydes.
Le CSST établit un cadre d’octroi des ATUn (Autorisation temporaire d'utilisation Nominative) de bactériophages qui les réserve aux infections présentant les caractéristiques suivantes[83] :
- un pronostic vital engagé ou pronostic fonctionnel menacé ;
- l’impasse thérapeutique ;
- une infection mono-microbienne.
S'y ajoutent les restrictions suivantes :
- la nécessité d’un groupe de validation issu du CSST pour toute demande d’ATUn de bactériophages afin d’obtenir un avis collégial ;
- la nécessité de disposer des résultats d’un phagogramme avant la décision d’une mise sous traitement.
Et enfin que :
« Aujourd’hui les seuls phages de qualité standardisée contrôlée fabriqués industriellement sont ceux de la Société Pherecydes Pharma (phages dirigés contre Escherichia coli et contre Pseudomonas), qui est promoteur de l’essai clinique en cours « Phagoburn ». Les demandes d’ATUn ne peuvent concerner que ces produits[83]. »
Restriction qui limite donc en plus l'utilisation éventuelle de la phagothérapie à seulement deux germes et sans choix de produits.
Cette porte entrouverte en mars 2016 n'a pas eu l'effet escompté d'encourager la recherche et le développement d'essais thérapeutiques, ni de sauver un nombre significatif de malades condamnés. Le nombre d'ATUn accordées reste confidentiel (une douzaine de patients en tout à la date du CSST 2019[15]). En effet, les restrictions imposées et l'obligation de demande d'ATUn découragent les médecins. Dans le même temps, on compte toujours environ 13 000 décès par an en France dus à des infections par des germes antibio-résistants dont environ 5 000 cas d'infections nosocomiales[91].
Le CSST Phagothérapie du 21 mars 2019
Bien que le CSST de 2016 ait prévu une prochaine réunion du CSST avec pour objectifs de rechercher/d’analyser d’autres sources de bactériophages thérapeutiques (y compris de fabrication « personnalisée »), et d’apprécier les données pré-cliniques voire cliniques issues d’expérimentations effectuées avec ces phages. Il faut attendre 3 ans pour voir le CSST se réunir à nouveau, le . Y participent cette fois aussi des représentants de la DGS et de la DGOS[15].
Lors de cette nouvelle réunion, l'ANSM commence par souligner qu'elle n'interdit pas les phages. Elle indique avoir changé de position quant aux ATUn qui ne sont désormais plus possibles : L'ANSM ne peut être amenée à octroyer des ATU en l'absence à ce jour de phages répondant à des standards de qualité et de production industrielles. Désormais elle autorise dans un cadre compassionnel les phages belges et ceux de Pherecydes mis à disposition selon un statut assimilé à des préparations magistrales et elle confirme que l'ANSM n'interdit pas les phages et procède à un accompagnement au cas par cas de l'usage compassionnel de phages en milieu hospitalier ».
Puis se tient un retour d'expérience des Hospices Civils de Lyon (infections ostéoarticulaires), de l'Hôpital de la Pitié Salpêtrière (empyème extradural à S. Aureus), de l'Hôpital européen Georges Pompidou (Mucoviscidose) et de l'Hôpital Henri Mondor de Créteil (infections vasculaires). Le CSST récapitule que depuis 2015, 45 demandes ont été reçues à l'ANSM qui ont conduit à 15 administrations de phages pour 12 patients.
Lors du CSST, la société Pherecydes explique se tourner désormais vers la production de phages individuels et avoir sélectionné ainsi 4 phages contre Pseudomonas aeruginosae et 3 contre Staphylococcus Aureus. Les phages fournis par Pherecydes en concertation avec l'ANSM ont été produits de manière non industrielle et n'ont donc pu relever du statut ATU mais ont pu être mis à disposition selon un statut assimilé à des préparations magistrales. Le calendrier de Pherecydes prévoit une libération de lots industriels pour fin 2019 qui relèveront des ATUn. Pherecydes précise ne pas être en mesure de produire d'autres types de phages.
Les Belges de l'Hôpital de la Reine Astrid relèvent avoir reçu 260 demandes de traitement par phagothérapie entre 2013 et 2018, émanant principalement de patients. L'administration de phages n'y a été considérée que pour 15 de ces patients.
Le manque d'implication apparent de l'Agence Européenne du Médicament provient, selon l'ANSM, du fait que l'Agence Européenne ne se positionne qu'au regard des demandes d'avis scientifique ou d'AMM qui lui sont soumises, mais pas sur l'accès compassionnel qui relève des agences nationales et qui ne fait donc pas l'objet de demandes auprès des autorités européennes.
L'ANSM a souligné que les phages de sources étrangères ne pourraient être fournis à des Pharmacies à Usage Intérieur des hôpitaux que si les Bonnes Pratiques de Fabrication étaient respectées, y compris l'inspection du site de production par un organisme européen ou la confirmation écrite par les autorités du pays exportateur que les normes appliquées sont au moins équivalentes aux BPF.
Plusieurs associations et médecins ont aussi proposé d'envisager le recours aux phages dès la primo-colonisation, sans attendre la dernière extrémité.
Le CSST de 2019 a décidé d'assouplir les contraintes d'accès à la phagothérapie décidées au CSST de 2016. Ainsi la phagothérapie ne se limitera plus aux infections mono-bactériennes. Par contre la voie orale est exclue pour la plupart des infections.
L'équipe hospitalière de l'Hôpital Beaujon de Clichy (APHP) a présenté un guide pratique sur l'organisation et la sécurisation du circuit des préparations de bactériophages à l'hôpital.
Enfin et à l'unanimité, les membres du CSST n'ont pas identifié d'effets indésirables particuliers pour la phagothérapie.
Réglementation souhaitée par les associations de patient
Les associations de patients et de médecins demandent à pouvoir utiliser les médicaments bactériophagique étrangers même s'ils ne sont pas fabriqués selon les normes de Bonnes Pratiques de Fabrication européennes (BPF). En effet l'Agence Médicale Européenne n'impose pas ces normes pour les produits utilisés à titre compassionnel[84]. Elle laisse chaque pays membre libre de réglementer ou non les produits utilisés à titre compassionnel et c'est l'ANSM qui a décidé de son propre chef d'interdire les médicaments bactériophagiques non BPF[78]. Cela exclut de fait tous les produits non européens, donc les bactériophagiques russes et géorgiens, les seuls à être produits de manière industrielle et à avoir fait leurs preuves sur de nombreuses espèces de germes[69].
L'AVIBEP propose plusieurs pistes telle que de déréglementer l'accès compassionnel aux bactériophagiques étrangers de manière large, en faisant le point au bout d'une année, ou par étape en commençant par les urgences vitales et en étendant progressivement aux autres patients, ou encore de compléter l'article L5121-12 du Code de la Santé Publique comme suit:[92]
VII. – Par dérogation aux dispositions des II, III, IV, V et VI, une autorisation n’a pas à être demandée lorsque, en l’état des thérapeutiques disponibles, des conséquences graves pour le patient sont très fortement probables selon l’opinion du médecin prescripteur et que le médecin prescripteur est spécialisé dans un champ qui recouvre la pathologie du patient. Les dispositions suivantes s’appliquent alors :
1. Le produit utilisé doit être autorisé et visé comme médicament dans son pays de fabrication. Il n’est pas soumis à la définition de l’Article L.5111-1 ni aux dispositions de l’Article L5121, y compris en matière de bonnes pratiques. Il peut provenir d’une origine hors Union Européenne.
2. Le médecin prescripteur est habilité à obtenir le produit directement, y compris par importation, sans devoir passer par un établissement autorisé par l’Agence nationale de sécurité du médicament et des produits de santé.
3. Le médecin prescripteur transmet à l’agence, dès le début du traitement, des données documentant le produit, ainsi que les données de suivi des patients traités. La nature de ces données peut être précisée par l’agence. Si les données ne sont pas disponibles, le médecin prescripteur en informe l’agence.
4. L’agence peut proposer mais non imposer la mise en place d’un protocole d’utilisation thérapeutique et de recueil d’informations.
3. La mise en œuvre du traitement n’est pas soumise à autorisation de l’agence et l’agence ne peut s’opposer au traitement du patient au motif de l’insuffisance des données transmises par le médecin prescripteur.
Et par ailleurs
Article L5121-1 19° Médicament bactériophagique: tout médicament dont les principes actifs sont exclusivement une ou plusieurs préparations à base de virus bactériophages ou une association de plusieurs préparations à base de virus bactériophages ;
Phagothérapie anti-virale
Les bactériophages sont nouvellement étudiés pour combattre le virus de la grippe et maintenant aussi celui du Covid-19, le virus SARS-CoV-2. L'idée est simple: il suffit d'avoir des bactériophages qui s'attachent au virus grippal sur les pointes virales (appelées hémagglutinines) que le virus grippal utilise normalement pour se fixer aux cellules qu'il va infecter. Ainsi le virus ne peut plus se fixer à sa cible.
L'étude a d'abord été menée sur le virus de la grippe par une équipe de chercheurs de l'Institut de Recherche de Pharmacologie Moléculaire de Leibniz et de l'Université Humboldt de Berlin. Ils ont développé un phage modifié chimiquement pour se lier parfaitement aux hémagglutinines du virus. Le virus se trouve alors enveloppé par des capside de phages qui lui rendent impossible de se fixer sur les sucres (acide sialique) des cellules pour les infecter. Le phénomène a été démontré lors d'études pré-cliniques sur du tissu de poumons humains.
La méthode a été étendue à la grippe aviaire avec succès. Elle ouvre la voie à un nouveau type de phagothérapie.
Lorsque le tissu pulmonaire infecté par le virus de la grippe était traité avec des phages, le virus ne pouvait quasiment plus infecter de nouvelles cellules et donc se reproduire. De plus le microscope électronique a montré que les phages enrobaient complètement le virus.
Le phage utilisé est un parasite des bactéries Eschericchia Coli dénommé phage Q-beta.
Les chercheurs appliquent maintenant au SARS-CoV-2 cette découverte qui concernait initialement le virus de la grippe, et qu'ils ont publiée dans le journal Nature[93],[94].
Autres utilisations de la phagothérapie
Utilisation en médecine vétérinaire
La phagothérapie peut être utilisée en médecine vétérinaire comme elle l'est en médecine humaine, par exemple en aquaculture, ou dans des élevages de volaille ou de bétail, etc. Les raisons de l'utiliser et les obstacles règlementaires sont similaires[95]. L'organisme règlementaire est cette fois l'ANSES.
Utilisation dans l'industrie agroalimentaire
Des bactériophages sont utilisés dans le but de détruire certaines bactéries susceptibles de contaminer les produits alimentaires frais. C'est ainsi qu'en août 2006 l'administration américaine des denrées alimentaires et des médicaments (FDA) a autorisé la pulvérisation sur la viande d’un cocktail de 6 phages non génétiquement modifiés (phages anti-listeria). Bien que ce procédé ait suscité des préoccupations du fait que, sans étiquetage obligatoire, les consommateurs ne pouvaient pas savoir si la viande et la volaille avaient été traitées, cette approbation est justifiée par le fait que l'exposition par voie orale à certains phages actifs est actuellement considérée comme sans danger pour les consommateurs[96].
Utilisation possible pour l'épuration de l'eau
En 2019, 4 chercheurs de l'Université Rice ont publié une étude sur les niches d'application potentielles de phages dans le cycle d'approvisionnement et de réutilisation de l'eau. Ils y concluent que des bactériophages pourraient être préventivement utilisés pour :
- débarrasser certaines eaux (« usées » ou destinées à être potabilisée ou réutilisées) de certaines bactéries pathogènes (et de plus en plus antibiorésistantes), trouvées dans les composants d'installations de traitement, de distribution et de réutilisation de l'eau, bactéries qui contribuent aussi à produire des biofilms bactériens très difficiles à désinfecter et contribuant à la corrosion et l'encrassement de ces infrastructures.
Les phages ne peuvent pas remplacer les désinfectants à large spectre dans le traitement de l'eau potable, mais ils permettraient de cibler des bactérie spécifiques posant problème (d'antibiorésistance par exemple), tout en éviter la production de sous-produits de désinfection nocifs (par exemple issus de la désinfection par le chlore ou l'ozone), dans des installations « où les antimicrobiens à large spectre nuiraient à la biodégradation des polluants ». Ils permettraient en particulier sélectivement supprimer des bactéries source de flocs flottants et de mousses qui entravent la clarification/floculation des boues activées[97]. J Mathieu & al. en 2019 rappellent que ces virus ciblant uniquement des bactéries « sont la ressource biologique la plus abondante (et peut-être la plus sous-utilisée) de la Terre et sont très prometteurs. pour cibler les bactéries problématiques »[97] ; - freiner ou supprimer certaines pullulations nocives de cyanophycées sources de cyanotoxines[97] dans les réservoirs d'eau ou certaines eaux de baignade ;
- offrir des usages prophylactique en agriculture et élevage, en remplaçant des antibiotiques et biocides problématiques, ou au moins en permettrant de réduire leur rejet dans les eaux de surface et de nappe tout en diminuanl la pression sélective qui crée un nombre croissant de bactéries résistantes aux biocides[97].
Les phages permettraient ainsi une épuration et/ou réutilisation de l'eau plus écologique car se passant de biocides couteux et/ou écotoxiques[97].
Utilisation des phages sur les aliments pour la consommation humaine : viandes, poissons, etc.
Les autorités sanitaires - ANSES - donnent leur aval pour l'utilisation du phage P100 afin de détruire la bactérie listeria[98].
L'avis se base sur des données générales concernant les phages : « Les phages constituent les organismes les plus abondants sur terre (Sulakvelidze, 2013[99]). Malgré cela aucun phage n’a jamais provoqué d’infection chez l’homme et aucune séquence de phage n’a pu être identifiée dans le génome humain. Des phages ont déjà été administrés à l’homme dans le cadre de phagothérapies (voie orale ou rectale, en topique) sans aucun effet négatif pour la santé. »
Chaque fois qu'un aliment peut être vecteur d'une bactérie pathogène pour l'être humain, la destruction des bactéries par les phages est envisagée - ostréiculture, pisciculture, etc.[100],[101]. Le secteur de la production fromagère est également concerné[102].
Utilisation des phages en médecine vétérinaire
Elle fait l'objet de travaux de recherche[103]. En 2014 un essai vétérinaire a été financé par l'Union européenne — AntibioPhage[104]. Les industriels travaillent au développement de phages à usage vétérinaire[105].
En 2019, les phages ne sont toujours pas autorisés, cependant il y a une tolérance pour l'importation de phages depuis la Géorgie, la Russie ou la Pologne[106].
Situation à l'étranger
Autres pays d'Europe
Le projet Européen PhagoBurn a financé quelques études sur les bactériopathies des grands brûlés.
L'équipe PhageBack — Centre hospitalier universitaire vaudois et Université de Lausanne Suisse — travaille sur le projet PhagoBurn et d'autres dimensions de la phagothérapie. La question de l'autorisation de la phagothérapie est à l'ordre du jour[107].
La récolte des phages est en cours en Finlande[108].
En République Fédérale Allemande un colloque en 2017[109] fait un double constat : « De nombreux obstacles méthodiques ont été supprimés, les problèmes de démarrage de la production de phages conformes aux Bonnes pratiques de fabrication - BPF - ont été résolus et certains obstacles règlementaires ont déjà été franchis. Et pourtant, la réalité ne suit pas le progrès scientifique. La protection de la propriété intellectuelle, la concession de licences et d'autres questions règlementaires doivent être adaptées au nouveau monde de la médecine personnalisée et à d'autres domaines d'application du phage, et non l'inverse. Un accès ouvert aux données et aux infrastructures appropriées (référentiels de phages, installations de production conformes aux BPF, unités de diagnostic et cliniques expérimentées dans l'utilisation du phage) est nécessaire pour exploiter pleinement le potentiel des applications de phage. »
En Grande-Bretagne, une jeune fille de 15 ans atteinte d'une infection résistante par Mycobacterium abscessus a été traitée par un cocktail de trois bactériophages (mis au point à l'Université de Pittsburg) : le seul phage actif sur sa souche bactérienne, épaulé par deux autres génétiquement modifiés. Le traitement (2 injections intraveineuses par jour pendant 32 semaines) est venu à bout de l'infection[110].
En Catalogne, les chercheurs soulignent « l'attitude réticente de la communauté scientifique et médicale »[111] ; ils ajoutent « Une approche multidisciplinaire centrée sur le patient, qui ne se limite pas aux contextes académiques ou cliniques ni aux études microbiologiques, est recommandée pour évaluer l'étendue réelle et le rôle joué par le phagome dans le corps humain »[112].
Amérique du nord
Au Canada, des industriels travaillent aux applications alimentaires des phages[113].
Associations
Plusieurs associations françaises ont pour objet ou s'engagent en faveur de la phagothérapie :
AVIBEP : L’ Association des Victimes de l’Interdiction des Bactériophagiques Etrangers et de leurs Proches, a pour but d’aider les malades à avoir accès aux phagiques français et étrangers afin que plus un malade ne se voie condamné à mourir ou à être amputé sans avoir été traité auparavant par phagothérapie lorsque cela est possible, y compris avec des bactériophagiques étrangers si nécessaire. L'association demande que d'une part les médicaments agréés à l'étranger soient autorisés automatiquement en France dans le cadre de la règlementation compassionnelle existante, et que d'autre part soit de nouveau mis en place un centre de fabrication de bactériophages à la demande, analogue à ce qu'ont fait les Instituts Pasteur de Paris, Lyon et Strasbourg durant une cinquantaine d'années pour les médecins de ville et les hôpitaux. Elle s'appuie sur l'Etude Burden BMR[114] pour affirmer que chaque année environ 10 000 vies sont perdues qui pourraient être sauvées par les bactériophagiques étrangers[35] ;
Le Lien : Association de défense des patients et des usagers de la santé. Son cœur de mission est de défendre les victimes d’infections nosocomiales et d'accidents médicaux, qu’il s’agisse d’erreurs, de fautes ou d’aléas. Elle milite pour la réintroduction des bactériophagiques en France[115] ;
Phag Espoirs : Vise à promouvoir d’une part la recherche et l’utilisation des bactériophages dans le domaine diagnostique et thérapeutique, et d’autre part à soutenir les patients désirant en savoir plus sur les bactériophages. L'association est principalement composée de médecins[116] ;
Phages sans frontières : Récolte de fonds et conseils pour aider les patients à aller se faire soigner en Géorgie. L'association passe régulièrement dans les médias[34] ;
PHELIX France : en lien avec l'Université de Leicester au Royaume Uni, porte un projet d'étude et de traitement des infections chroniques par Borrelia (maladie de Lyme) en utilisant des virus bactériophages[117],[118].
Notes et références
- Cet article est partiellement ou en totalité issu de l'article intitulé « Phagothérapie (dimensions politiques) » (voir la liste des auteurs).
- Des virus pour combattre les infections, docteur Alain Dublanchet, éd. Favre, 240 p., 2009.
- Hérelle, Félix d' (1873-1949). et Schwartz, Maxime (1940-....)., Autobiographie de Félix d'Hérelle 1873-1949 (ISBN 978-2-86728-015-3 et 286728015X, OCLC 1002110122, lire en ligne)
- (en) Summers, W.C. « History of Phage Research and Phage Therapy » in Phages: Their Role in Bacterial Pathogenesis and Biotechnology, M.K. Waldor, D.I. Friedman, and S.L. Adhya, Editors. 2005, ASM Press: Washington, DC. p. 3-17.
- Institut Pasteur Auteur du texte, « Annales de l'Institut Pasteur : journal de microbiologie / publiées sous le patronage de M. Pasteur par E. Duclaux », sur Gallica, (consulté le )
- Dr Edouard Peyre, V. Sertic, N. Boulgakov, F. d'Hérelle, Ch. Mikeladzé, E. Nemsadzé, N. Alexidzé, T. Assanichvili, A. Tsouloukidzé, Gougerot, les chirurgiens L. Sauvé, et L. Michon, Pr E. Halphen., « Le Bactériophage - Applications Thérapeutiques », La Médecine, (ISSN 0368-9344, lire en ligne)
- Dr. A. Raiga-Clémenceau, « Pétition en faveur de la renaissance de la bactériophagie thérapeutique », Panorama du Médecin, (lire en ligne)
- Albert Delaunay, « Pour le Quarantième Anniversaire de la Société Française de Microbiologie », Annales de Microbiologie de l'Institut Pasteur, , p. 1-17 (lire en ligne)
- Pierre Nicolle - Chef du Service des Bactériophages, « A propos de la thérapeutique par les bactériophages », Bulletin de l'Académie Nationale de Médecine, , p. 58-60 (lire en ligne)
- Jacques Charpin, « Rapport - Sur la demande d'autorisation de fabrication de bactériophages et vaccins thérapeutiques présentée par MM Pérouse de Montclos, Drouet, Denoyel et Mme Richoud », Bulletin de l'Académie Nationale de Médecine, , p. 115-116 (lire en ligne)
- Docteur Paul-Hervé Riche, Manuel de phagothérapie à l'usage des médecins du XXIe siècle, Nîmes, W3edition.com, , 260 p. (ISBN 978-2-9544885-0-9), pp 236-238
- « Les phages, des virus guérisseurs », Le Monde, (lire en ligne, consulté le )
- Baptiste Talmont, « Phagothérapie: La relève de l'antibiothérapie? », Principes de Santé, , p. 15
- « 20th Evergreen Phage Meeting: Jerome Larché » (consulté le )
- (en) Irshad U Haq, Waqas N Chaudhry, Maha N Akhtar, Saadia Andleeb et Ishtiaq Qadri, « Bacteriophages and their implications on future biotechnology: a review », Virology Journal, vol. 9, no 1, , p. 9 (ISSN 1743-422X, DOI 10.1186/1743-422X-9-9, lire en ligne, consulté le ).
- « Évènement - Comité Phagothérapie - Retour d'expérience et perspectives - ANSM », sur ansm.sante.fr, (consulté le )
- Ansm, « Phagothérapie : l’ANSM autorise un accès compassionnel pour des bactériophages dans les infections ostéo-articulaires »
 , sur Asnm, (consulté le )
, sur Asnm, (consulté le ) - Dottore Emiliano Fruciano et Shawna Bourne, « Phage as an antimicrobial agent: d’Herelle's heretical theories and their role in the decline of phage prophylaxis in the West », The Canadian Journal of Infectious Diseases & Medical Microbiology, vol. 18, no 1, , p. 19–26 (ISSN 1712-9532, PMID 18923687, PMCID PMC2542891, lire en ligne, consulté le )
- (en) Alexander Sulakvelidze, Zemphira Alavidze et J. Glenn Morris, « Bacteriophage Therapy », Antimicrobial Agents and Chemotherapy, vol. 45, no 3, , p. 649-659 (ISSN 0066-4804, DOI 10.1128/AAC.45.3.649-659.2001, lire en ligne).
- Kutter, Elizabeth. et Sulakvelidze, Alexander., Bacteriophages : biology and applications, CRC Press, (ISBN 0-203-49175-0 et 9780203491751, OCLC 70247338, lire en ligne)
- Alexander Sulakvelidze, Zemphira Alavidze et J. Glenn Morris, « Bacteriophage Therapy », Antimicrobial Agents and Chemotherapy, vol. 45, no 3, , p. 649–659 (ISSN 0066-4804, PMID 11181338, DOI 10.1128/AAC.45.3.649-659.2001, lire en ligne, consulté le )
- William C. Summers, « The strange history of phage therapy », Bacteriophage, vol. 2, no 2, , p. 130–133 (ISSN 2159-7073, PMID 23050223, PMCID PMC3442826, DOI 10.4161/bact.20757, lire en ligne, consulté le )
- (en) Biographie de George Eliava sur le site Internet de sa région natale.
- (en) Chanishvili, N. and R. Sharp, Bacteriophage therapy: experience from the Eliava Institute, Georgia. Microbiology Australia, 2008, p. 96-101.
- (en) M Kutateladze et R Adamia, « Phage therapy experience at the Eliava Institute », Médecine Et Maladies Infectieuses, vol. 38, no 8, , p. 426-430 (ISSN 0399-077X, PMID 18687542, DOI 10.1016/j.medmal.2008.06.023).
- (en) Dimitry Myelnikov, « An Alternative Cure: The Adoption and Survival of Bacteriophage Therapy in the USSR, 1922–1955 », Journal of the History of Medicine and Allied Sciences, , p. 385-411 (lire en ligne)
- (en) SCIENCE First Hand journal, « Phages Attack », SCIENCE First Hand, (lire en ligne, consulté le )
- Stephen T Abedon, Sarah J Kuhl, Bob G Blasdel et Elizabeth Martin Kutter, « Phage treatment of human infections », Bacteriophage, vol. 1, no 2, , p. 66–85 (ISSN 2159-7073, PMID 22334863, PMCID PMC3278644, DOI 10.4161/bact.1.2.15845, lire en ligne, consulté le )
- (en) B Weber-Dabrowska, M Mulczyk et A Górski, « Bacteriophage therapy of bacterial infections: an update of our institute's experience », Archivum Immunologiae Et Therapiae Experimentalis, vol. 48, no 6, , p. 547-551 (ISSN 0004-069X, PMID 11197610).
- (en) Andrzej Gorski, Krystyna Dabrowska, Kinga Switala-Jeleń, Maria Nowaczyk et Beata Weber-Dabrowska, « New insights into the possible role of bacteriophages in host defense and disease », Medical Immunology (London, England), vol. 2, no 1, , p. 2 (ISSN 1476-9433, PMID 12625836).
- (en) Ryszard Miedzybrodzki, Wojciech Fortuna, Beata Weber-Dabrowska, Andrzej Górski, « Phage therapy of staphylococcal infections (including MRSA) may be less expensive than antibiotic treatment », Postȩpy Higieny I Medycyny Doświadczalnej (Online), vol. 61, , p. 461-465 (ISSN 1732-2693, PMID 17679835).
- « Phages: Accueil », sur www.phage.ulaval.ca (consulté le )
- Sarah Djebara, Christiane Maussen, Daniel De Vos et Maya Merabishvili, « Processing Phage Therapy Requests in a Brussels Military Hospital: Lessons Identified », Viruses, vol. 11, no 3, 03 17, 2019 (ISSN 1999-4915, PMID 30884879, PMCID 6466067, DOI 10.3390/v11030265, lire en ligne, consulté le )
- « Figure 1. Exponential increase in phage application-related... », sur ResearchGate (consulté le ).
- « Phages Sans Frontières », sur phages-sans-frontieres.com (consulté le )
- « Association des Victimes de l'Interdiction des Bactériophagiques Etrangers et de leurs Proches », sur AVIBEP (consulté le )
- « EuroPhages », sur europhages.com (consulté le )
- Bruce R. Levin et J. J. Bull, « Phage Therapy Revisited: The Population Biology of a Bacterial Infection and Its Treatment with Bacteriophage and Antibiotics », The American Naturalist, vol. 147, no 6, , p. 881–898 (ISSN 0003-0147, DOI 10.1086/285884, lire en ligne, consulté le )
- Samuel Alizon, C'est grave Docteur Darwin ? : l'évolution, les microbes et nous, Paris, Éditions du Seuil, (ISBN 978-2-02-110292-5 et 2-02-110292-0, OCLC 940971773, lire en ligne)
- (en) A Wright, C H Hawkins, E E Anggård, D R Harper, « A controlled clinical trial of a therapeutic bacteriophage preparation in chronic otitis due to antibiotic-resistant Pseudomonas aeruginosa; a preliminary report of efficacy », Clinical Otolaryngology: Official Journal of ENT-UK ; Official Journal of Netherlands Society for Oto-Rhino-Laryngology & Cervico-Facial Surgery, vol. 34, no 4, , p. 349-357 (ISSN 1749-4486, PMID 19673983, DOI 10.1111/j.1749-4486.2009.01973.x).
- (en)Référence NCT00663091 sur le site clinicaltrials.gov consulté le 25 janvier 2013.
- Carte de répartition des essais dans le monde, sur le site clinicaltrials.gov consulté le 25 janvier 2013.
- « Pherecydes Pharma obtient un financement de la DGA pour le projet PACOBURNS », sur MyPharmaEDITIONS.com, (consulté le ).
- (en) Wilbert Sybesma et Jean-Paul Pirnay, « Silk route to the acceptance and re-implementation of bacteriophage therapy », Biotechnology Journal, vol. 11, , p. 595-600 (DOI 10.1002/biot.201600023, lire en ligne).
- voir description du projet sur le site officiel du 7e PCRDT : http://cordis.europa.eu/projects/rcn/108695_en.html.
- communiqué de presse du ministère de la Défense : https://www.defense.gouv.fr/sante/a-la-une/une-2013/lancement-du-1er-projet-de-recherche-clinique-europeenne-phagoburn.
- essai clos, réalisé entre le et le , enregistré dans la base de données European Clinical Trials, numéro 2014-000714-65, et ClinicalTrials.gov, numéro NCT02116010 ; cité par (en) Patrick Jault, Thomas Leclerc, Serge Jennes et Jean Paul Pirnay, « Efficacy and tolerability of a cocktail of bacteriophages to treat burn wounds infected by Pseudomonas aeruginosa (PhagoBurn): a randomised, controlled, double-blind phase 1/2 trial », The Lancet Infectious Diseases, vol. 19, no 1, , p. 35–45 (ISSN 1473-3099 et 1474-4457, PMID 30292481, DOI 10.1016/S1473-3099(18)30482-1, lire en ligne, consulté le )
- (en) SCIENCE First Hand journal, « Phages Attack », SCIENCE First Hand, (lire en ligne, consulté le )
- "Collége de France, 2020, David Bikard, Institut pasteur"
- (en) Jean-Paul Pirnay, Gilbert Verbeken, Pieter-Jan Ceyssens et Isabelle Huys, « The Magistral Phage », Viruses, vol. 10, no 2, , p. 64 (DOI 10.3390/v10020064, lire en ligne, consulté le )
- (en) Letkiewicz, Sławomir, Międzybrodzki, Ryszard, Kłak, Marlena et Jończyk, Ewa, « The perspectives of the application of phage therapy in chronic bacterial prostatitis », FEMS Immunology & Medical Microbiology, vol. 60, no 2, (ISSN 0928-8244, DOI 10.1111/j.1574-695X.2010.00723.x, lire en ligne, consulté le )
- Europhages, « Notices des phagiques commercialisés et classés par fabricant », sur EuroPhages, (consulté le )
- (en) Alain Dublanchet, Anthony Smithyman, Max Liddle et Hubert Mazure, « Clinical Indications and Compassionate Use of Phage Therapy: Personal Experience and Literature Review with a Focus on Osteoarticular Infections », Viruses, vol. 11, no 1, , p. 18 (DOI 10.3390/v11010018, lire en ligne, consulté le )
- (en) Mor Shlezinger, Leron Khalifa, Yael Houri-Haddad, Shunit Coppenhagen-Glazer, Grégory Resch, Yok-Ai Que, Shaul Beyth, Elisheva Dorfman, Ronen Hazan and Nurit Beyth, « Phage Therapy: A New Horizon in the Antibacterial Treatment of Oral Pathogens », Current Topics in Medicinal Chemistry, vol. 17, no 10, (lire en ligne, consulté le )
- (en) Andrzej Górski, Magdalena Targońska, Jan Borysowski et Beata Weber-Dabrowska, « The potential of phage therapy in bacterial infections of the eye », Ophthalmologica. Journal International D'ophtalmologie. International Journal of Ophthalmology. Zeitschrift Fur Augenheilkunde, vol. 223, no 3, , p. 162–165 (ISSN 1423-0267, PMID 19155637, DOI 10.1159/000193293, lire en ligne, consulté le )
- (en) Ali Fadlallah, Elias Chelala et Jean-Marc Legeais, « Corneal Infection Therapy with Topical Bacteriophage Administration », The Open Ophthalmology Journal, vol. 9, , p. 167–168 (ISSN 1874-3641, PMID 26862360, PMCID PMC4740968, DOI 10.2174/1874364101509010167, lire en ligne, consulté le )
- « Santé urinaire : la piste des bactériophages vésicaux | Biocodex Microbiote Institut », sur www.biocodexmicrobiotainstitute.com (consulté le )
- Sciences et avenir, 25/02/2016
- Définition du biocontrôle par Sciencepresse.qc.ca.
- "Nbci, 2015:Bactériophages et phagothérapie: utilisation de virus naturels pour traiter les infections bactériennes"
- (en) Christian Willy, Felix Broecker, Karin Moelling et Karin Moelling, « A Wake-Up Call: We Need Phage Therapy Now », Viruses, vol. 10, no 12, , p. 688 (DOI 10.3390/v10120688, lire en ligne, consulté le )
- La Phagothérapie en 2017 - Une innovation Thérapeutique
- Tang, Yi-Wei,, Molecular medical microbiology, , 2216 p. (ISBN 978-0-12-397763-2, 0123977630 et 0123971691, OCLC 893680539, lire en ligne), p 569
- Marie-Céline Ray, Infections : le traitement de la dernière chance, Vergèze, Thierry Soucar Editions, , 176 p. (ISBN 978-2-36549-320-8)
- A. Dublanchet, « La phagothérapie au XXIe siècle. Deuxième partie : expérience actuelle », Antibiotiques, vol. 10, no 4, , p. 219-225 (ISSN 1294-5501, DOI 10.1016/j.antib.2008.09.001, lire en ligne, consulté le ).
- Ecole Montessori d'Antibes, « Phagothérapie et bactériophages: un remède aux antibiotiques », (consulté le )
- (en) Martha R. J. Clokie, Jakub Barylski, Fatima B. I. Vukusic et Anisha M. Thanki, « Bacteriophages are more virulent to bacteria with human cells than they are in bacterial culture; insights from HT-29 cells », Scientific Reports, vol. 8, no 1, , p. 5091 (ISSN 2045-2322, DOI 10.1038/s41598-018-23418-y, lire en ligne, consulté le )
- I. Ozkan, E. Akturk, N. Yeshenkulov et S. Atmaca, « Lytic Activity of Various Phage Cocktails on Multidrug-Resistant Bacteria », Clinical and Investigative Medicine. Medecine Clinique Et Experimentale, vol. 39, no 6, , p. 27504 (ISSN 1488-2353, PMID 27917795, lire en ligne, consulté le )
- (en) « (PDF) Comparison of in vitro lytic activities of three bacteriophage preparations Stafal, Saphylon and Pyobacteriophagum liquidum against methicillin resistant Staphylococcus aureus », sur ResearchGate (consulté le )
- (ru) « Efficacy of commercial bacteriophage products against ESKAPE pathogens », sur vestnik.rsmu.press (consulté le )
- (en) J. Glenn Morris, Zemphira Alavidze et Alexander Sulakvelidze, « Bacteriophage Therapy », Antimicrobial Agents and Chemotherapy, vol. 45, no 3, , p. 649–659 (ISSN 1098-6596 et 0066-4804, PMID 11181338, PMCID PMC90351, DOI 10.1128/AAC.45.3.649-659.2001, lire en ligne, consulté le )
- Archivum Immunologiae et Therapiae Experimentalis, Springer Nature, (lire en ligne)
- Elizabeth Kutter, Daniel De Vos, Guram Gvasalia et Zemphira Alavidze, Phage Therapy in Clinical Practice : Treatment of Human Infections, vol. 11, (lire en ligne)
- Stephen T Abedon, « Phage therapy of pulmonary infections », Bacteriophage, vol. 5, no 1, (ISSN 2159-7073, PMID 26442188, PMCID PMC4422798, DOI 10.1080/21597081.2015.1020260, lire en ligne, consulté le )
- Vera V. Morozova, Valentin V. Vlassov et Nina V. Tikunova, « Applications of Bacteriophages in the Treatment of Localized Infections in Humans », Frontiers in Microbiology, vol. 9, (ISSN 1664-302X, PMID 30116226, PMCID PMC6083058, DOI 10.3389/fmicb.2018.01696, lire en ligne, consulté le )
- PLACE DE LA PHAGOTHERAPIE DANS LE TRAITEMENT DES INFECTIONS OSTEOARTICULAIRES BACTERIENNES
- La phagothérapie aux Hospices civils de Lyon
- Les phages, traitement de la dernière chance pour Monsieur P., AFP / La Croix le 20/03/2019
- ANSM, COMITE SCIENTIFIQUE SPECIALISE TEMPORAIRE PHAGOTHERAPIE, (lire en ligne), p. 7
- « Dax : elle devait se faire amputer de la jambe, elle est sauvée par un virus », sur SudOuest.fr (consulté le )
- PHAGOBURN : des virus pour traiter des infections bactériennes
- Bactériophages et phagothérapie: utilisation de virus naturels pour traiter les infections bactériennes F. Ravat, P. Jault et J. Gabard
- Europhages, « Se traiter avec des bactériophages », sur EuroPhages, (consulté le )
- Compte rendu de séance du CSST Phagothérapie en date du 24 mars 2016
- (en) « Compassionate use | European Medical Agency », sur ema.europa.eu
- (en) Agence Médicale Européenne - Comité pour les produits médicaux à usage humain, GUIDELINE ON COMPASSIONATE USE OF MEDICINAL PRODUCTS, PURSUANT TOARTICLE 83 OF REGULATION (EC) No 726/2004 (lire en ligne), page 4
- « Demande d'autorisation d’accès compassionnel - ANSM », sur ansm.sante.fr (consulté le )
- « Actualité - Phagothérapie : l’ANSM autorise un accès compassionnel pour des bactériophages dans les infections ostéo-articulaires - ANSM », sur ansm.sante.fr (consulté le )
- Code de la santé publique : Article L5121-1 (lire en ligne)
- « Décision DG no 2016-11 du 13/01/2016 - Création CSST Phagothérapie - ANSM : Agence nationale de sécurité du médicament et des produits de santé », sur ansm.sante.fr (consulté le )
- Libre Journal des Sciences et des Techniques de Paul Deheuvels - Partie 2 - Minute 37 [Radio], Dr Alain Dublanchet () Paris : Radio Courtoisie.
- Colomb-Cotinat M, Lacoste J, Coignard B, Vaux S, Brun-Buisson C et Jarlier V, « Morbidité et mortalité des infections à bactéries multi-résistantes aux antibiotiques en France en 2012 : Etude Burden BMR, rapport - Juin 2015 », sur avibep.org, (consulté le ).
- « PROPOSER », sur AVIBEP - Phagothérapie (consulté le )
- (en) Daniel Lauster, Simon Klenk, Kai Ludwig et Saba Nojoumi, « Phage capsid nanoparticles with defined ligand arrangement block influenza virus entry », Nature Nanotechnology, , p. 1–7 (ISSN 1748-3395, DOI 10.1038/s41565-020-0660-2, lire en ligne, consulté le )
- (en-US) « Influenza and Coronavirus Demise Could Lie with Phage Nanoparticles », sur GEN - Genetic Engineering and Biotechnology News, (consulté le )
- (en) Sergey Gazeev, « Applications of Phage Therapy in Veterinary Medicine », Faculty of Veterinary Medicine and Animal Science - examensarbete för kandidatexamen, (lire en ligne)
- (en) Anne Bruttin et Harald Brüssow, Antimicrobial Agents and Chemotherapy, vol. 49, no 7, , p. 2874-2878 (ISSN 0066-4804 et 1098-6596), DOI10.1128/AAC.49.7.2874-2878.2005, [lire en ligne].
- Mathieu J, Yu P, Zuo P, Da Silva M.L & Alvarez P.J (2019) Going Viral : Emerging Opportunities for Phage-Based Bacterial Control in Water Treatment and Reuse. Accounts of chemical research, 52(4), 849-857. URL: https://www.researchgate.net/profile/Pingfeng_Yu/publication/332088709_Going_Viral_Emerging_Opportunities_for_Phage-Based_Bacterial_Control_in_Water_Treatment_and_Reuse/links/5ca23612299bf11169556090/Going-Viral-Emerging-Opportunities-for-Phage-Based-Bacterial-Control-in-Water-Treatment-and-Reuse.pdf
- AVIS de l’Anses relatif à l’utilisation des phages dans les denrées alimentaires d’origine animale pour lutter contre les Listeria
- (en) Sulakvelidze, A., « Using lytic bacteriophages to eliminate or significantly reduce contamination of food by foodborne bacterial pathogens: Bacteriophages and food safety », J. Sci. Food Agric., 2013 oct, Vol 93 Issue 13 p 3137-46 (DOI 10.1002/jsfa.6222, lire en ligne)
- Application of a phage in decontaminating Vibrio parahaemolyticus in oysters. Zhang H, Yang Z, Zhou Y, Bao H, Wang R, Li T, Pang M, Sun L, Zhou X.
- Application of Bacteriophages in the Agro-Food Sector: A Long Way Toward Approval Lucía Fernández, Diana Gutiérrez, Ana Rodríguez, and Pilar García
- Utilisation des bactériophages pour le contrôle de Staphylococcus aureus dans les produits laitiers
- LA PHAGOTHÉRAPIE : HISTORIQUE ET POTENTIELLE UTILISATION CONTRE LES INFECTIONS À BACTÉRIES MULTIRÉSISTANTES THÈSE Pour le DOCTORAT VÉTÉRINAIRE FACULTÉ DE MÉDECINE DE CRÉTEIL 30 janvier 2014 Magali, Christiane, Elisabeth BERGER SAVIN
- Phagothérapie: concept et modèles animaux Laurent Debarbieux
- Les bactériophages, un large potentiel d’applications Société Lesaffre
- Applications of Phage Therapy in Veterinary Medicine Sergey Gazeev Department of Biomedical Sciences and Veterinary Public Health Swedish University of Agricultural Sciences
- Phagothérapie : une alternative à l’antibiothérapie ? Alessia Carminati, Nadia Kerkour, Claudia Landry, Brian Lopes Lourenço, Florence Meyer Rev Med Suisse 2016; volume 12. 1676-1677
- Phages: a special force to fight bacteria! When antibiotics fail, bacteriophages could come to our rescue Saara Töyssy UPM Janvier 2019
- 1st German Phage Symposium—Conference Report Irene Huber, Katerina Potapova, Andreas Kuhn, Herbert Schmidt, Jörg Hinrichs, Christine Rohde, and Wolfgang Beyer
- Rebekah M. Dedrick et al., "Engineered bacteriophages for treatment of a patient with a disseminated drug-resistant Mycobacterium abscessus", Nature Medicine volume 25, p. 730–733 (2019)
- Bacterial Infections: Characteristics, Types and Treatment, Edition: 1rst, Chapter: Antimicrobial Applications of Phages, Publisher: Nova Publishers, Editors: Leo F. Delgado and Maria J. Vega, pp.pp. 69-87
- Phages in the Human Body Ferran Navarro and Maite Muniesa Front. Microbiol., 04 April 2017
- Des papiers d'emballage tueurs de bactérie Journal de Montréal 2015
- Colomb-Cotinat M, Lacoste J, Coignard B, Vaux S, Brun-Buisson C et Jarlier V, « Morbidité et mortalité des infections à bactéries multi-résistantes aux antibiotiques en France en 2012 : Etude Burden BMR, rapport - juin 2015 », sur avibep.org, (consulté le ).
- « Le Lien - L'association : Le Sénat fait le point sur la phagothérapie ( publication mars 2019) », sur lelien-association.fr (consulté le )
- « Qui sommes-nous? », sur Association PHAG ESPOIRS (consulté le )
- « Qui sommes nous ? », sur Phelix Research & Development (consulté le )
- « PHELIX FRANCE », sur www.net1901.org (consulté le )
Voir aussi
Publications récentes en français
- Debarbieux L. Dublanchet A. et Patay O. Infection bactérienne : quelle place pour la phagothérapie ? Compte Rendu des organisateurs. Médecine et Maladies Infectieuses, 2008. 38(8):407-9.
- Dublanchet A. La phagothérapie au XXIe siècle. Première partie : que pourrait-elle apporter aujourd’hui ? Antibiotiques, 2008. 10(4):209-18.
- Dublanchet A. La phagothérapie au XXIe siècle. Deuxième partie : expérience actuelle. Antibiotiques, 2008. 10(4):219-25.
- Dufour-Gaume, Frédérique. De l'utilisation des bactériophages comme traitement anti-bactérien. Applications au Service de Santé des Armées, Presses Académiques Francophones, 2012, 156 p. (ISBN 978-3-8381-8827-0)
- Riche Paul-Hervé. Manuel de phagothérapie pratique à l'usage des médecins du XXIe Siècle, 2013, 272 p. (ISBN 978-2954488509)
- Samuel Alizon, C'est grave Dr Darwin ? L'évolution, les microbes et nous, 2016, Le Seuil (ISBN 2021102920)
- Laurent Debarbieux, « La phagothérapie ou soigner avec les virus », Pour la Science, no 469, , p. 92-97.
Publications en anglais
- Abedon ST. Bacteriophage Ecology: Population Growth, Evolution, and Impact of Bacterial Viruses (Advances in Molecular and Cellular Microbiology) Vol. 53. 2008, Cambridge, UK.: Cambridge University Press.
- McGrath, S. and D. van Sinderen, eds. Bacteriophage: Genetics and Molecular Biology. 2007, Caister Academic Press: Department of Microbiology, and Alimentary Pharmabiotic Centre, University College Cork, Ireland. 344.
- Summers, W.C., History of Phage Research and Phage Therapy, in Phages: Their Role in Bacterial Pathogenesis and Biotechnology, M.K. Waldor, D.I. Friedman, and S.L. Adhya, Editors. 2005, ASM Press: Washington, DC. p. 3-17.
- Kutter, E. and A. Sulakvelidze, Bacteriophages – Biology and applications. 2004, Boca Raton, FL: CRC Press.
- Levin BR, Bull JJ (2004) Population and evolutionary dynamics of phage therapy. Nat. Rev. Microbiol. 2:166-73
Articles connexes
Liens externes
- Virus contre bactéries, une solution à la crise des antibiotiques ? (Arté)
- Des virus qui sauvent des vies (Arté)
- Bactéries résistantes : des virus au secours des malades ? (Radio Télévision Suisse)
- Des virus génétiquement modifiés viennent à bout d’une bactérie résistante pourlascience.fr 9 juillet 2019.
- Portail de la médecine
- Portail de la virologie