Phosphite de triéthyle
Le phosphite de triéthyle est un composé organophosphoré de la famille des esters de phosphite, de formule C6H15O3P. C'est l'ester triéthylique de l'acide phosphoreux. Il est utilisé comme ligand en chimie organométallique et comme réactif en synthèse organique.
| Phosphite de triéthyle | ||
3.png.webp)
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom systématique | phosphite de triéthyle | |
| Synonymes |
triéthoxyphosphine |
|
| No CAS | ||
| No ECHA | 100.004.139 | |
| No RTECS | TH 1130000 | |
| PubChem | 31215 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore malodorant[1] | |
| Propriétés chimiques | ||
| Formule | C6H15O3P |
|
| Masse molaire[2] | 166,155 3 ± 0,006 8 g/mol C 43,37 %, H 9,1 %, O 28,89 %, P 18,64 %, |
|
| Propriétés physiques | ||
| T° fusion | −112 °C[1] | |
| T° ébullition | 156 °C[1] | |
| Solubilité | décomposition violente dans l'eau[1] | |
| Masse volumique | 0,96 g cm−3 (20 °C)[1] | |
| Densité de vapeur | 5,74[1] | |
| Densité du mélange vapeur-air | 1,02[1] | |
| T° d'auto-inflammation | 250 °C[1] | |
| Point d’éclair | 44 °C[1] | |
| Limites d’explosivité dans l’air | 3,75 - 42,5 vol.%[1] | |
| Pression de vapeur saturante | 4,09 hPa (20 °C) 7,42 hPa (30 °C) 12,9 hPa (40 °C) 21,5 hPa (50 °C)[1] |
|
| Viscosité dynamique | 1 mPa·s (20 °C)[1] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,4127 (20 °C)[3] | |
| Précautions | ||
| SGH[1] | ||
  |
||
| Transport | ||
| Écotoxicologie | ||
| DL50 | 3 720 mg kg−1 (souris, oral)[4] 1 840 mg kg−1 (rat, oral)[4] 2 800 mg kg−1 (lapin, dermique)[4] |
|
| CL50 | 6 203 mg/m3 par 6 heures (souris, inhalation)[4] 11 063 mg/m3 par 6 heures (rat, inhalation)[4] |
|
| LogP | 0,740[5] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Propriétés
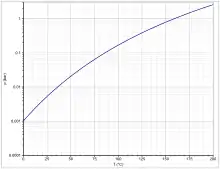
Le phosphite de triéthyle est un liquide incolore malodorant[1]. Son point d'ébullition à une pression de 1 013 hPa est de 158 °C, à une pression réduite de 19 hPa il est de 54 °C[6]. Sa pression de vapeur est donnée par l'équation d'Antoine log10(P) = A-(B/(T+C)) (P en Torr, T en °C) avec A = 7,2, B = 1 683 et C = 230 dans la plage de température de 20 à 156 °C[7]. C'est un liquide peu voire très peu volatil[1].
C'est un liquide inflammable dont les vapeurs peuvent former un mélange hautement inflammable et explosif au-dessus de son point d'éclair (44 °C)[1]. Ses limites d'explosivité dans l'air se situent à 3,75 % en volume (LIE) et 42,5 % en volume (LSE)[1],[6]. Sa température d'auto-inflammation est de 250 °C, ce qui le met dans la classe de température T3[1].
Le phosphite de triéthyle se décompose chauffé au dessus de 260 °C, dégageant des oxydes de phosphore, de l'éthanol et de la phosphine[1]. Il se décompose également violemment au contact de l'eau[1]. Il réagit également dangereusement avec les oxydants, et présente un risque d'explosion en contact avec le perchlorate de magnésium[1] (généralement utilisé comme dessicant), avec qui il forme du perchlorate d'éthyle[8].
La molécule présente une géométrie pyramidale trigonale autour du phosphore(III) lié aux trois groupes éthoxyle. Son spectre RMN du 31P présente un déplacement de +139 ppm par rapport à l'acide phosphorique standard.
Synthèse
Le phosphite de triéthyle peut être produit par la réaction du trichlorure de phosphore avec l'éthanol en présence d'une base, typiquement une amine tertiaire[9] :
- PCl3 + 3 C2H5OH + 3 R3N → P(OC2H5)3 + 3 R3NH+Cl−
En absence de base, la réaction produit le phosphite de diéthyle ((C2H5O)2P(O)H). De nombreux composés peuvent être préparés de façon similaire, par exemple le phosphite de triisopropyle.
Utilisation
Le phosphite de triéthyle est utilisé comme matière première dans la production industrielle de l'insecticide chlorfenvinphos.
En chimie organique, il est souvent utilisé pour la synthèse d'alcènes, d'alcynes, de déshydrodimères et d'hétérocycles azotés à partir de composés nitro aromatiques. La réaction de Michaelis-Arbuzov peut être utilisée pour produire des phosphonates, et la réaction de Perkow des phosphates de vinyle. Dans la synthèse de Corey-Winter permettant de préparer de alcènes à partir de 1,2-diols, le phosphite de triéthyle sert d'agent de désulfuration[6].
Ligand
En chimie des complexes et en catalyse homogène, le phosphite de triéthyle est utilisé comme ligand mou. Ses complexes sont généralement lipophiles et contiennent des métaux à des états d'oxydation peu élevés. On peut citer par exemple les complexes incolores FeH2(P(OEt)3)4 et Ni(P(OEt)3)4[10].
Certains de ces composés sont utilisés comme catalyseurs d'isomérisation[6].
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Triethyl phosphite » (voir la liste des auteurs) et en allemand « Triethylphosphit » (voir la liste des auteurs).
- Entrée « Triethylphosphite » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 avril 2020 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 90e éd., 2804 p. (ISBN 9781420090840, présentation en ligne), p. 498
- Acute Toxicity Data, Journal of the American College of Toxicology, Part B., vol. 1, p. 218, 1992.
- Fiche (en) « Phosphite de triéthyle », sur ChemIDplus (consulté le 17 avril 2020)
- (de) Entrée Triethylphosphit sur Römpp Online. Georg Thieme Verlag, consultée le 19 juin 2014.
- E. Brandes et W. Möller, Sicherheitstechnische Kenngrößen - Band 1: Brennbare Flüssigkeiten und Gase, Bremerhaven, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH,
- Roth/Weller, Gefährliche Chemische Reaktionen, ecomed SICHERHEIT, Verlagsgruppe Hüthig Jehle Rehm GmbH, Ausgabe 08/2011.
- A. H. Ford-Moore et B. J. Perry, « Triethyl Phosphite », Org. Synth., vol. 31, , p. 111 (DOI 10.15227/orgsyn.031.0111)
- Steven D. Ittel, « Complexes of Nickel(0) », Inorganic Syntheses, vol. 28, , p. 98–104 (ISBN 978-0-470-13259-3, DOI 10.1002/9780470132593.ch26)
- Portail de la chimie
