Géométrie moléculaire pyramidale trigonale
En chimie, une géométrie moléculaire pyramidale trigonale est la géométrie des molécules où un atome central, noté A, est lié à trois atomes, groupes d'atomes ou ligands, notés X, aux sommets de la base d'une pyramide trigonale, avec un doublet non liant, noté E, sur l'atome central. Ces composés appartiennent à la classe AX3E1 selon la théorie VSEPR.
| Géométrie moléculaire pyramidale trigonale | |

| |
| Notation VSEPR | AX3E1 |
|---|---|
| Exemple(s) | NH3, PCl3, XeO3 |
| Symétrie moléculaire | C3v |
| Nombre stérique | 4 |
| Coordinence | 3 |
| Doublet non liant | 1 |
| Angle de liaison | ≈107° |
Quand tous les trois atomes de la base sont identiques, sa symétrie moléculaire est C3v.
On peut citer parmi les molécules à géométrie moléculaire pyramidale trigonale l'ammoniac (NH3), le trioxyde de xénon (XeO3), l'ion chlorate (ClO3−) et l'ion sulfite (SO32−). En chimie organique, les molécules ayant ce genre de géométrie sont parfois décrit comme hybride sp3.

Géométrie pyramidale trigonale dans l'ammoniac
Dans l'ammoniac, l'atome d'azote est lié à trois atomes d'hydrogène avec lesquels il partage trois de ses cinq électrons de valence et en reçoit en retour un de chaque hydrogène, ce qui lui permet de suivre la règle de l'octet. Ceci aboutirait en théorie à la formation d'un tétraèdre régulier avec un atome à chaque sommet et des angles de liaison d'environ 109,5°. Cependant, les trois atomes d'hydrogène sont repoussés par le doublet non liant formé par les deux derniers électrons de valence de l'azote, conduisant à la formation d'une pyramide déformée avec des angles de liaison de 107°. Par contraste, le trifluorure de bore est plat, adoptant une géométrie moléculaire trigonale plan, puisque le bore ne possède pas de doublet non-liant.
Dans l'ammoniac, la pyramide trigonale peut subir une rapide inversion de l'azote[1].
 Représentation de l'ammoniac sous forme « tétraédrique » avec son doublet non-liant : ce doublet est représenté en jaune, les atomes d'hydrogène en blanc.
Représentation de l'ammoniac sous forme « tétraédrique » avec son doublet non-liant : ce doublet est représenté en jaune, les atomes d'hydrogène en blanc.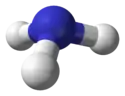 Représentation de l'ammoniac sans son doublet non-liant, soulignant sa géométrie pyramidale trigonale.
Représentation de l'ammoniac sans son doublet non-liant, soulignant sa géométrie pyramidale trigonale.
Notes et références
- C. E. Cleeton & N. H. Williams, 1934 - Online version; archive. URL last accessed 8 May 2006
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Trigonal pyramidal molecular geometry » (voir la liste des auteurs).