Potentialisation à long terme
En neurosciences, la potentialisation à long terme (PLT) est un renforcement persistant des synapses basé sur les derniers patrons d'activité.
Pour les articles homonymes, voir PLT.
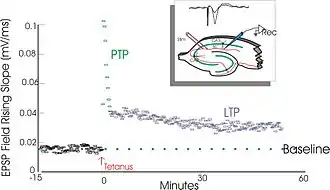
Ces derniers produisent une augmentation durable du taux de transmission du signal entre deux neurones[2]. L'opposé de la PLT est la DLT (dépression synaptique à long terme).
C'est l'un des nombreux phénomènes qui sous-tendent la plasticité synaptique, la capacité des synapses chimiques à modifier leur force. Dans la mesure où les souvenirs sont supposés être encodés par la modification de la force synaptique[3], la PLT est généralement considérée comme l'un des mécanismes cellulaires majeurs qui sous-tendent l'apprentissage et la mémoire.
La PLT a été découverte au niveau de l'hippocampe du lapin par Terje Lømo en 1966 et elle demeure depuis un sujet de recherche populaire. De nombreuses études modernes de la PLT visent à mieux comprendre ses mécanismes biologiques, tandis que d'autres visent à établir un lien de causalité entre la PLT et l'apprentissage comportemental. D'autres études encore tentent de développer des méthodes, pharmacologiques ou autres, permettant de renforcer la PLT afin d'améliorer l'apprentissage et la mémoire. La PLT est également un sujet de recherche clinique, par exemple, dans les domaines de la maladie d'Alzheimer et de la médecine de l'addiction.
Histoire
Premières théories de l'apprentissage

À la fin du XIXe siècle, les scientifiques considéraient généralement que le nombre de neurones dans le cerveau adulte (environ 100 milliards[4]) n'augmentait pas de façon significative avec l'âge, donnant aux neurobiologistes de bonnes raisons de croire que les souvenirs n'étaient généralement pas le résultat de la production de nouveaux neurones[5]. De ce principe est née la nécessité d'expliquer comment de nouveaux souvenirs pouvaient se former en l'absence de la formation de nouveaux neurones.
Le neuroanatomiste espagnol Santiago Ramón y Cajal a été parmi les premiers à proposer un mécanisme d'apprentissage qui ne nécessite pas la formation de nouveaux neurones. Dans sa Croonian Lecture de 1894, il a proposé que les souvenirs puissent à la place être formés par le renforcement de connexions existantes entre neurones, de telle sorte à améliorer l'efficacité de leur communication. La Règle de Hebb, introduite par Donald Hebb en 1949 en écho des idées de Ramón y Cajal, propose en outre que les cellules puissent développer de nouvelles connexions ou subir des changements métaboliques qui améliorent leur capacité à communiquer :
« Let us assume that the persistence or repetition of a reverberatory activity (or trace) tends to induce lasting cellular changes that add to its stability… When an axon of cell A is near enough to excite a cell B and repeatedly or persistently takes part in firing it, some growth process or metabolic change takes place in one or both cells such that A's efficiency, as one of the cells firing B, is increased[6]. »
Bien que ces théories de la formation de la mémoire soient désormais bien établies, elles étaient visionnaires pour leur époque : à la fin du 19e et au début du XXe siècle, les neuroscientifiques et les psychologues ne disposaient pas des techniques neurophysiologiques nécessaires pour élucider les fondements biologiques de l'apprentissage chez les animaux. Ces compétences ne viendraient pas avant la seconde moitié du XXe siècle, à peu près en même temps que la découverte de la potentialisation à long terme.
Découverte
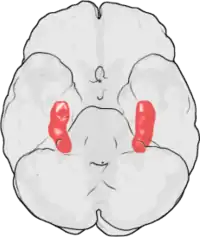
La PLT a été observée pour la première fois par Terje Lømo en 1966 à Oslo (Norvège), dans le laboratoire de Per Andersen[7],[8]. Lømo y conduisit une série d'expériences neurophysiologiques sur des lapins anesthésiés pour explorer le rôle de l'hippocampe dans la mémoire à court terme.
Les expériences de Lømo se focalisaient sur les connexions, ou synapses, allant de la voie perforante au gyrus denté. Ces expériences ont été réalisées en stimulant des fibres pré-synaptiques de la voie perforante et en enregistrant les réponses d'une collection de cellules post-synaptiques du gyrus denté. Comme attendu, une seule stimulation par impulsion électrique des fibres de la voie perforante causait des potentiels postsynaptiques excitateurs (PPSE) dans les cellules du gyrus denté. Ce que Lømo a observé, mais cette fois-ci de manière inattendue, c'est que la réponse des cellules post-synaptiques à ces stimuli revenant à une impulsion unique pouvait être augmentée pour une longue période de temps s'il appliquait d'abord un train de stimuli à haute fréquence aux fibres pré-synaptiques. Quand un tel train de stimuli était appliqué, des stimuli suivants à impulsion unique élicitaient des PPSE forts et prolongés dans la population des cellules post-synaptiques. Ce phénomène, par lequel un stimulus de haute fréquence peut produire une augmentation durable de la réponse des cellules post-synaptiques à des stimuli par impulsion unique ultérieures, a d'abord été appelé « potentialisation de longue durée »[9],[10].
Timothy Bliss, qui a rejoint le Laboratoire Andersen en 1968, a collaboré avec Lømo et, en 1973, les deux chercheurs ont publié la première caractérisation de la potentialisation de longue durée au niveau de l'hippocampe du lapin. Bliss et Tony Gardner-Medwin ont publié un rapport similaire sur la potentialisation à longue durée chez l'animal éveillé dans le même numéro que le rapport de Bliss et Lømo. En 1975, Douglas et Goddard ont proposé « potentialisation à long terme » comme nouveau nom pour le phénomène de potentialisation de longue durée[11],[12]. Andersen a suggéré que les auteurs ont choisi « potentialisation à long terme », peut-être en raison de la facilité qu'il y a à prononcer l'acronyme PLT[13].
Modèles et théories

Les mécanismes biologiques et physiques de la PLT ne sont pas encore totalement compris, mais certains modèles cohérents ont été développés. Des études des épines dendritiques, les excroissances des dendrites des neurones qui croissent et se rétractent physiquement au cours des minutes ou des heures, ont suggéré une relation entre la résistance électrique de l'épine et la force effective de la synapse, en raison de leurs liens avec les transits intracellulaires du calcium. D'autres modèles mathématiques tels que la BCM Theory, qui dépend également du calcium intracellulaire en relation avec les récepteurs tensiodépendants NMDA, ont été développés depuis les années 1980 et ont modifié le traditionnel modèle de l'apprentissage a priori de Hebb avec à la fois des justifications biologiques et expérimentales. D'autres encore ont proposé de revoir ou de synchroniser la relation entre la régulation des récepteurs, la PLT, et de la force synaptique[14].
Types
Depuis sa découverte dans l'hippocampe du lapin, la PLT a été observée dans beaucoup d'autres structures cérébrales, y compris dans le cortex cérébral, le cervelet et l'amygdale[15]. Robert Malenka, un chercheur de référence dans le domaine de la PLT, a même suggéré que la PLT pouvait se produire au niveau de toutes les synapses excitatrices du cerveau des mammifères[16].
Les différentes zones du cerveau présentent différentes formes de PLT. Le type spécifique de PLT présente entre des neurones dépend d'un certain nombre de facteurs. L'un de ces facteurs est l'âge de l'organisme lorsque la PLT est observée. Par exemple, les mécanismes moléculaires de la PLT dans un hippocampe immature diffèrent des mécanismes qui sous-tendent la PLT dans un hippocampe adulte[17]. Les voies de signalisation utilisées par une cellule en particulier contribuent également au type spécifique de PLT présente. Par exemple, certains types de PLT hippocampique dépendent des récepteurs NMDA, d'autres dépendent des récepteurs métabotropiques du glutamate (mGluR), tandis que d'autres dépendent d'une toute autre molécule. La variété des voies de signalisation qui contribuent à la PLT et la large distribution de ces différentes voies dans le cerveau sont les raisons pour lesquelles le type de PLT présente entre des neurones dépend en partie de l'emplacement anatomique dans lequel la PLT est observée. Par exemple, la PLT dans la voie collatérale de Schaffer de l'hippocampe est dépendante des récepteurs NMDA, alors que la PLT dans les fibres moussues est indépendante des récepteurs NMDA[18].
L'activité pré - et post-synaptiques requises pour induire la PLT sont d'autres critères de classification de la PLT. Globalement, cela permet la classification de la PLT en mécanisme Hebbien, non Hebbien, et anti-Hebbien. Empruntant son nom au postulat de Hebb, résumé par la maxime selon laquelle « des neurones qui s'activent en même temps sont des neurones qui sont connectés ensemble » (« cells that fire together wire together »), la PLT Hebbienne nécessite une dépolarisation pré - et post-synaptique simultanée pour être induite[19]. La PLT Non Hebbienne est un type de PLT qui ne nécessite pas une telle dépolarisation pré - et post-synaptique simultanée des cellules ; un bon exemple de ce type de PLT se produit dans la voie des fibres moussues de l'hippocampe[20]. Un cas particulier de PLT non-Hebbienne, la PLT anti-Hebbienne, requiert explicitement et simultanément une dépolarisation pré-synaptique et une relative hyperpolarisation post-synaptique pour être induite[21].
En raison de son organisation prédictible et de sa sensibilité à l'induction de la PLT, la région CA1 de l'hippocampe est devenue le site prototypique de l'étude de la PLT chez les mammifères. En particulier, la PLT dépendante des récepteurs NMDA au niveau de la région CA1 de l'hippocampe adulte est le type de PLT le plus largement étudié et est donc l'objet central de cet article.
Propriétés
La PLT dépendante des récepteurs NMDA présente plusieurs propriétés, y compris la spécificité, l'associativité, la coopérativité, et de la persistance.
- La spécificité
Le phénomène de PLT ne sera observable que sur le circuit sollicité, c’est-à-dire la voie ayant reçu une stimulation à haute fréquence. Autrement dit, le changement d'efficacité synaptique du circuit sollicité ne se propage pas aux voies convergentes non sollicitées par la stimulation à haute fréquence. Par ailleurs, la potentialisation à long terme ne se propage qu'aux synapses qui répondent aux règles de l'associativité et de la coopérativité. Un modèle pour expliquer la spécificité d'entrée de la PLT a été présenté par Frey et Morris en 1997 et est appelé l'hypothèse de marquage et de capture synaptique.[réf. nécessaire]
- L'associativité
L'associativité réfère à l'observation que lorsqu'une stimulation faible appliquée à une voie unique est insuffisante pour induire une PLT, une forte stimulation simultanée d'une autre voie va induire une PLT dans les deux voies.[réf. nécessaire]
- La coopérativité
La PLT peut être induite soit par la forte stimulation tétanique d'une voie unique vers une synapse, ou coopérativement via la faible stimulation de nombreuses voies. Quand une voie vers une synapse est stimulée faiblement, cela produit une dépolarisation post-synaptique insuffisante pour induire la PLT. En revanche, lorsque des stimuli faibles sont appliquées à de nombreuses voies qui convergent sur un seul patch de membrane postsynaptique, les dépolarisations individuelles post-synaptique générées peuvent collectivement dépolariser la cellule post-synaptique, suffisamment pour induire coopérativement une PLT. Le marquage synaptique, qui sera discuté plus bas, pourrait être un mécanisme commun sous-tendant l'associativité et la coopérativité. Bruce McNaughton fait valoir que toute différence entre l'associativité et la coopérativité est strictement sémantique[22].
- La persistance
La PLT est persistante, durant de quelques minutes à plusieurs mois, et c'est cette persistance qui sépare la PLT d'autres formes de plasticité synaptique[23].
Phase précoce
Maintien
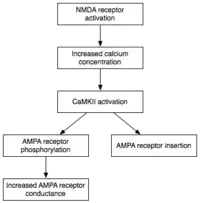
Alors que l'induction implique une activation transitoire de la CaMKII et de la protéine kinase C (PKC), le maintien de l'E-LTP (Early-LTP PLT précoce) est caractérisée par leur activation persistante. Au cours de cette étape, la PKMz (Protéine kinase Mz) qui est calcium-indépendante, devient active de façon autonome. Par conséquent, elles sont en mesure de mener à bien les événements de phosphorylation qui sous-tendent de l'expression de la E-LTP.
Expression
La phosphorylation est une réaction chimique dans laquelle un petit groupe phosphate est ajouté à une autre molécule permettant un changement de son activité. Une CaMKII et PKC activées utilisent la phosphorylation afin de mener les deux principaux mécanismes sous-jacents à l'expression de la E-LTP. Tout d'abord, et surtout, elles phosphorylent récepteurs AMPA existant pour augmenter leur activité. Deuxièmement, ils servent de médiateurs ou de modulateur d'insertion de récepteurs AMPA supplémentaires au niveau de la membrane postsynaptique. Surtout, la livraison des récepteurs AMPA à la synapse au cours du E-LTP est indépendante de la synthèse des protéines. Ceci est réalisé par la présence d'un pool non-synaptique des récepteurs AMPA adjacente à la membrane postsynaptique. Quand un stimulus capable d'induire une PTL arrive, les récepteurs AMPA non-synaptiques sont rapidement acheminés vers la membrane postsynaptique sous l'influence de protéines kinases[25]. Comme mentionné précédemment, les récepteurs AMPA sont les récepteurs du glutamate les plus abondant du cerveau et qui médient de la majorité de son activité excitatrice. Par l'augmentation de l'efficacité et du nombre de récepteurs AMPA au niveau des synapses, les prochains stimuli excitateurs vont générer une réponse post-synaptique plus importante.
Bien que le modèle ci-dessus de E-LTP décrit entièrement les mécanismes post-synaptiques pour l'induction, l'entretien, et de l'expression, un élément supplémentaire de l'expression peut se produire en présynaptique[26]. Une hypothèse de cette facilitation présynaptique est que la persistance de l'activité de CaMKII dans la cellule post-synaptique au cours de E-LTP peut conduire à la synthèse d'un « messager rétrograde ». Selon cette hypothèse, le nouvellement synthétisé messenger voyage à travers la fente synaptique de la cellule post-synaptique à la cellule présynaptique, conduisant à une chaîne d'événements qui facilitent la réponse présynaptique à des stimuli ultérieurs. De tels événements peuvent inclure une augmentation dans le nombre de vésicules de neurotransmetteurs, la probabilité de libération des vésicules, ou les deux. En plus de l'action du messager rétrograde à l'expression présynaptique de la phase précoce de PLT, ce dernier peut également jouer un rôle dans l'expression de la phase tardive de la PLT.
La phase tardive
La phase tardive de la PLT (en anglais Late LTP ou L-LTP) est le prolongement naturel de l'E-LTP. Contrairement à l'E-LTP, qui est indépendant de la synthèse des protéines, de la L-LTP nécessite la transcription du gène[27] et de la synthèse des protéines[28] dans la cellule post-synaptique. Il existe deux phases de la L-LTP : la première dépend de la synthèse des protéines, tandis que la seconde dépend à la fois de la transcription des gènes et la synthèse des protéines. Ces phases sont parfois appelés LTP2 et LTP3, respectivement, avec E-LTP dénommé LTP1 sous cette nomenclature.
Induction
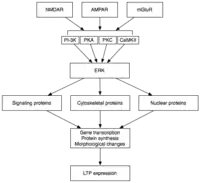
La phase tardive de la PLT est induite par des changements dans l'expression des gènes et la synthèse des protéines apportées par la persistance de l'activation de protéines kinases activées au cours de E-LTP, tels que les MAPK. En fait, MAPK, et plus précisément la extracellular signal-regulated kinase (ERK) (sous-famille des Mapk), peut-être le lien moléculaire entre les E-LTP et la L-LTP, puisque de nombreuses cascades de signalisation impliqués dans l'E-LTP (y compris la CaMKII et de la PKC), peuvent converger sur ERK.
La recherche récente a montré que l'induction de la L-LTP peut dépendre d'événements moléculaires coïncidant, à savoir l'activation de la PKA et l'influx de calcium, qui convergent sur CRTC1 (TORC1) : un puissant coactivateur transcriptionnel pour cAMP response élément binding protein (CREB)[29]. Cette exigence pour une coïncidence moléculaire va parfaitement pour la nature associative de la PLT, et, sans doute, pour l'apprentissage.
Maintenance
Au moment de l'activation de ERK peut phosphoryler un certain nombre de molécules cytoplasmiques et nucléaires qui aboutissent à la synthèse des protéines et des changements morphologiques observés dans la L-LTP. Ces molécules peuvent inclure des facteurs de transcription tels que CREB. Les changements médiés par ERK dans l'activité de facteur de transcription peut déclencher la synthèse de protéines qui sous-tendent le maintien de la L-LTP. Une telle molécule peut être la protéine kinase Mz (PKMz), la persistance de la kinase active dont la synthèse augmente à la suite de l'induction de la PLT[30],[31].
PKMz est une isoforme de la PKC atypique qui n'a pas de sous-unité régulatrice et reste donc constitutivement active. Contrairement à d'autres kinases qui interviennent dans PLT, PKMz est active non seulement dans les 30 premières minutes après l'induction de la PLT. Plutôt, PKMz ne devient une exigence pour la maintenance de PLT de que durant la phase tardive de la PLT.
PKMz apparaît donc importante pour la persistance de la mémoire et donc devrait jouer un rôle important dans le maintien de la mémoire à long terme. En effet, l'administration d'un inhibiteur de PKMz dans l'hippocampe du rat entraina une l'amnésie rétrograde avec une mémoire à court terme qui resta intacte (PKMz ne joue pas un rôle dans l'établissement de la mémoire à court terme). Mais encore plus récemment : des souris transgéniques dépourvues de PKMz ont démontré une PLT qui est normale, remettant en cause la nécessité de PKMz[32]
La stabilisation à long terme des changements synaptiques est également déterminée par une augmentation parallèle de structures pré - et post-synaptiques telles que les boutons axonaux, des épines dendritiques et la densité post-synaptique[33]. Au niveau moléculaire, une corrélation entre une augmentation des protéines d'échafaudage post-synaptique PSD-95 et Homer1c et la stabilisation de l'élargissement synaptique a été mis en évidence.
Expression
Seulement quelques protéines synthétisés au cours de la L-LTP sont connus. Quelle que soit leur nature, on pense qu'elles contribuent à l'augmentation de nombre des épines dendritiques, de la surface et la sensibilité post-synaptique aux neurotransmetteurs associés à l'expression de la L-LTP. Cette dernière peut être provoquée en partie par une amélioration de la synthèse des récepteurs AMPA au cours de la L-LTP. La phase tardive de la PLT est également associée à la synthèse présynaptique de la synaptotagmine et une augmentation du nombre des vésicules synaptiques, ce qui suggère que la L-LTP induit la synthèse de protéines non seulement dans les cellules post-synaptiques, mais aussi dans les cellules présynaptiques. Comme mentionné précédemment, pour que l'induction post-synaptique de la PLT provoque une synthèse présynaptique des protéines, il doit y avoir communication de la cellule post-synaptique à la présynaptique. Cela peut se produire via la synthèse d'un messager rétrograde (voir section suivante).
Même dans les études limitées à événements postsynaptiques, les chercheurs n'ont pas déterminé le lieu de synthèse des protéines qui sont à la base de la L-LTP. Plus précisément, il est difficile de savoir si la synthèse des protéines a lieu dans le corps cellulaire des cellules post-synaptiques ou dans ses dendrites[34]. Malgré l'observation des ribosomes (les principaux composants de la machinerie de synthèse protéique) dans les dendrites, et ce, dès les années 1960, l'idée dominante était que le corps de la cellule a été le principal site de la synthèse des protéines dans les neurones. Ce raisonnement n'a pas été sérieusement mis en question jusqu'aux années 1980. Par après, les scientifiques ont rapporté l'observation de la synthèse des protéines dans les dendrites dont le rapport à leur corps cellulaire a été rompu[34]. Plus récemment, des chercheurs ont démontré que ce type de la synthèse locale de protéines est nécessaire pour certains types de PLT[35],[36].
L'une des raisons de la popularité de l'hypothèse de synthèse locale de protéines est qu'elle fournit un mécanisme possible pour la spécificité associée avec la PLT. Plus précisément, si en effet une synthèse des protéines est à la base de la L-LTP : seulement des épines dendritiques recevant des stimuli induisants de la PLT seront soumis à cette dernière ; la potentialisation ne seront pas propagées aux synapses adjacentes. En revanche, la synthèse protéique globale qui se produit dans le corps de la cellule nécessite que les protéines soient expédiées à toutes les régions de la cellule, y compris les synapses qui n'ont pas reçu des stimuli induisant la PLT. La synthèse locale des protéines fournit un mécanisme explicatif à la spécificité que la synthèse protéique globale semble compromettre.
Signalisation rétrograde
La signalisation rétrograde est une hypothèse qui tente d'expliquer que, bien que la PLT est induite et exprimée en postsynaptique, certaines données suggèrent qu'elle est également exprimée en présynaptique[37]. L'hypothèse tire son nom du fait que la transmission synaptique normale est directionnelle et va de la cellule présynaptique vers la cellule post-synaptique. Pour que l'induction se produise en postsynaptique et qu'elle soit partiellement exprimée en présynaptique, un message doit s'effectuer à partir de la cellule post-synaptique à la cellule présynaptique dans une direction rétrograde (sens inverse). Une fois là, le message vraisemblablement déclenche une cascade d'événements qui conduirait à une composante présynaptique d'expression, telles que l'augmentation de la probabilité de libération de neurotransmetteur des vésicules synaptiques[38].
La signalisation rétrograde est actuellement un sujet de controverse : certains chercheurs ne croient pas du tout que la cellule présynaptique puisse contribuer à l'expression de la LTP. Même parmi les partisans de l'hypothèse, il existe une controverse sur la nature du messager. Au début, pensant qu'il s'agirait de l'oxyde nitrique, tandis que les plus récentes données orientent vers les protéines d'adhérence cellulaire.
Modulation
| Modulateur | Cible |
|---|---|
| des récepteurs β-Adrénergiques | cAMP, MAPK amplification |
| Synthase de l'oxyde nitrique | Guanylate cyclase, PKG, NMDAR |
| Des récepteurs de la dopamine | cAMP, MAPK amplification |
| Des récepteurs métabotropiques du glutamate | La PKC, MAPK amplification |
Comme décrit précédemment, les molécules qui sont à la base de la PLT peuvent être classés comme des médiateurs ou des modulateurs. Un médiateur de la PLT est une molécule, comme le récepteur NMDA ou de calcium, dont la présence et l'activité est nécessaire pour générer des PLT sous presque toutes les conditions. En revanche, un modulateur est une molécule qui peut altérer la PLT mais n'est pas indispensable pour sa génération ou l'expression.
En plus de la signalisation des voies décrites ci-dessus, la PLT au niveau de l'hippocampe peut être modifié par une variété de modulateurs. Par exemple, l'œstradiol (une hormone stéroïdienne) peut améliorer la PLT par l'augmentation de la phosphorylation de CREB et par conséquent la croissance des épines dendritiques[40]. En outre, des récepteurs β-adrénergiques agonistes tels que la noradrénaline, peuvent altérer la phase tardive de la PLT dépendante de la synthèse des protéines[41]. L'activité de l'oxyde Nitrique synthase peut également entraîner l'activation ultérieur de la guanylate cyclase et PKG[42]. De même, l'activation de récepteurs de la dopamine peut améliorer la PLT via la voie de signalisation de cAMP/PKA[43],[44].
La relation avec la mémoire du comportement
Alors que la potentialisation à long terme des synapses en culture cellulaire semble fournir un élégant substrat pour l'apprentissage et la mémoire, la contribution de la PLT dans L'apprentissage comportemental — l'apprentissage au niveau de l'organisme entier — ne peut pas tout simplement être extrapolées à partir des études in vitro. Pour cette raison, un effort considérable a été consacrée afin d'établir si la PLT est indispensable pour l'apprentissage et la mémoire chez les animaux vivants. De ce fait, la PLT joue également un rôle crucial dans le traitement de la peur.
La mémoire spatiale

En 1986, Richard Morris donné les premières preuves que la PLT est en effet nécessaire à la formation des souvenirs in vivo[45]. Il a testé la mémoire spatiale chez des rats ayant subi une modification pharmacologique de leur hippocampe : une structure du cerveau, dont le rôle dans l'apprentissage spatial est bien établi. L'apprentissage des rats s'est réalisé sur un labyrinthe aquatique de Morris à travers une tâche afin d'évaluer la mémoire spatiale des rongeurs. Les rats nagent dans une piscine d'eau trouble jusqu'à ce qu'ils localisent la plate-forme cachée sous sa surface. Au cours de cet exercice, les rats normaux sont censés associer l'emplacement de la plate-forme cachée avec des repères marquants placés à des positions spécifiques autour de la circonférence du labyrinthe. Après la formation, un groupe de rats a leurs hippocampes baigné dans le NMDA-receptor bloquant APV, tandis que l'autre groupe a servi le contrôle. Les deux groupes ont ensuite été soumis à l'eau labyrinthe de la mémoire spatiale de la tâche. Les rats du groupe témoin ont été en mesure de localiser la plate-forme et s'échapper de la piscine, tandis que les performances de l'APV chez les rats traités a été sensiblement réduite. En outre, lorsque les tranches de l'hippocampe ont été prises à partir de ces deux groupes, la PLT était facilement induite dans les contrôles, mais n'a pas pu être induite dans le cerveau des APV chez les rats traités. Cela a fourni des preuves que le récepteur NMDA — et, par extension, PLT — était nécessaire pour au moins certains types d'apprentissage et de mémoire.
De même, Susumu Tonegawa montré en 1996 que la région CA1 de l'hippocampe est essentiel à la formation des souvenirs spatiaux chez des souris vivantes[46]. Les soi-disant cellules de lieu situées dans cette région ne deviennent actives que lorsque le rat est dans un endroit particulier appelé « champ de place » — dans l'environnement. Puisque ces champs sont distribués partout dans l'environnement, une interprétation est que les groupes de cellules de lieu forment des cartes dans l'hippocampe. La précision de ces cartes détermine la façon dont un rat apprend à connaître son environnement et donc comment il peut naviguer. Tonegawa constate que, en altérant le récepteur NMDA, en particulier par retrait génétique de la sous-unité NR1 dans la région CA1, les champs de place générés ont été nettement moins précis que ceux des contrôles. Ces souris ont produit des cartes spatiales défectueuses lorsque leurs récepteurs NMDA ont été altérés. Comme prévu, ces souris ont très mal effectué les tâches spatiales par rapport aux témoins, mettant encore le point sur le rôle de la PLT dans l'apprentissage spatial.
L'évitement inhibiteur
En 2006, Jonathan Whitlock et ses collègues ont rapporté une série d'expériences qui fournissent peut-être la meilleure preuve du rôle de la PLT dans la mémoire du comportement, en argumentant que, pour conclure, que la PLT est à la base de l'apprentissage, les deux processus doivent imiter et occlure l'un l'autre[47]. En employant un paradigme de l'apprentissage de l'évitement inhibiteur, les chercheurs ont formé des rats dans un système à deux chambres : l'une obscure et l'autre éclairée, cette dernière étant équipée d'un dispositif qui délivre un choc chez le rat à l'entrée. Une analyse des synapses de CA1 de l'hippocampe a révélé que l'entraînement à l'évitement inhibiteur induit in vivo la phosphorylation des récepteurs AMPA du même type que celle observée dans les PLT in vitro ; c'est-à-dire que l'entraînement à l'évitement inhibiteur a imité la PLT. En outre, les synapses potentialisées au cours de l'entrainement ne pouvaient pas encore être potentialisées par des manipulations expérimentales qui, autrement, auraient induit PLT ; c'est-à-dire, que cet entraînement a occlus la PLT. Dans une réponse à l'article, Timothy Bliss et Al ont fait remarquer que ces expériences « font progresser de manière substantielle le cas pour la PLT comme un mécanisme neuronal de la mémoire »[48].
La signification clinique
Le rôle de la PLT dans la maladie est moins clair que son rôle dans les mécanismes de base de la plasticité synaptique. Cependant, les modifications dans la PLT peut contribuer à un certain nombre de maladies neurologiques, y compris la dépression, la maladie de Parkinson, l'épilepsie et les douleurs neuropathiques[49]. Altération de la PLT peut également avoir un rôle dans la maladie d'Alzheimer et chez des toxicomanies.
La maladie d'Alzheimer
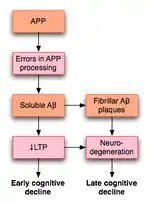
PLT a reçu beaucoup d'attention parmi ceux qui étudient la maladie d'Alzheimer (MA), une maladie neurodégénérative qui provoque le déclin cognitif marqué et la démence. Une grande partie de cette détérioration se produit en association avec des changements dégénératifs dans l'hippocampe et d'autres structures lobe temporal médial. En raison du rôle bien établi de l'hippocampe dans la PLT, certains ont suggéré que le déclin des fonctions cognitives observé chez les individus avec MA peut résulter de l'altération de la PLT.
En 2003, par une revue de la littérature, Rowan et coll. proposé un modèle pour la façon dont PLT peut être affectée dans la MA[50]. La MA semble résulter, au moins en partie, d'un mauvais traitement de la protéine précurseur amyloïde (APP). Le résultat de ce traitement anormal est l'accumulation de fragments de cette protéine, appelée amyloïde ß (Aß). Aß existe dans les deux soluble et fibrillaire formes. le mauvais traitement de l'APP résulte en l'accumulation de la solubles Aß que, selon l'hypothèse de Rowan, porte atteinte de l'hippocampe PLT et peut entraîner le déclin cognitif observé en début de la MA.
La MA peut également nuire à la PLT par le biais de mécanismes distincts de Aß. Par exemple, une étude a démontré que l'enzyme PKMz s'accumule dans les dégénérescences neurofibrillaires, qui sont un marqueur pathologique de la MA. PKMz est une enzyme ayant une importance cruciale dans le maintien de la fin de la PLT[51].
La toxicomanie
La recherche dans le domaine de la médecine de l'addiction a récemment tourné son attention vers PLT, en raison de l'hypothèse que l'addiction à la drogue représente une forme puissante de l'apprentissage et de la mémoire[52]. La dépendance est un complexe neuro-phénomène impliquant diverses parties du cerveau, comme l'aire tegmentale ventrale (VTA) et le noyau accumbens (NAc). Des études ont démontré que les synaspses de l'aire tegmentale ventrale et NAc sont capables de subir la PLT et que cette PLT peut être responsable des comportements qui caractérisent la dépendance[53].
Voir aussi
Notes et références
- (en) Paradiso, Michael A., Bear, Mark F. et Connors, Barry W., Neuroscience : Exploring the Brain, Hagerstwon, MD, Lippincott Williams & Wilkins, , 857 p. (ISBN 978-0-7817-6003-4 et 0-7817-6003-8, lire en ligne), p. 718
- S. F. Cooke et T. V. Bliss, « Plasticity in the human central nervous system », Brain, vol. 129, no Pt 7, , p. 1659–73 (PMID 16672292, DOI 10.1093/brain/awl082)
- La PLT est largement considérée comme l'un des principaux mécanismes cellulaires qui sous-tendent l'apprentissage et la mémoire
- R. W. Williams et K. Herrup, « The control of neuron number », Annu. Rev. Neurosci., vol. 11, no 1, , p. 423–53 (PMID 3284447, DOI 10.1146/annurev.ne.11.030188.002231, lire en ligne)
- Ramón y Cajal, Santiago, « The Croonian Lecture : La Fine Structure des Centres Nerveux », Proceedings of the Royal Society of London, vol. 55, nos 331-335, , p. 444–468 (DOI 10.1098/rspl.1894.0063)
- (en) Hebb, D. O., Organization of Behavior : a Neuropsychological Theory, New York, John Wiley, (ISBN 0-471-36727-3)
- Terje Lømo, « The discovery of long-term potentiation », Philos Trans R Soc Lond B Biol Sci, vol. 358, no 1432, , p. 617–20 (PMID 12740104, PMCID 1693150, DOI 10.1098/rstb.2002.1226)
- Terje Lømo, « Frequency potentiation of excitatory synaptic activity in the dentate area of the hippocampal formation », Acta Physiologica Scandinavica, vol. 68, no Suppl 277, , p. 128
- « Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path », J Physiol, vol. 232, no 2, , p. 331–56 (PMID 4727084, PMCID 1350458, DOI 10.1113/jphysiol.1973.sp010273)
- « Long-lasting potentiation of synaptic transmission in the dentate area of the unanaestetized rabbit following stimulation of the perforant path », J. Physiol.(Lond.), vol. 232, no 2, , p. 357–74 (PMID 4727085, PMCID 1350459)
- « While the term long term potentiation appeared once in the original Bliss and Lømo paper, it was not formally proposed for the phenomenon until the Douglas and Goddard paper ».
- « Long-term potentiation of the perforant path-granule cell synapse in the rat hippocampus », Brain Res., vol. 86, no 2, , p. 205–15 (PMID 163667, DOI 10.1016/0006-8993(75)90697-6)
- Andersen P, « A prelude to long-term potentiation », Philos. Trans. R. Soc. Lond., B, Biol. Sci., vol. 358, no 1432, , p. 613–5 (PMID 12740103, PMCID 1693144, DOI 10.1098/rstb.2002.1232)
- JC McEachern et CA Shaw, « An alternative to the LTP orthodoxy: a plasticity-pathology continuum model », Brain Research Review, vol. 22, no 1, , p. 51–92 (PMID 8871785, DOI 10.1016/0165-0173(96)00006-9)
- MC Clugnet et LeDoux JE, « Synaptic plasticity in fear conditioning circuits: induction of LTP in the lateral nucleus of the amygdala by stimulation of the medial geniculate body. », J Neurosci, vol. 10, no 8, , p. 2818–24 (PMID 2388089, lire en ligne [PDF])
- « LTP and LTD: an embarrassment of riches », Neuron, vol. 44, no 1, , p. 5–21 (PMID 15450156, DOI 10.1016/j.neuron.2004.09.012)
- « A developmental switch in the signaling cascades for LTP induction », Nat Neurosci, vol. 6, no 1, , p. 15–6 (PMID 12469130, DOI 10.1038/nn985)
- « Long-term potentiation of guinea pig mossy fiber responses is not blocked by N-methyl D-aspartate antagonists », Neurosci Lett, vol. 70, no 1, , p. 132–7 (PMID 3022192, DOI 10.1016/0304-3940(86)90451-9)
- « Postsynaptic control of hippocampal long-term potentiation », J. Physiol. (Paris), vol. 81, no 4, , p. 228–36 (PMID 2883309)
- « Induction of hebbian and non-hebbian mossy fiber long-term potentiation by distinct patterns of high-frequency stimulation », J. Neurosci., vol. 16, no 13, , p. 4293–9 (PMID 8753890, lire en ligne)
- « Roles of distinct glutamate receptors in induction of anti-Hebbian long-term potentiation », J. Physiol. (Lond.), vol. 586, no 6, , p. 1481–6 (PMID 18187472, PMCID 2375711, DOI 10.1113/jphysiol.2007.148064, lire en ligne)
- McNaughton BL, « Long-term potentiation, cooperativity and Hebb's cell assemblies: a personal history », Philosophical transactions of the Royal Society of London. Series B, Biological sciences, vol. 358, no 1432, , p. 629–34 (PMID 12740107, PMCID 1693161, DOI 10.1098/rstb.2002.1231, lire en ligne)
- Abraham WC, « How long will long-term potentiation last? », Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, vol. 358, no 1432, , p. 735–44 (PMID 12740120, PMCID 1693170, DOI 10.1098/rstb.2002.1222, lire en ligne)
- Lynch M, « Long-term potentiation and memory », Physiol Rev, vol. 84, no 1, , p. 87–136 (PMID 14715912, PMCID 1693161, DOI 10.1152/physrev.00014.2003, lire en ligne [archive du ])
- Malinow R, « AMPA receptor trafficking and long-term potentiation », Philos Trans R Soc Lond B Biol Sci, vol. 358, no 1432, , p. 707–14 (PMID 12740116, PMCID 1693162, DOI 10.1098/rstb.2002.1233)
- Malinow R, « Optical quantal analysis reveals a presynaptic component of LTP at hippocampal Schaffer-associational synapses », Neuron, vol. 38, no 5, , p. 797–804 (PMID 12797963, PMCID 1693162, DOI 10.1016/S0896-6273(03)00325-8, lire en ligne)
- « Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro », J Physiol, vol. (Pt 3), no Pt 3, , p. 703–11 (PMID 8683469, PMCID 1158708)
- « Anisomycin, an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro », Brain Res, vol. 452, nos 1-2, , p. 57–65 (PMID 3401749, DOI 10.1016/0006-8993(88)90008-X)
- « TORC1 is a calcium- and cAMP-sensitive coincidence detector involved in hippocampal long-term synaptic plasticity. », PNAS, vol. 104, no 11, , p. 4700–5 (PMID 17360587, PMCID 1838663, DOI 10.1073/pnas.0607524104)
- « Persistent phosphorylation by protein kinase Mzeta maintains late-phase long-term potentiation », J Neurosci, vol. 25, no 8, , p. 1979–84 (PMID 15728837, DOI 10.1523/JNEUROSCI.5132-04.2005)
- « Storage of spatial information by the maintenance mechanism of LTP », Science, vol. 313, no 5790, , p. 1141–4 (PMID 16931766, DOI 10.1126/science.1128657)
- Lenora J. Volk, Bachman, Julia L., Johnson, Richard, Yu, Yilin, Bachman, Julia L., Bachman, Julia L., Bachman, Julia L., Bachman, Julia L., Bachman, Julia L. et Bachman, Julia L., « PKM-ζ is not required for hippocampal synaptic plasticity, learning and memory », Nature, vol. 493, no 7432, , p. 420–423 (PMID 23283174, PMCID 3830948, DOI 10.1038/nature11802)
- D. Meyer, Bonhoeffer T. et Scheuss V., « Balance and Stability of Synaptic Structures during Synaptic Plasticity », Neuron, vol. 82, no 2, , p. 430–443 (PMID 24742464, DOI 10.1016/j.neuron.2014.02.031)
- Raymond J. Kelleher, Arvind Govindarajan et Susumu Tonegawa, « Translational Regulatory Mechanisms in Persistent Forms of Synaptic Plasticity », Neuron, vol. 44, no 1, , p. 59–73 (DOI 10.1016/j.neuron.2004.09.013, lire en ligne).
- « A requirement for local protein synthesis in neurotrophin-induced hippocampal synaptic plasticity », Science, vol. 273, no 5280, , p. 1402–6 (PMID 8703078, DOI 10.1126/science.273.5280.1402)
- « A cellular mechanism for targeting newly synthesized mRNAs to synaptic sites on dendrites », Proc Natl Acad Sci USA, vol. 98, no 13, , p. 7062–8 (PMID 11416188, PMCID 34623, DOI 10.1073/pnas.131146398, lire en ligne)
- « Presynaptic protein kinase activity supports long-term potentiation at synapses between individual hippocampal neurons », J Neurosci, vol. 20, no 12, , p. 4497–505 (PMID 10844019)
- « Presynaptic BDNF required for a presynaptic but not postsynaptic component of LTP at hippocampal CA1-CA3 synapses », Neuron, vol. 39, no 6, , p. 975–90 (PMID 12971897, DOI 10.1016/S0896-6273(03)00543-9)
- Sweatt J, « Toward a molecular explanation for long-term potentiation », Learn Mem, vol. 6, no 5, , p. 399–416 (PMID 10541462, DOI 10.1101/lm.6.5.399, lire en ligne)
- « CREB activation mediates plasticity in cultured hippocampal neurons », Neural Plast, vol. 6, no 3, , p. 1–7 (PMID 9920677, PMCID 2565317, DOI 10.1155/NP.1998.1)
- « Involvement of beta-adrenergic receptors in protein synthesis-dependent late long-term potentiation (LTP) in the dentate gyrus of freely moving rats: the critical role of the LTP induction strength », Neuroscience, vol. 119, no 2, , p. 473–9 (PMID 12770561, DOI 10.1016/S0306-4522(03)00151-9)
- « Nitric oxide signaling contributes to late-phase LTP and CREB phosphorylation in the hippocampus », J Neurosci, vol. 19, no 23, , p. 10250–61 (PMID 10575022)
- « The effect of dopaminergic D1 receptor blockade during tetanization on the expression of long-term potentiation in the rat CA1 region in vitro », Neurosci Lett, vol. 129, no 1, , p. 111–4 (PMID 1833673, DOI 10.1016/0304-3940(91)90732-9)
- « D1/D5 dopamine receptor activation increases the magnitude of early long-term potentiation at CA1 hippocampal synapses », J Neurosci, vol. 16, no 23, , p. 7478–86 (PMID 8922403)
- « Selective impairment of learning and blockade of long-term potentiation by an N-methyl-D-aspartate receptor antagonist, AP5 », Nature, vol. 319, no 6056, , p. 774–6 (PMID 2869411, DOI 10.1038/319774a0)
- « Impaired hippocampal representation of space in CA1-specific NMDAR1 knockout mice », Cell, vol. 87, no 7, , p. 1339–49 (PMID 8980239, DOI 10.1016/S0092-8674(00)81828-0)
- « Learning induces long-term potentiation in the hippocampus », Science, vol. 313, no 5790, , p. 1093–7 (PMID 16931756, DOI 10.1126/science.1128134)
- « Neuroscience. ZAP and ZIP, a story to forget », Science, vol. 313, no 5790, , p. 1058–9 (PMID 16931746, DOI 10.1126/science.1132538)
- « Plasticity in the human central nervous system », Brain, vol. 129, no Pt 7, , p. 1659–73 (PMID 16672292, DOI 10.1093/brain/awl082, lire en ligne)
- « Synaptic plasticity in animal models of early Alzheimer's disease », Philosophical transactions of the Royal Society of London. Series B, Biological sciences, vol. 358, no 1432, , p. 821–8 (PMID 12740129, PMCID 1693153, DOI 10.1098/rstb.2002.1240, lire en ligne)
- « Atypical protein kinase C in neurodegenerative disease I: PKMzeta aggregates with limbic neurofibrillary tangles and AMPA receptors in Alzheimer disease », Journal of neuropathology and experimental neurology, vol. 65, no 4, , p. 319–26 (PMID 16691113, DOI 10.1097/01.jnen.0000218442.07664.04, lire en ligne)
- « Synaptic plasticity and addiction », Nature reviews. Neuroscience, vol. 8, no 11, , p. 844–58 (PMID 17948030, DOI 10.1038/nrn2234)
- Wolf ME, « LTP may trigger addiction », Molecular interventions, vol. 3, no 5, , p. 248–52 (PMID 14993438, DOI 10.1124/mi.3.5.248, lire en ligne)
Liens externes
- Ressource relative à la santé :
- Portail des neurosciences