Râle d'eau
Rallus aquaticus

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Classe | Aves |
| Ordre | Gruiformes |
| Famille | Rallidae |
| Genre | Rallus |

LC [1] : Préoccupation mineure
Le Râle d'eau (Rallus aquaticus) est une espèce d'oiseaux de la famille des rallidés. L'adulte mesure de 23 à 28 cm de long et a, comme les autres râles, un corps aplati latéralement lui permettant de se frayer plus facilement un chemin dans les roselières, son habitat préférentiel. Ses parties supérieures sont brunes et ses parties inférieures gris-bleu. Il a des rayures noires sur les flancs, de longs orteils, une courte queue et un long bec rougeâtre. Les jeunes sont similaires aux adultes, mais la partie gris-bleu du plumage de l'adulte est chamoisée chez les jeunes. Les nouveau-nés sont couverts d'un duvet noir, comme chez tous les autres râles.
Le Râle d'eau est omnivore, mais se nourrit principalement de petits animaux. Il se reproduit dans les roselières et autres zones marécageuses disposant d'une végétation haute et dense. Il y construit son nid, juste au-dessus du niveau de l'eau, avec diverses plantes collectées à proximité. Les œufs, de couleur écrue, sont principalement couvés par la femelle et éclosent après 19 à 22 jours d'incubation. La femelle défend ses œufs en chassant les intrus ou même parfois en déplaçant le nid. Mâles et femelles sont des oiseaux territoriaux, qui peuvent se montrer agressifs tout au long de l'année. Les jeunes oiseaux sont matures à un an, et les femelles peuvent dès lors pondre deux fois par saison.
L'espèce vit dans les zones humides d'Europe, d'Asie et d'Afrique du Nord. C'est un oiseau migrateur dans le nord et l'est de son aire de répartition, mais on le rencontre toute l'année dans les zones à climat plus tempéré. Le Râle d'eau compte trois sous-espèces reconnues, dont une est aujourd'hui éteinte. Le Râle à joues brunes a longtemps été considéré comme une sous-espèce du Râle d'eau, mais a désormais le statut d'espèce à part entière. Le Râle d'eau est victime des inondations et du gel, de la perte de son habitat et de la prédation des mammifères et des grands oiseaux. Le Vison d'Amérique, introduit en Europe, l'a exterminé sur certaines îles, mais l'espèce a une aire de répartition suffisamment vaste et une population assez nombreuse pour ne pas être considérée en danger.
Description
Mensurations et plumage

L'adulte est un oiseau de taille moyenne, mesurant de 23 à 28 cm de long[2] pour une envergure de 38 à 45 cm[3]. Les mâles pèsent généralement entre 88 et 190 g et les femelles, plus légères, entre 74 et 138 g[3].
Les parties supérieures de la tête à la queue sont brun-olive avec des raies noires[4], notamment sur les épaules. Les côtés de la tête et les parties inférieures en dessous de la poitrine sont gris ardoise[5],[4], à l'exception d'une marque noire entre le bec et l'œil. La poitrine est brunâtre, les flancs sont barrés de blanc et de noir et le dessous de la queue est blanc avec quelques raies noires. Le long bec et l'iris sont rouges, et les pattes sont rosées. Il n'y a pas de dimorphisme sexuel très marqué[4],[3] : la femelle est légèrement plus petite et a un bec plus effilé[6], mais il est impossible de déterminer le sexe avec exactitude par de simples mesures[7]. Les mâles adultes ont des raies noires particulièrement bien marquées sous la queue[8]. Les individus adultes mâles et femelles sont facilement identifiables grâce à ces marques, qui sont uniques et caractéristiques de chaque individu. Certains ornithologues pensent que ces rayures noires sous la queue sont un compromis entre le blanc uni adopté par certains oiseaux grégaires vivant dans l'eau pour se signaler à leurs congénères, comme la poule d'eau, et la nécessité de ne pas se faire remarquer trop facilement[9]. Les jeunes ont une couronne noirâtre et leur gorge et leur menton sont blancs. Les parties inférieures sont chamoisées ou blanches avec des raies plus sombres, et les flancs sont marqués de brun et de chamoisé. Le dessous de la queue est chamoisé, et l'œil, le bec et les pattes sont d'une couleur plus terne que chez l'adulte. Les oisillons duveteux sont entièrement noirs, à l'exception de leur bec principalement blanc[6]. Après la reproduction, le râle mue, et ne peut donc plus voler durant environ trois semaines[1],[2].
Espèces similaires
Le Râle d'eau peut facilement se distinguer des autres râles qui vivent dans les roselières grâce à ses rayures blanches et noires sous la queue et son bec rouge, qui est légèrement plus long que le reste de la tête de l'oiseau, et légèrement incurvé vers le bas[10]. Le Râle à joues brunes (Rallus indicus), qui vit de la Sibérie au Japon et était autrefois considéré comme conspécifique du Râle d'eau, est légèrement plus petit et diffère également par ses parties supérieures plus claires, ses parties inférieures teintées de brun et le trait brun passant sur l'œil[11]. Le Râle strié (Gallirallus striatus), qui lui ressemble beaucoup, a un bec plus robuste, une couronne couleur noix et des points blancs sur ses parties supérieures. Les Râles d'eau jeunes et les adultes ayant juste mué présentent une teinte chamoisée sous la queue, comme la Marouette ponctuée (Porzana porzana), espèce plus petite[12], mais le plumage de cette dernière espèce est marqué de points blancs, et la marouette a un bec plus court et jaunâtre. D'une manière générale, le Râle d'eau se distingue des marouettes par son long bec rouge. La Marouette poussin (P. parva) et la Marouette de Baillon (P. pusilla) sont nettement plus petites et ont des sous-caudales plus foncées[2]. L'aire de répartition du Râle d'eau ne chevauche pas celle des autres râles du genre Rallus, et les individus erratiques qui s'aventurent de l'autre côté de l'Atlantique peuvent se distinguer de leurs homologues américains par l'absence de coloration rousse ou noix sur les ailes. Le Râle bleuâtre (Rallus caerulescens), plus grand, a quant à lui des parties supérieures non rayées et des pattes d'un rouge plus vif[6].
Écologie et comportement
Ce râle est une espèce discrète qui reste dissimulée dans la végétation le plus clair de son temps, rendant difficile son observation dans son habitat de prédilection[3]. Il a un corps aplati latéralement qui lui permet de se faufiler dans une végétation dense[13], et il ne bouge plus lorsqu'il est surpris hors de son abri herbacé[14]. Il marche en levant haut les pattes, mais se tapit dès qu'il cherche à s'abriter. Il nage quand cela est nécessaire, avec les mouvements saccadés typiques des râles[15], et vole sur de courtes distances, pas très haut au-dessus des roseaux et en laissant pendre ses pattes[3]. Bien que son vol paraisse peu efficace, l'oiseau peut parcourir de longues distances au cours de ses migrations nocturnes[11], durant desquelles il est parfois victime de collisions avec des lampadaires ou des lignes électriques[14]. Des oiseaux bagués en Angleterre ont ainsi été retrouvés jusqu'en Pologne, en République tchèque et en Suède[16].
Cette espèce est territoriale et défend l'espace qu'elle occupe pendant la période de reproduction, mais également durant l'hiver. Les oiseaux peuvent se battre, notamment en période de reproduction, chargeant l'intrus avec le cou dressé. Les deux membres d'un couple peuvent parfois attaquer en même temps pour protéger leur nid. Durant l'hiver, les plus gros mâles dominent, mais les agressions sont moins courantes et les animaux cherchent plutôt à intimider l'intrus, en se tenant bien dressés, en secouant la tête et en menaçant avec leur bec[6].
Cri
.jpg.webp)
Le Râle d'eau est une espèce que l'on peut entendre tout au long de l'année. Le cri consiste en une série de grognements suivis d'un couinement en kruîh[4] rappelant celui d'un porcelet, et se termine par de nouveaux grognements. Il est utilisé comme cri d'alerte ou pour prévenir de sa présence sur un territoire[6]. On entend principalement ce chant à l'aube ou au crépuscule[17]. Les râles indiquent également leur présence par des séries de ick ick ick espacés, des pitt ou des tick[4]. Les membres d'un couple peuvent émettre ce couinement à tour de rôle, le mâle ayant des notes plus basses et plus lentes que sa partenaire. Le chant utilisé lors de la cour par les mâles comme les femelles est un tjick tjick tjik tjuirrrr qui finit souvent par un trille de la femelle[4]. Le mâle peut chanter pendant des heures. Lorsqu'il est en vol, il émet un sifflement aigu, et d'autres sons comme un craquement répété lorsqu'il indique un emplacement pour le nid à la femelle[6]. Les deux parents émettent un ronronnement quand ils sont au nid avec leurs petits. Les râles chantent plus facilement quand ils sont bien installés dans un territoire et au début de la saison de reproduction. La femelle appelle ses oisillons par un douc-douc-douc[4], tandis que ceux-ci répondent en gazouillant doucement au début, mais acquièrent rapidement un cri de type tick-tick-trik[6].
Quand les ornithologues diffusent le cri enregistré de la Rousserolle effarvatte (Acrocephalus scirpaceus) la nuit pour attirer des animaux de cette espèce, ils attirent également des Râles d'eau et d'autres oiseaux de zones humides, qui semblent reconnaître le cri de cette espèce et l'associer à la présence d'une zone humide où s'installer[18].
Alimentation
Le Râle d'eau est omnivore, mais préfère les proies animales. Celles-ci incluent des sangsues, des vers de terre, des gastéropodes, de petits crustacés, des araignées, et une grande variété d'insectes terrestres et aquatiques et leurs larves[2]. De petits vertébrés comme des amphibiens, des poissons, des oiseaux ou des mammifères peuvent être consommés occasionnellement. Les vertébrés sont empalés avec le bec de l'animal qui brise ainsi la colonne vertébrale de sa proie. Il peut se nourrir également de cadavres d'autres oiseaux[17]. Le râle consomme des végétaux en automne et en hiver principalement, et son régime inclut des bourgeons, des graines, des fleurs, des pousses de plantes aquatiques, des baies et des fruits[6],[17]. Les jeunes râles sont principalement nourris d'insectes et d'araignées.
Le Râle d'eau trouve sa nourriture au sol ou dans la boue, et il la rince alors dans l'eau avant de la consommer[6]. Après une pluie, il lui arrive de sonder le sol à la recherche de vers de terre[8]. Il peut plonger la tête dans l'eau jusqu'au dos pour attraper sa proie[13]. Il se nourrit dans des milieux plus ouverts quand le froid l'y oblige, et Edmund Meade-Waldo a décrit une fois sept râles se nourrissant dans un pré[20]. En dépit de sa nature discrète, ce râle peut facilement être élevé en captivité, où il est nourri de viande et de vers de terre[21]. Un individu a même été dressé à sauter pour attraper des vers suspendus à une canne à pêche[22].
Le Râle d'eau suit des trajets bien définis lorsqu'il est en quête de nourriture, et revient fréquemment dans les meilleurs coins de chasse. Opportuniste, il est capable de sauter pour attraper des insectes sur les plantes, de grimper pour trouver des baies ou de déloger des pommes qu'il pourra manger au sol[6],[17]. Il tue de petits oiseaux en les empalant ou en les noyant, notamment si ces derniers ont une capacité à fuir limitée. Ainsi on l'a déjà observé tuant un Verdier d'Europe (Chloris chloris) et une Caille peinte (Excalfactoria chinensis) dans un parc ornithologique, ainsi que des petits oiseaux piégés dans des filets. Il s'attaque aussi aux nids d'autres espèces nichant dans les roseaux comme la Rousserolle turdoïde (Acrocephalus arundinaceus)[23]. Le Râle d'eau peut défendre son territoire de chasse l'hiver, bien qu'il soit plus restreint qu'en période de reproduction, avec des animaux situés à moins de 10 m les uns des autres[6], ce qui permet à certains sites d'accueillir des centaines d'oiseaux[19]. Son comportement agressif en dehors de la période de reproduction peut le conduire à attaquer d'autres rallidés comme la Marouette ponctuée (Porzana porzana) ou la Marouette de Baillon (P. pusilla)[24].
Reproduction

Le Râle d'eau est monogame et très territorial durant la reproduction. Les couples se forment dès l'arrivée des animaux sur le site de nidification, ou peut-être même avant la migration de printemps. Dans de grands marécages avec de bonnes conditions de vie, les oiseaux peuvent nicher entre 20 et 50 m les uns des autres. Les territoires sont de taille variable, mais ils font souvent autour de 300 m2. Le couple fait sa parade nuptiale et émet des cris durant toute la saison de reproduction. Le mâle choisit l'emplacement du nid, qu'il montre à la femelle en se tenant à cet endroit avec les plumes du dos dressées, la queue déployée et le bec pointé verticalement vers le bas. Cette posture est accompagnée d'un puissant cri. Avant de s'accoupler, il déploie ses ailes et sa queue, et touche sa poitrine avec son bec. Le mâle nourrit la femelle durant la parade nuptiale, et durant la période d'incubation : elle quitte alors momentanément le nid pour aller s'exposer devant lui, l'appelant doucement, marchant autour de lui, frottant son bec contre lui et faisant de petites courses dans sa direction[6].
Le nid est construit à partir de la végétation dont l'oiseau dispose à proximité, et il est bâti principalement par le mâle, généralement en un seul jour. Il est construit à au moins 15 cm au-dessus du niveau de l'eau, et peut parfois être bâti sur un amas de racines, une souche ou un support du même type. Il peut être construit plus haut si les eaux commencent à monter. Le nid fait 13 à 16 cm de diamètre environ et 7 cm de haut. Il est bien caché et le râle s'en approche précautionneusement via d'étroites pistes[6],[14],[25].
Une ponte comprend généralement entre 6 et 11 œufs[6],[15],[17], mais est plus réduite au Cachemire, à 1 500 m d'altitude, avec seulement 5 à 8 œufs[11]. Les dates de pontes varient suivant les régions, de fin mars dans l'Ouest de l'Europe et en Afrique du Nord à fin mai dans le Cachemire et juin en Islande[6]. La taille de la ponte est en moyenne légèrement plus petite en tout début de saison de reproduction, ou en fin de celle-ci[26]. La saison de reproduction peut être allongée par le remplacement d'une ponte perdue ou par une seconde ponte. Les œufs sont lisses, légèrement brillants et de forme ovale. Leur couleur varie du blanc au rosé, avec des taches brun-rougeâtre principalement situées dans la partie la plus large[15]. Les petites taches peuvent parfois en former une seule grosse[25]. La taille des œufs varie suivant les sous-espèces. Chez la sous-espèce type, leur taille moyenne est de 36 mm de long pour 26 mm de large. Ils pèsent environ 13 g[6], dont 7 % sont constitués par la coquille[27].
Les deux parents couvent alternativement les œufs, bien que la femelle y consacre plus de temps que le mâle[11]. Les œufs éclosent après 19 à 22 jours d'incubation[27],[17], avec une réussite d'au moins 87 %[16], et les jeunes quittent le nid 20 à 30 jours plus tard[27],[17]. Tandis qu'un des deux parents couve, le second part chercher de la nourriture et ravitaille son compagnon, puis les oisillons. Ceux-ci sont capables de rechercher leur nourriture par eux-mêmes après seulement cinq jours. Après avoir quitté le nid, les jeunes se débrouillent par eux-mêmes. Ils doivent attendre l'âge de sept à neuf semaines pour être capables de voler[6]. Si un nid a été découvert par un prédateur, la femelle peut déplacer les oisillons ou les œufs à un autre endroit. Les œufs sont alors transportés dans son bec[14], et les jeunes oisillons peuvent être transportés sous les ailes de l'adulte[22]. Les oiseaux en train de couver restent sur le nid sans bouger même s'ils sont approchés de près, ou attaquent l'intrus, voire feignent d'être blessés pour le distraire[6]. Le Râle d'eau peut se reproduire dès l'âge d'un an, et élève généralement par la suite deux nichées par saison.
En moyenne, un Râle d'eau ayant quitté le nid vit 17 à 20 mois, avec un pourcentage de survie qui ne dépasse pas 50 % durant ses trois premières années de vie, et parfois supérieur par la suite[16]. L'âge maximum jamais enregistré pour cet oiseau est de huit ans et dix mois[27],[28].
Prédateurs et parasites
_lores.jpg.webp)
Parmi les prédateurs du Râle d'eau, on compte un grand nombre de mammifères et de grands oiseaux. Le Vison d'Amérique (Neovison vison) est en partie responsable de l'extinction de la population islandaise[30] et les chats et les chiens sont couramment observés s'en prenant à l'espèce[16]. Localement, la Loutre d'Europe (Lutra lutra) mange des râles et d'autres oiseaux des marais[31]. Le Butor étoilé (Botaurus stellaris), un autre résident des roselières, consomme des râles[32], tout comme le Héron cendré (Ardea cinerea)[33]. Les Râles d'eau sont particulièrement vulnérables au héron qui peut s'introduire dans les roselières lorsque l'eau est haute[22]. Les busards qui chassent dans les marais sont également des prédateurs de l'espèce[34], mais moins fréquemment. Le Râle d'eau est parfois aussi victime de la Chouette hulotte[35], du Hibou des marais[36], du Hibou grand-duc[37], de l'Aigle criard[38], du Faucon crécerelle[39] et du Faucon pèlerin[40].
Les parasites du Râle d'eau comprennent les anoploures Rallicola cuspidatus et Incidifrons ralli[41],[42], la tique Ixodes frontalis[43] et l'hippoboscidé Ornithomyia avicularia[44]. Trois poux, Fulicoffula rallina, Pseudomenopon scopulacorne et Rallicola cuspidatus, ont été découverts sur des cadavres de Râle d'eau en 2005 sur les îles Féroé, alors que ces espèces n'avaient jamais été répertoriées sur cet archipel précédemment[45]. Trois espèces d'acariens des plumes au moins s'abritent dans son plumage[46]. Le Râle d'eau peut être touché par la grippe aviaire[47],[48] et la bactérie Borrelia burgdorferi, transportée par les tiques, qui cause chez l'homme la maladie de Lyme[29].
Aire de répartition et habitat
Aire de répartition
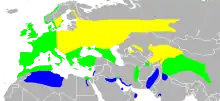
- Zones de reproduction
- Résident annuel
- Zones d'hivernage
Aire au sein de laquelle l'espèce se reproduit
Le Râle d'eau se reproduit dans une vaste zone comprenant toute la partie tempérée de l'Eurasie, depuis l'Islande et les îles Britanniques jusqu'à la Sibérie, la Corée, la Chine et le Nord du Japon. Il est ponctuellement présent dans les habitats qui lui conviennent en Afrique du Nord, en Arabie saoudite et en Turquie. On connaît assez mal sa répartition exacte en Asie, et elle pourrait être plus étendue que ce que l'on pense aujourd'hui[6]. Cette espèce peut occasionnellement devenir erratique et s'aventurer loin de son aire de répartition, et on a retrouvé des Râles d'eau aux Açores, à Madère, en Mauritanie, dans l'Arctique[15], au Groenland, en Malaisie et au Viêt Nam[1].
La population islandaise du Râle d'eau, R. a. hibernans, s'est éteinte vers 1965, du fait de la disparition de son habitat à la suite du drainage des zones humides, et de la prédation exercée par le Vison d'Amérique, une espèce introduite[30],[49]. Avant son extinction complète, quelques oiseaux persistaient tout au long de l'année sur l'île, profitant des sources d'eau chaude engendrées par le fort volcanisme pour passer les mois d'hiver ; d'autres ont été observés dans les îles Féroé, en Irlande, ainsi que de passage dans les Hébrides, montrant qu'il lui arrivait parfois de migrer[15].
Migrations
Le Râle d'eau est un migrant occasionnel. Ainsi, la sous-espèce nominale, R. a. aquaticus, vit aujourd'hui dans les parties au climat le plus doux de son aire de répartition, mais il lui arrive de migrer vers le sud en cas d'hiver trop rigoureux. Cette population hiverne ainsi sur son aire de reproduction, mais également en Afrique du Nord, au Moyen-Orient et dans la région de la mer Caspienne. La période la plus adaptée aux migrations se situe entre septembre et octobre, tandis que la plupart des oiseaux retournent dans leur aire de reproduction en mars et début avril[15]. Un spécimen de la sous-espèce type collecté par Richard Meinertzhagen dans le Baloutchistan, région d'Asie située entre l'Iran et l'Afghanistan, est d'origine douteuse[50]. R. a. korejewi est un autre migrant occasionnel, une partie de la population hivernant en Irak et dans l'Est de l'Arabie saoudite et à l'est jusqu'au Pakistan et au Nord de l'Inde[6].
Habitat


Il se reproduit dans des zones humides aux eaux stagnantes, avec une végétation haute et dense, comprenant des espèces comme le roseau, les massettes, les iris, les rubaniers ou les carex[6]. Le long des côtes, le Juncus maritimus est courant dans les marais salants, et les carex et les rubaniers dominent dans les marais moins salés. Une étude menée aux Pays-Bas et en Espagne a montré que le Juncus maritimus offre un meilleur abri que les autres plantes maritimes. Le nid est bâti à partir des plantes dont l'oiseau dispose[51]. Lorsqu'elle est présente, la marisque offre un très bon habitat pour la reproduction, du fait de sa grande taille et de sa forte densité elle abrite parfaitement le nid des râles[52]. L'habitat qu'ils affectionnent le plus est toutefois sans aucun doute la roselière de Phragmites[53], avec les plantes baignant dans une eau profonde de 5 à 30 cm, des aires boueuses assurant un approvisionnement en nourriture et une bonne diversité d'invertébrés. S'ils disposent de saules ou de buissons à proximité, ils sont d'autant plus à l'aise que dans une vaste étendue uniforme. En plus des marais d'eau douce ou d'eau salée, cet oiseau peut s'installer dans des carrières de gravier ou d'argile, ou dans des tourbières, à condition que le couvert végétal soit suffisant. On peut le trouver dans des rizières ou sur des îles de végétation flottant sur l'eau[6], et on le rencontre au Cachemire dans des plantations de canne à sucre inondées[11]. Bien qu'il s'agisse d'une espèce de plaine, le Râle d'eau peut vivre à une altitude atteignant 1 240 m dans les Alpes et 2 000 m en Arménie[6].
Une étude finlandaise a montré que le facteur qui influait le plus sur la distribution du Râle d'eau était l'existence de couvert végétal haut et dense, ainsi que, dans une moindre mesure, la présence de marécages. Toutefois, certains facteurs comme la température, les précipitations, la longueur du rivage ou la présence de tourbières, très importants pour d'autres oiseaux de marais, n'influent pas directement sur le Râle d'eau. Les zones présentant la plus grande densité de Râles d'eau en Finlande sont par ailleurs celles qui comptent le plus grand nombre de trois autres espèces considérées comme menacées : la Rousserolle turdoïde (Acrocephalus arundinaceus), le Butor étoilé (Botaurus stellaris) et le Busard des roseaux (Circus aeruginosus)[54]. La limite septentrionale de son aire de reproduction semble déterminée par la transition entre les marais riches en nutriments et les eaux plus pauvres et plus acides, qui conviennent moins bien au roseau et laissent leur place à des végétaux moins hauts comme la Potentille des marais (Comarum palustre), qui ne convient pas à ce râle[55]. Une étude italienne a montré que les oiseaux vivant dans les roselières avaient besoin d'une surface minimum pour vivre, et que cette surface était d'un hectare pour le Râle d'eau[56].
Lorsqu'il migre et durant l'hiver, il peut utiliser une plus grande variété d'habitats, comme des fourrés inondés ou des fougères. Lorsqu'il gèle, les oiseaux peuvent être contraints à choisir des habitats plus ouverts comme des fossés, des jardins ou des décharges[6], ou même à rester sur la glace[57]. Une étude galloise a conclu que les territoires hivernaux des animaux se chevauchaient parfois, chacun d'entre eux utilisant une proportion importante de la roselière. Après qu'un site est déserté pour cause de gelée, les oiseaux reviennent à leur zone d'origine. Ainsi une densité de 14 oiseaux par hectare a été observée[58]. En Islande, les sources chaudes d'origine géothermique permettent aux râles de passer l'hiver. Ils peuvent rejoindre les ruisseaux par des tunnels sous la neige. Quand ils ne s'alimentent pas, ils s'abritent dans des trous et des crevasses formés dans la lave solidifiée[6].
Taxinomie et systématique
Les râles forment une famille d'oiseaux comprenant près de 150 espèces. Bien que ce groupe soit d'origine très ancienne, une grande majorité des espèces et les formes les plus primitives se rencontrent dans l'ancien monde, d'où cette famille est vraisemblablement originaire. Toutefois, le genre Rallus, le groupe des espèces au long bec vivant dans les roselières auquel appartient le Râle d'eau, semble s'être développé dans le Nouveau Monde. Ces membres de l'ancien monde que sont le Râle d'eau, le Râle bleuâtre (Rallus caerulescens) et le Râle de Madagascar (Rallus madagascariensis) semblent avoir évolué à partir d'oiseaux ayant traversé l'Atlantique[59]. La génétique suggère que le Râle d'eau est, au sein des Rallus', le plus apparenté aux râles Gallirallus du Pacifique[60] et est à la base de ce groupe[61].
Le Râle d'eau a été décrit pour la première fois par Carl von Linné dans son ouvrage Systema Naturae en 1758, sous son nom scientifique actuel, Rallus aquaticus[62]. Son nom scientifique signifie en latin « Râle d'eau », nom vernaculaire utilisé pour désigner l'espèce[27].
Fossiles
Le plus vieux fossile connu de Râle d'eau est constitué d'os retrouvés dans les Carpates et datant du Pliocène (il y a 5,3 à 1,8 million d'années). À la fin du Pléistocène, deux millions d'années plus tard, les traces fossilisées suggèrent que le Râle d'eau était présent dans une aire plus étendue que celle qu'il occupe aujourd'hui[30]. On a notamment retrouvé une trentaine de fossiles de cette espèce en Bulgarie, et d'autres à travers le Sud de l'Europe[63],[64] et en Chine[65]. On a retrouvé sur l'île d'Ibiza les traces fossilisées d'une espèce de râle aujourd'hui disparue, Rallus eivissensis, qui était plus petit mais plus robuste que le Râle d'eau, et avait probablement de moins bonnes aptitudes à voler. Durant le quaternaire, l'île ne présentait pas de mammifères terrestres, et cette espèce de râle descendait vraisemblablement de son homologue continental, le Râle d'eau. Il s'éteignit à peu près au moment où l'homme arriva sur l'île[66], entre 16 700 et 5 300 ans av. J.-C.[67]. Le Râle d'eau, lui, est actuellement un oiseau rare à Ibiza[68].
Sous-espèces

On reconnaît trois sous-espèces, dont une est aujourd'hui éteinte, et qui se distinguent facilement les unes des autres[6] :
- R. a. aquaticus (Linnaeus, 1758). C'est la sous-espèce type. On la trouve en Europe, en Afrique du Nord, en Turquie, dans l'Ouest de l'Asie jusqu'à la mer Caspienne et l'Ouest du Kazakhstan, et dans une petite bande à l'Est de la Sibérie[6] ;
- R. a. hibernans (Salomonsen, 1931). Cette sous-espèce, aujourd'hui éteinte, vivait en Islande, elle avait des parties supérieures d'un brun plus chaud que la sous-espèce type. Les barres sur les flancs étaient marron foncé et non noires, et le bec était un peu plus court. Le gris des parties inférieures pouvait prendre une teinte légèrement brune[6] ;
- R. a. korejewi (Zarudny, 1905) (comprenant les formes deserticolor, tsaidamensis et arjanicus). Cette sous-espèce se reproduit dans le Sud de l'Asie centrale, dans une zone allant du Sud et de l'Est de l'Iran à l'Ouest de la Chine. Elle est légèrement plus imposante que la sous-espèce type, avec des parties supérieures d'un brun plus pâle. Elle a un léger trait blanc sur l'œil[6],[11].
Le Râle à joues brunes (R. indicus, Blyth, 1849), a longtemps été considéré comme une sous-espèce du Râle d'eau. Cette espèce se reproduit dans le Nord de la Mongolie, l'Est de la Sibérie, le Nord-Est de la Chine, la Corée et le Nord du Japon[6]. Elle a été considérée dans un premier temps comme une espèce à part, comme dans la première édition de Fauna of British India parue en 1898[70], mais a ensuite été reléguée au rang de sous-espèce par Edward Charles Stuart Baker dans la seconde édition de 1929[71]. Son statut est revu, et il est à nouveau considéré comme une espèce distincte, le « Râle d'eau oriental », R. indicus, par Pamela Rasmussen dans son Birds of South Asia de 2005. Rasmussen, experte des oiseaux asiatiques, renomme également les formes occidentales du Râle d'eau[50],[72]. Sa classification n'a pas été suivie par la majorité des autres ornithologues, mais elle a été reprise dans Birds of Malaysia and Singapore (2010)[73]. Une étude de 2010 sur la phylogénie des râles à partir d'analyses moléculaires a montré que R. a. indicus a divergé des autres formes de Râle d'eau il y a environ 534 000 ans. Elle conclut également que les trois autres espèces forment un cline et qu'elles peuvent être toutes trois fondues dans R. a. aquaticus[30]. Cette classification s'impose petit à petit chez les ornithologues. Le Râle à joues brunes diffère du Râle d'eau par ses parties supérieures plus claires, ses parties inférieures teintées de brun et le trait brun passant sur l'œil. Il a un dessus plus sombre que R. a. korejewi, une poitrine plus brune et un trait plus visible sur l'œil[11]. Elle a un cri différent de celui du Râle d'eau, mais son comportement, son nid et ses œufs sont identiques à ceux de cette espèce[74].
Menaces et protection

Le Râle d'eau voit sa population globale décliner, mais il garde une très grande population composée de 100 000 à 1 000 000 d'adultes et une très vaste aire de répartition que l'on estime à 15 600 000 km2. C'est pourquoi l'espèce demeure classée comme étant de préoccupation mineure dans la liste rouge de l'UICN[1]. En Europe, où l'on compterait entre 140 000 et 350 000 oiseaux nicheurs, la population est assez stable, malgré quelques fortes chutes des effectifs localement[75]. C'est principalement la disparition de son habitat qui menace l'oiseau sur ce continent[76]. L'aire de répartition du râle et ses effectifs augmentent au Maroc, où on le trouve jusqu'à l'Oued Massa[15]. On sait peu de chose sur l'aire de répartition exacte en Asie, mais on sait que la sous-espèce korejewi se reproduit couramment au Pakistan et dans le Cachemire[50].
Certains prédateurs introduits menacent l'espèce, surtout dans les populations insulaires, plus vulnérables. En plus de l'extinction locale de la population islandaise, le vison (introduit pour sa fourrure dont à Lewis en Écosse[77]) est responsable du déclin marqué de la population de Râle d'eau dans les Hébrides, où la loutre était le seul carnivore naturel, et surtout intéressée par le poisson. Il s'est propagé à travers Harris, North Uist et South Uist[78]. Des programmes d'éradication des visons et des furets ont permis au râle de se rétablir dans ces îles y compris à Lewis et Harris[79], et d'autres projets sont en cours ou à l'étude dans les terres écossaises[80]. Localement, l'habitat du râle peut être affecté par le drainage des marais, la canalisation de cours d'eau et l'urbanisation[81],[82] ou par la pollution[83].
Le Râle d'eau est consommé par l'Homme depuis des centaines d'années[84]. Il était apprécié par les Romains[85],[86] et a été peint sur les murs de Pompéi[87]. Cette consommation s'est poursuivie durant tout le Moyen Âge et jusqu'aux temps modernes[88],[89].
Annexes
Articles connexes
- Rallus, le genre biologique ;
- Râle à joues brunes (Rallus indicus), ancienne sous-espèce du Râle d'eau ;
- Râle, l'appellation vernaculaire.
Bibliographie
- (en) Thomas Alfred Coward, The Birds of the British Isles and their eggs (two volumes), Londres, Frederick Warne,
- (en) Christopher R.W. Edwards et Ian A.D. Bouchier, Davidson's Principles and Practice of Medicine, Édimbourg, Churchill Livingstone, , 16e éd. (ISBN 0-443-04092-3)
- (en) Barry Taylor et Berl van Perlo, Rails, Robertsbridge, Sussex, Pica, (ISBN 1-873403-59-3)
- (fr) Michel Vallance, Faune sauvage de France: Biologie, habitats et gestion, Le gerfaut, , 415 p. (ISBN 2351910303 et 9782351910306)
- Brambilla M & Rubolini D (2004) Water Rail Rallus aquaticus breeding density and habitat preferences in northern Italy.— Ardea 92: 11–18.
Références taxinomiques
- (en) Référence Congrès ornithologique international : (consulté le )
- (en) Référence Zoonomen Nomenclature Resource (Alan P. Peterson) : Rallus aquaticus dans Gruiformes (consulté le )
- (en) Référence Tree of Life Web Project : Rallus aquaticus (consulté le )
- (en) Référence Catalogue of Life : Rallus aquaticus Linnaeus, 1758 (consulté le )
- (fr+en) Référence Avibase : Rallus aquaticus (+ répartition) (consulté le )
- (en) Référence Fauna Europaea : Rallus aquaticus Linnaeus, 1758 (consulté le )
- (fr+en) Référence ITIS : Rallus aquaticus Linnaeus, 1758 (consulté le )
Liens externes
- (fr) Référence Oiseaux.net : Rallus aquaticus (+ répartition) (consulté le )
- (en) Référence Animal Diversity Web : Rallus aquaticus (consulté le )
- (en) Référence NCBI : Rallus aquaticus (taxons inclus) (consulté le )
- (en) Référence uBio : Rallus aquaticus Linnaeus, 1758 (consulté le )
- (en) Référence UICN : espèce Rallus aquaticus (consulté le )
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Water Rail » (voir la liste des auteurs).
- Union internationale pour la conservation de la nature
- (fr) « Râle d'eau », sur Mission migration (consulté le )
- Vallance 2007, p. 393
- (fr) « Râle d'eau » [PDF], Fondation Hainard (consulté le )
- Oiseaux.net
- Taylor et van Perlo 2000, p. 293–299
- (en) Benito Fuertes, Javier García, Juan Fernández, Susana Suárez-Seoane et Juan José Arranz, « Can Iberian Water Rail Rallus aquaticus be sexed reliably using simple morphometrics? », Ringing & Migration, vol. 25, , p. 42–46 (lire en ligne)
- (en) S. Dillon Ripley et Bruce M. Beehler, Rails of the World, a compilation of new information 1975-1983 (Aves: Rallidae): Smithsonian Contributions to Zoology number 417, Washington, Smithsonian Institution Press, (lire en ligne), p. 8
- (en) Alexandra T. Stang et Susan B. McRae, « Why some rails have white tails: the evolution of white undertail plumage and anti-predator signaling », Evolutionary Ecolology, vol. 23, , p. 943–961 (DOI 10.1007/s10682-008-9283-z, lire en ligne)
- (en) Roy Brown, John Ferguson, Mike Lawrence et David Lees, Tracks and Signs of the Birds of Britain and Europe, Bromley, Kent, Christopher Helm, (ISBN 0-7470-0201-0), p. 208
- (en) Salim Ali et S. Dillon Ripley, Handbook of the Birds of India and Pakistan: Volume 2: Megapodes to Crab Plover, New Delhi, OUP India, , 2e éd., 149–151 p. (ISBN 0-19-565935-X)
- (fr)« Marouette ponctuée » (consulté le )
- (fr) Nicole Bouglouan, « Le râle d'eau dans son environnement », sur oiseaux-birds.com (consulté le )
- Coward 1930, p. 319–321
- (en) David Snow et Christopher M. Perrins, The Birds of the Western Palearctic concise edition, volume 1), Oxford, Oxford University Press, , 584–587 p. (ISBN 0-19-854099-X)
- (en) J.J.M. Flegg et David E. Glue, « A Water Rail study », Bird Study, vol. 20, no 1, , p. 69–80 (DOI 10.1080/00063657309476360)
- (fr) Nicole Bouglouan, « Râle d'eau », sur oiseaux-birds.com (consulté le )
- (en) Marc Herremans, « Body-moult and migration overlap in Reed Warblers (Acrocephalus scirpaceus) trapped during nocturnal migration », De Giervalk/Le Gerfaut, vol. 80, , p. 149–158
- (en) Peter Lack, The Atlas of Wintering Birds in Britain and Ireland, Calton, Staffordshire, T & A D Poyser, , 172–173 p. (ISBN 0-85661-043-7)
- (en) Edmund Meade-Waldo, « The Water Rail », The Aviculturalist, vol. 7, , p. 176 (lire en ligne)
- (en) William Yarrell, A history of British birds, volume 3, Londres, J Van Voorst, , 25–26 p.
- (en) Mark Cocker et Richard Mabey, Birds Britannica, Londres, Chatto & Windus, , 175–177 p. (ISBN 0-7011-6907-9)
- (en) Bengt Hansson, Staffan Bensch et Dennis Hasselquist, « Patterns of nest predation contribute to polygyny in the Great Reed Warbler », Ecology, vol. 81, no 2, , p. 319–328 (ISSN 0012-9658, DOI 10.1890/0012-9658(2000)081[0319:PONPCT]2.0.CO;2)
- (en) Michał Ciach, « Interference competition between rails and crakes (Rallidae) during foraging in the post-breeding season », Turkish Journal of Zoology, vol. 31, , p. 161–163 (lire en ligne)
- (en) Henry Seebohm, Coloured Figures of the Eggs of British Birds, Sheffield, Pawlson & Brailsford, , p. 86
- (en) Richard K.B. Jenkins, « The breeding biology of the Water Rail Rallus aquaticus in Britain and Ireland », Bird Study, vol. 46, no 3, , p. 305–308 (DOI 10.1080/00063659909461143)
- (en) « Water Rail Rallus aquaticus (Linnaeus, 1758) », sur BTOWeb BirdFacts, British Trust for Ornithology (consulté le )
- (en) European Union for Bird Ringing (EURING), « European Longevity Records », sur www.euring.org, (consulté le )
- (en) K. Schwarzová, T. Betáková, J. Neméth et A. Mizáková, « Detection of Borrelia burgdorferi sensu lato and Chlamydophila psittaci in throat and cloacal swabs from birds migrating through Slovakia », Folia Microbiologica, vol. 51, no 6, , p. 653–658 (PMID 17455806, DOI 10.1007/BF02931634, lire en ligne [archive du ])
- (en) Erika S. Tavares, Gerard H.J. de Kroon et Allan J. Baker, « Phylogenetic and coalescent analysis of three loci suggest that the Water Rail is divisible into two species, Rallus aquaticus and R. indicus », Evolutionary Biology, vol. 10, no 226, , p. 1–12 (DOI 10.1186/1471-2148-10-226)
- (en) Daniel Charles de la Hey, « The importance of birds in the diet of otter Lutra lutra on Shapwick Heath », Bioscience Horizons, vol. 1, no 2, , p. 143–147 (DOI 10.1093/biohorizons/hzn018, lire en ligne)
- (en) Edward Crisp, « Observations on Strongylus filaria and Botaurus stellaris », Proceedings of the Zoological Society of London, vol. 24, , p. 54
- Coward 1930, p. 85
- (en) Roger Clarke, André Bourgonje et Henk Castelijns, « Food niches of sympatric Marsh Harriers Circus aeruginosus and Hen Harriers C. cyaneus on the Dutch coast in winter », Ibis, vol. 135, no 4, , p. 424–431 (DOI 10.1111/j.1474-919X.1993.tb02115.x)
- (en) D.W. Yalden, « Dietary separation of owls in the Peak District », Bird Study, vol. 32, no 2, , p. 122–131 (DOI 10.1080/00063658509476867)
- (en) David E. Glue, « Feeding ecology of the Short-eared Owl in Britain and Ireland », Bird Study, vol. 24, no 2, , p. 70–78 (DOI 10.1080/00063657709476536)
- (en) Patrick Bayle et Richard Prior, « Prey species of Eagle Owl Bubo bubo in Lebanon », Sandgrouse, vol. 28, no 2, , p. 167–168 (lire en ligne)
- (en) Haralambos Alivizatos, Dimitris Papandropoulos et Stamatis Zogaris, « Winter diet of the Greater Spotted Eagle (Aquila clanga) in the Amvrakikos wetlands, Greece », Journal of Raptor Research, vol. 38, no 4, , p. 371–374
- (en) Antonius Johannes Cavé, « The breeding of the kestrel, Falco tinnunculus L. in the reclaimed area Oostelijk Flevoland », Netherlands Journal of Zoology, vol. 18, , p. 313–407
- (en) « Peregrines at Derby Cathedral » [archive du ], Derbyshire Wildlife Trust, Derby Cathedral and Derby Museum & Art Gallery (consulté le )
- (en) Henry Denny, Monographia anoplurorum Britanniae or an essay on the British species of parasitic insects belonging to the order anoplura of leach, Londres, Henry G Bohn, , p. 139
- (en) Theresa Clay et G.H.E. Hopkins, « The early literature on Mallophaga. Part 2. 1763-75 », Bulletin of the British Museum (Natural History). Entomology, vol. 2, , p. 1–42 (lire en ligne)
- (en) K.P. Martyn, Provisional atlas of the ticks (Ixodoidea) of the British Isles, Grange-over-Sands, Cumbria, Institute of Terrestrial Ecology, (ISBN 1-870393-09-0, lire en ligne), p. 26
- (en) Dennis S. Hill, « A study of the distribution and host preferences of three species Of Ornithomyia (Diptera: Hippoboscidae) in the British Isles », Proceedings of the Royal Entomological Society of London. Series A, General Entomology, vol. 37, nos 4–6, , p. 37 (DOI 10.1111/j.1365-3032.1962.tb00286.x)
- (en) Ricardo L. Palma et Jens-Kjeld Jensen, « Lice (Insecta: Phthiraptera) and their host associations in the Faroe Islands », Steenstrupia, vol. 29, no 1, , p. 49–73 (lire en ligne)
- (en) Warren T. Atyeo et Paul C. Peterson, « The feather mite genera Zumptia Gaud & Mouchet and Parazumptia gen. nov. (Acarina, Analgoidea) », Tijdschrift Voor Entomologie, vol. 119, , p. 327–335 (lire en ligne [archive du ])
- (en) A. Mižáková, P. Gronesová et T. Betáková, « Monitoring of influenza viruses in waterfowl and terrestrial birds in eastern Slovakia », Acta virologica, vol. 52, , p. 71–73 (lire en ligne)
- (en) S.R. Fereidouni, M. Aghakhan, O. Werner, E. Starick et M.H. Bozorghmehrifard, « Isolation and identification of avian influenza viruses from migratory birds in Iran », Veterinary Record, vol. 157, no 17, , p. 526 (DOI 10.1136/vr.157.17.526)
- (fr) Guy Bordin et Michel Breuil, Islande, le guide de l'île aux volcans: avec les îles Féroé, Marcus, coll. « Les guides du voyageur », , 543 p. (ISBN 271310226X et 9782713102264), p. 168
- (en) Pamela C. Rasmussen et John C. Anderton, Birds of South Asia, vol. 2 : Attributes and Status, Barcelone, Lynx Edicions, (ISBN 84-87334-65-2), p. 141–142
- (en) Gerard H.J. De Kroon, « A comparison of two European breeding habitats of the Water Rail Rallus aquaticus », Acta Ornithologica, vol. 39, no 1, , p. 21–27 (DOI 10.3161/0001645044213992)
- (en) Gerard H.J. de Kroon et Maria H.J. Mommers, « Breeding of the Water Rail Rallus aquaticus in Cladium mariscus vegetation », Ornis Svecica, vol. 12, , p. 69–74 (lire en ligne)
- (en) Richard K.B. Jenkins et Steve J. Ormerod, « Habitat preferences of breeding Water Rail Rallus aquaticus: Surveys using broadcast vocalizations during the breeding season found that Water Rail were significantly more abundant at sites that contained the most wet reed Phragmites sp », Bird Study, vol. 49, no 1, , p. 2–10 (DOI 10.1080/00063650209461238)
- (en) Raimo Virkkala, Miska Luoto, Risto K. Heikkinen et Niko Leikola, « Distribution patterns of boreal marshland birds: modelling the relationships to land cover and climate », Journal of Biogeography, vol. 32, no 11, , p. 1957–1970 (DOI 10.1111/j.1365-2699.2005.01326.x)
- (en) Gerard H.J. de Kroon et Maria H.J. Mommers, « Why is the Water Rail Rallus aquaticus a very scarce breeder north of 61°N? », Ornis Svecica, vol. 13, , p. 47–52 (lire en ligne)
- (en) Claudio Celada et Giuseppe Bogliani, « Breeding bird communities in fragmented wetlands », Italian Journal of Zoology, vol. 60, no 1, , p. 73–80 (DOI 10.1080/11250009309355794)
- (en) Killian Mullarney, Lars Svensson, Dan Zetterstrom et Peter Grant, Collins Bird Guide, Londres: Collins, (ISBN 0-00-219728-6), p. 124
- (en) Richard K.B. Jenkins, S.T. Buckton et Steve J. Ormerod, « Local movements and population density of Water Rails Rallus aquaticus in a small inland reedbed », Bird Study, vol. 42, no 1, , p. 82–87 (DOI 10.1080/00063659509477152)
- Taylor et van Perlo 2000, p. 29
- (en) Les Christidis et Walter Boles, Systematics and taxonomy of Australian birds, Collingwood, Victoria, CSIRO, (ISBN 0-643-06511-3), p. 120
- (en) S.A. Trewick, « Flightlessness and phylogeny amongst endemic rails (Aves: Rallidae) of the New Zealand region », Philosophical Transactions of the Royal Society of London B, vol. 352, , p. 429–446 (PMID 9163823, PMCID 1691940, DOI 10.1098/rstb.1997.0031, lire en ligne)
- (la) C. Linnaeus, Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Tomus I. Editio decima, reformata., Holmiae:Laurentii Salvii, , p. 153
- (en) Zlatovar Boev, « Fossil birds in the National Museum of Natural History, Sofia: composition, development and scientific value », Zoologische Mededelingen Leiden, vol. 79–3, no 4, , p. 35– 44 (lire en ligne)
- (en) Antonio Sánchez Marco, « Avian zoogeographical patterns during the Quaternary in the Mediterranean region and paleoclimatic interpretation », Ardeola, vol. 51, no 1, , p. 91–132 (lire en ligne)
- (en) Spencer G. Lucas, Chinese fossil vertebrates, New York, Columbia University Press, (ISBN 0-231-08483-8), p. 283
- (en) M. Mcminn, M. Palmer et Josep Antoni Alcover, « A new species of rail (Aves: Rallidae) from the Upper Pleistocene and Holocene of Eivissa (Pityusic Islands, western Mediterranean) », Ibis, vol. 147, no 4, , p. 706–716 (DOI 10.1111/j.1474-919X.2005.00442.x)
- (ca) Josep Antoni Alcover, « Nous avenços en el coneixement dels ocells fòssils de les Balears », Anuari Ornitològic de les Balears, vol. 16, , p. 3–13 (lire en ligne)
- (en) Thomas Kellner, Mathias Krech, Axel Schulz et Carsten H.G. Müller, « The avifauna of Ibiza: an updated checklist including comments on abundances and ecology », Rostocker Meeresbiologische Beiträge, vol. 18, , p. 7–29 (lire en ligne)
- (en) Allan Octavian Hume et C.H.T. Marshall, Game Birds of India, Burmah and Ceylon, volume 2, Calcutta, self-published, (lire en ligne), p. 257–260
- (en) W.T. Blanford, The Fauna of British India, Including Ceylon and Burma. Birds, volume 4, Londres, Taylor and Francis, , 158–160 p. (lire en ligne)
- (en) E.C.S. Baker, The Fauna of British India, Including Ceylon and Burma. Birds, volume 6, Londres, Taylor and Francis, , 2e éd. (lire en ligne), p. 4–7
- (en) P.C. Rasmussen, « Biogeographic and conservation implications of revised species limits and distributions of South Asian birds », Zoologische Mededelingen Leiden, vol. 79-3, no 13, , p. 137–146 (lire en ligne)
- (en) D.W.H. Davidson et Chin Aik Yeap, Naturalist's Guide to the Birds of Malaysia and Singapore, Taunton, Somerset, John Beaufoy Publishing, (ISBN 978-1-906780-21-0), p. 155
- (en) Henry Eeles Dresser, A manual of Palearctic birds: part II, London, , p. 705
- Vallance 2007, p. 394
- (fr) Jean-Philippe Paul, « Râle d'eau // Rallus aquaticus », Liste rouge des vertébrés terrestres de Franche-Comté (consulté le )
- (en) N.P. Moore, S.S. Roy et A. Helyar, « Mink (Mustela vison) eradication to protect ground-nesting birds in the Western Isles, Scotland, United Kingdom », New Zealand Journal of Zoology, vol. 30, no 4, , p. 443–452 (DOI 10.1080/03014223.2003.9518351)
- (en) « Outer Hebrides Biosecurity Plan 2010–2015 » [archive du ], Outer Hebrides Fisheries Trust (consulté le )
- (en) « Consultation draft - March 2001 », sur The natural heritage of the Western Isles, Scottish Natural Heritage (consulté le )
- (en) « American mink 'safe haven'project under way », sur BBC News Scotland, 12 mai 2011, BBC, (consulté le )
- (en) David Wingfield Gibbons, James B. Reid et Robert A. Chapman, The New Atlas of Breeding Birds in Britain and Ireland: 1988-91, Calton, Staffordshire, T & A D Poyser, (ISBN 0-85661-075-5), p. 146–147
- (fr) Pascal Durantel, Chasse du gibier d'eau, Artemis, coll. « La bibliothèque du chasseur », , 143 p. (ISBN 9782844167149), p. 18
- (en) E. Carpenè, R. Serra et G. Isani, « Heavy metals in some species of waterfowl of northern Italy », Journal of Wildlife Diseases, vol. 31, no 1, , p. 49–56 (PMID 7563424)
- (en) Nicola Botev, Proceedings of the 22nd Congress of the International Union of Game Biologists 1995: The game and the man, Sofia, Pensoft Publishers, (ISBN 954-642-013-1)
- (en) Lindsay Allason-Jones, Women in Roman Britain, York, Council for British Archaeology, (ISBN 1-902771-43-5), p. 103
- (en) W. Prummel, J.T. Zeiler et D.C. Brinkhuizen, Birds in Archaeology: Proceedings of the 6th Meeting of the ICAZ Bird Working Group in Groningen 23.8-27.8.2008, Eelde, Barkhuis, (ISBN 978-90-77922-77-4)
- (en) Wilhelmina Mary Feemster Jashemski et Frederick Gustav Meyer, The natural history of Pompeii, Cambridge, Cambridge University Press, (ISBN 0-521-80054-4)
- (en) Oliver L. Austin Jr et Kuroda Nagahisa, « The Birds of Japan: their status and distribution », Bulletin of the Museum of Comparative Zoology, vol. 109, no 1, , p. 403–404 (lire en ligne)
- (en) C.M. Woolgar, Dale Serjeantson et Tony Waldron, Food in medieval England: diet and nutrition, Oxford, OUP, (ISBN 0-19-927349-9)
- Portail de l'ornithologie
- Portail des lacs et cours d'eau
