Rhizosphère
La rhizosphère est la région du sol directement formée et influencée par les racines et les micro-organismes associés qui font partie du microbiote des plantes. Cette zone est réduite à une ou deux dizaines de centimètres d'épaisseur sous des pelouses ou des prairies, mais elle est parfois beaucoup plus épaisse dans les forêts des zones tempérées.
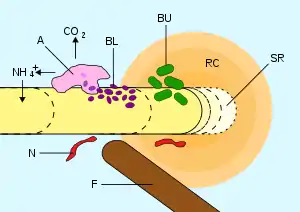
Cette région est caractérisée par sa biodiversité microbienne, et notamment sa richesse en bactéries et champignons microscopiques[1], la rhizosphère étant le lieu privilégié d'échanges entre ces micro-organismes et les végétaux, échanges qui se traduisent par des modifications des propriétés physiques et chimiques du sol rhizosphérique. L'ensemble de ces modifications détermine l’effet rhizosphère.
Étymologie
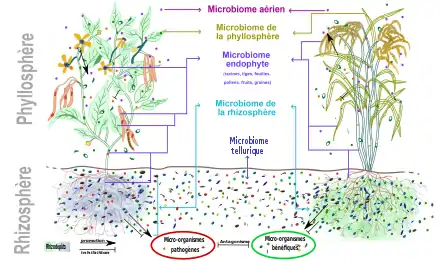
On retrouve aussi sur et dans la plante des microbes plus ou moins ubiquistes et opportunistes, éventuellement pathogènes provenant de l'air et du sol.
Le mot rhizosphère a été introduit en 1904 par Lorenz Hiltner[2], bactériologiste spécialiste de microbiologie du sol et professeur d'agronomie au collège Technique de Munich[3]. « Rhizo » vient du grec rhiza signifiant racine. « Sphère » vient du latin sphaera (même sens), mot provenant lui-même du grec ancien sfaira (signifiant balle, ballon, ou globe). La sphère définit le champ d'influence du système racinaire. En raison du volume qu'elle occupe, par rapport au volume de la plante, la rhizosphère est aussi appelée la « moitié cachée » (the hidden half en anglais)[4]. Au niveau pédologique, la rhizosphère occupe 1 à 3 % du volume du sol[5].
Enjeux de connaissance et de protection
C'est un lieu d'intenses échanges entre le végétal et le substrat minéral[6], qui peut être affecté par le tassement du sol, un ennoiement durable, sa salinisation, son eutrophisation ou la pollution, ou encore par des phénomènes d'aridification.
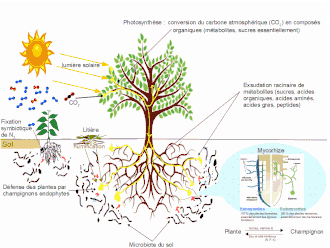
C'est dans la rhizosphère que par le biais des racines, le végétal s'ancre dans le sol, y puise les ressources minérales (cations, anions) et l'eau qu'il utilise pour sa croissance et sa régulation thermique par le processus d'évapotranspiration. Une plante transpire ainsi chaque jour l'équivalent de 5 fois sa biomasse environ, soit près de 1 500 fois sa masse chaque année.
Elle joue un rôle important dans la résistance des sols à l'érosion, au gel, aux incendies, aux inondations, etc. De même pour la résilience de ces sols et des plantes cultivées (les enjeux sont donc également agronomiques)[7],[8].
Au fil de l'histoire évolutive des végétaux, un réseau d'interactions extraordinairement complexe et diversifié s'est tissé entre les plantes et les micro-organismes. Cette évolution a conduit à la sélection de traits biologiques, notamment l'effet rhizosphère qui assure le recrutement de populations microbiennes (microbiote tellurique) ayant des activités favorables à la croissance et à la santé de la plante hôte, contribuant ainsi à son adaptation aux stress biotiques (attaque de pathogènes, compétition intraspécifique et interspécifique) et abiotiques (stress hydrique, carence en nutriments carbonés et minéraux)[9]. Ce recrutement spécifique est un processus dynamique qui évolue au cours du temps (développement végétal) et de l'espace (zones racinaires)[10].
Activité de la rhizosphère
L'activité de la rhizosphère est conditionnée par la dynamique de la biomasse racinaire. Environ 30, 50 et 75 % de la biomasse racinaire totale se trouvent respectivement dans les 10, 20 et 40 premiers centimètres du sol[11]. Jusqu'à 30 % des composés photosynthétisés par la plante[12] y sont remis à la disposition des micro-organismes qui y vivent, par le biais d'un processus de rhizodéposition (sécrétion racinaire active, exsudation racinaire passive, rhizodépôts de types mucilages, lysats, gaz)[13],[14].
Ces composés incluent une grande quantité d'acides organiques et de sucres, ainsi que des quantités plus limitées de composés organiques complexes. Ils sont transformés en biomasse microbienne ou ré-oxydés en CO2.
Les organismes vivants de la rhizosphère bénéficient de cette activité végétale, qui joue aussi un rôle dans la dissolution de près de 30 % du calcaire du substrat. Il faudrait déverser 500 litres d'acide chlorhydrique sur chaque mètre cube de sol pour obtenir un effet équivalent purement chimique de cette dissolution[15].
De nombreuses interactions, bénéfiques (symbioses) ou non, voire néfastes (pathogénie) sont observées entre plantes, bactéries et champignons du sol, « dopant » l'activité biologique de ce sol. Parmi les interactions bénéfiques aux plantes, on peut citer les symbioses fixatrices d'azote, les associations avec les bactéries promotrices de croissance (RFCP) ou de santé (phénomène de suppression de maladie), ou les interactions avec les champignons mycorhizogènes (voir aussi la définition de la mycorhizosphère) ou jouant un rôle dans la défense des plantes. Les effets délétères sont souvent liés à l'action de bactéries ou champignons pathogènes. Ils peuvent aussi être lié à des phénomènes de parasitisme végétal (tels ceux induits par les Striga ou les Orobanches) ou d'allélopathie qui conduisent à l'impossibilité pour certains végétaux d'occuper le même espace de sol (effet d'inhibition de croissance de l'un des deux sur l'autre).
De nombreuses interactions négatives avec la faune (notamment les larves d'insectes et les nématodes herbivores qui s'alimentent des racines) ont été étudiés pendant des décennies. Pourtant, de nombreuses interactions positives peuvent être observées. Les protozoaires et nématodes qui se nourrissent des bactéries sont aussi concentrés autour des racines, où ils se nourrissent de bactéries et peuvent favoriser la disponibilité des nutriments par biodégradation et minéralisation des matières organiques et des corps microbiens. Ainsi, la plupart du cycle des nutriments et des phénomènes de prédation se déroule dans la zone immédiatement adjacente aux racines[16],[17].
Siège d'une activité métabolique intense, d'échanges génétiques importants, la rhizosphère joue un rôle essentiel dans les processus de phytoremédiation.
Facteurs déterminant la richesse et l'activité de la rhizosphère
D'une façon générale, l’activité microbienne dans la rhizosphère est régie :
- par des facteurs de l’environnement climatique, notamment humidité de l’air, température, radiation solaire, teneur en CO2 ;
- par des facteurs de l’environnement édaphique, notamment : teneur du sol en eau et en oxygène, température du sol, teneur du sol en éléments assimilables par les plantes, présence de composés phytotoxiques[18] ;
- par des échanges de « molécules signal entre les racines des plantes et les microorganismes qui leur sont associés » (champignons, bactéries, cyanobactéries...) mais quand il y a par exemple une symbiose associative entre les RFCP (rhizobactérie favorisant la croissance des plantes) et une plante, le rôle et l’importance de ces molécules est encore mal connu. Les signaux rhizosphériques influent sur l'expression génique (« épigénétique »). Ils sont souvent « phytobénéfiques » en améliorant par exemple l’architecture, la croissance et le fonctionnement du système racinaire[19].
La rhizosphère est modifiée en termes de communauté et diversité microbienne. La racine filtre activement ces communautés[20].
Notes et références
- La rhizosphère est composée également, en moindre proportion, de protozoaires et algues unicellulaires. Cf (en) Nanjappa Shamanna Subba Rao, Soil Microbiology, Science Publishers, , p. 46
- (en) Anton Hartmann, Michael Rothballer & Michael Schmid, « Lorenz Hiltner, a pioneer in rhizosphere microbial ecology and soil bacteriology research », Plant and Soil, vol. 312, nos 1-2, , p. 7 (DOI 10.1007/s11104-007-9514-z)
- G.R. Gobran, W.W. Wenzel, E. Lombi, Trace Elements in the Rhizosphere. CRC Press 2001. Cité dans Microbial Health of the Rhizosphere (Researcher: Nikol Heckathorn ; Writer: Laura Reinhold ; Programmer: Tiffany White)
- Bowen et Roriva, 1991
- (en) George R Gobran, Stephen Clegg, « A conceptual model for nutrient availability in the mineral soil-root system », Canadian Journal of Soil Science, vol. 76, no 2, (DOI 10.4141/cjss96-019).
- ANOUA, B., Jaillard, B., RUIZ, J., Bénet, J. C., & Cousin, B. (1997). Couplage entre transfert de matière et réactions chimiques dans un sol. Partie 2: Application à la modélisation des transferts de matière dans la rhizosphère. Entropie, 33(207), 13-24.
- Kraffczyk, I., Trolldenier, G., & Beringer, H. (1984). Soluble root exudates of maize: influence of potassium supply and rhizosphere microorganisms. Soil Biology and Biochemistry, 16(4), 315-322.
- Kodama, H., Nelson, S., Yang, A. F., & Kohyama, N. (1994). Mineralogy of rhizospheric and non-rhizospheric soils in corn fields. Clays and clay minerals, 42(6), 755-763.
- Philippe Lemanceau et Manuel Blouin, Les sols au cœur de la zone critique, ISTE Editions, (lire en ligne), p. 59.
- Lemanceau, op. cit., p.60
- (en) Canadell, J., Jackson, RB., Ehleringer, J.R, Mooney, H.A., Sala, O.E., Schulze, E.D., 1996. Maximum rooting depth of vegetation types at global scale. Oecologia 108, 583-595
- Le flux de composés carbonés est mesuré par traçage isotopique. Cf(en) Philippe Hinsinger, A.G. Bengough., D. Vetterlein, I. M. Young, « Rhizosphere: biophysics, biogeochemistry and ecological relevance », Plant and Soil, vol. 321, nos 1-2, , p. 117-152 (DOI 10.1007/s11104-008-9885-9)
- (en) J. M. Lynch, J. M. Whipps, « Substrate flow in the rhizosphere », Plant and Soil, vol. 129, no 1, , p. 1-10
- Dans les sols hydromorphes ou les sédiments submergés anoxiques, l'aérenchyme racinaire des plantes (riz, salicorne) assure la diffusion d'oxygène dans le sol rhizosphérique, formant une gaine oxique autour de la racine qui apporte de l'oxygène aux populations bactériennes microaérophiles, leur permettant de respirer ou pour d'autres bactéries d'oxyder les ions ferreux en dépôts ferriques inertes (couleur rouille autour des racines). Cf. (en) William Armstrong, Roland Brändle, Michael B. Jackson, « Mechanisms of Flood Tolerance in Plants », Acta botanica Neerlandica, vol. 43, no 4, , p. 307-358 (DOI 10.1111/j.1438-8677.1994.tb00756.x).
- Hinsinger, P.;Jaillard, B.;Arvieu, J.C. 1996, INRA, Département de Science du sol; Paris ;Le sol, un patrimoine menacé, le point scientifique
- Elaine R. Ingham, The Soil Food Web. National Ressources Conservation Service.
- .
- Y. Dommergues, Mycorrhizes et fixation d’azote. O.R.S.T.O.M. avril 1978
- Combes-Meynet, É. (2010). Impact de signaux rhizosphériques sur l’expression de gènes phytobénéfiques chez les bactéries symbiotiques associatives (Doctoral dissertation, Lyon 1). (résumé)
- (en) T.R. Turner, E.K. James, P.S. Poole, « The plant microbiome », Genome Biology, vol. 14, no 6, , p. 209 (DOI 10.1186/gb-2013-14-6-209).
Voir aussi
Articles connexes
Bibliographie
- Curl EA & Truelove B (1986) The rhizosphere ; Springer-Verlag.
- Hinsinger P (2001) Bioavailability of soil inorganic P in the rhizosphere as affected by root-induced chemical changes : a review ; Plant and soil, 237(2), 173-195.
- Lemanceau P & Heulin T (1998) La rhizosphère, in Sol : interface fragile, INRA Edition, 93-106.
- Portail de l’agriculture et l’agronomie
- Portail de la biologie
- Portail de la protection des cultures