Microbiote des plantes
Le microbiote des plantes, appelé aussi phytobiote, est le microbiote constitué de la communauté de micro-organismes bactériens et fongiques plus ou moins mutualistes ou symbiotiques, associée à la plupart des plantes[2] :
- une partie du microbiote, dite « rhizosphérique » est intimement associée aux racines ;
- une autre part est externe (épiphyte, c'est-à-dire sur les écorces, les tiges et les feuilles des plantes[3] ; dans ce dernier cas, les micro-organismes symbiotes sont presque toujours uniquement en surface immédiate de la feuille dite « phyllosphère » ou de la tige dite « caulosphère », ou des micro-habitats spécifiques comme l'anthosphère pour les fleurs, la carposphère pour les fruits et la spermosphère pour les graines).
- une dernière part, composée de micro-champignons ou de bactéries endophytes (endosphère), vit pour tout ou partie à l'intérieur des feuilles ou de certaines cellules végétales (dans les céréales notamment).
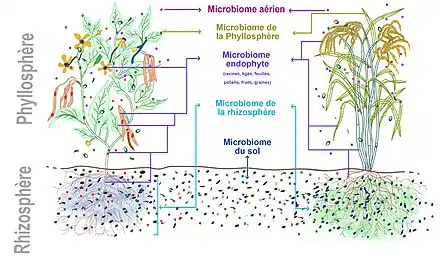
On retrouve aussi sur (voire dans) la plante des microbes plus ou moins ubiquistes et opportunistes, éventuellement pathogènes provenant de l'air et du sol.

Sharon L. Doty et al., dans une étude de 2016[1] montrent qu'une part du microbiote est formé non pas de bactéries et champignons rhizosphériques mais de bactéries endophytes diazotrophes de l'intérieur des branches, qui aident efficacement à capter l'azote ambiant (et non directement bioassimilable par les végétaux).
Le microbiome de la plante est appelé phytobiome.
Ce microbiote est étudié depuis au moins les années 1950[4] et fait l'objet de nombreuses découvertes.
L'un des enjeux d'une meilleure connaissance du microbiote des végétaux est de l'utiliser comme allié en agriculture, voire pour la dépolluer des sols ou de l'eau (pollution azotée en particulier, responsable de l'acidification et de l'eutrophisation et d'un appauvrissement de nombreux habitats et écosystèmes).
Historique des découvertes
De nombreux types de symbioses entre organismes sont connus et semblent faire partie des mécanismes importants de l'évolution et de la sélection naturelle[5].
La mycologie et la botanique ont depuis plusieurs décennies montré que le système racinaire des plantes abrite des symbioses complexes et souvent vitales (avec des champignons et des bactéries principalement, externes ou endophytes, internes). Ces symbioses permettent notamment aux végétaux de mieux capter l'azote comme nutriment mais elles présentent aussi de nombreux autres avantages pour les plantes (et leurs symbiotes).
Bactéries fixatrices d'azote dans les racines... et les feuilles
Des bactéries fixatrices d'azote ont d'abord été trouvées et étudiées dans les nodules racinaires développés par les légumineuses (Fabacées) puis, à l’intérieur même de certaines plantes alors dites actinorhiziennes (abritant des actinomycètes dans des structures actinorhizes). Ce type de symbioses - envisagées d'abord associées aux racines[6] puis aux aiguilles de certains résineux[7] permet à certains végétaux d'avoir une croissance plus rapide, voire très rapide, en particulier chez des espèces ou variétés de grand intérêt agricole[8], commercial et alimentaire comme la (canne à sucre[9]).
Une partie du microbiote des plantes, découverte en 2009 et 2016[1], est cachée dans la portion aérienne des arbres, dans les aiguilles des essences pionnières résineuses et dans les branches d'arbres des Salicaceae (saules (Salix sp.)[10] et peupliers (Populus sp.). Elle explique que ces taxons peuvent croitre facilement sur des substrats pourtant très pauvres et notamment carencés en azote bioassimilable[1].
Élagage naturel

L'élagage naturel, appelé autoélagage, élimine les branches affaiblies (parasitisme de faiblesse) ou mortes (mort par manque de lumière ou tuées par des champignons localement parasites)[11], favorisant l’élévation de la couronne et l’installation du houppier définitif. Il se révèle donc utile à l'adaptation d'une structure ligneuse à son environnement, participe à la construction de l'architecture d'un individu, et fait intrinsèquement parti de l'écosysteme et de l'équilibre d'un peuplement.
Il implique l'activité d'une communauté microbienne spécialisée qui parasite les tissus ligneux affaiblis (organismes biotrophes), les tue puis décompose les branches manquant de lumière (organismes nécrotrophes), ou simplement des micro-organismes saprotrophes (saproxyliques et saproxylophages) qui consomment des branches déjà mortes. Plusieurs études mettent en évidence la diversité taxonomique de ce groupe d'« élagueurs » : Stereum gausapatum, Vuilleminia comedens (de), Peniophora quercina, Phellinus ferreus (en), Phlebia rufa sur les branches de chênes ; Daldinia concentrica, Hypoxylon rubiginosum, Peniophora lycii et Peniophora quercina sur celles de frêne[12],[13].
L'absence de la communauté microbienne associée à des arbres importés dans une région et propre à chaque espèce ligneuse (épicéas en plaine, Pin de Monterey et cyprès introduits de Californie en Bretagne) a pour conséquence que l'élagage naturel ne s'effectue plus. L'aspect lisse du tronc correspond ainsi à une sculpture microbienne, les agents d'élagage étant des champignons microscopiques[14].
Découvertes d'un endomicrobiote aérien chez les végétaux
Jusqu'en 2010, les endosymbioses bactériennes fixatrices d'azote n’étaient connues avec certitude que chez les graminées tropicales ou certains arbres, mais uniquement au niveau racinaire ou en situation d'épiphytes, sur les feuilles. Ces endosymbioses bactériennes étaient auparavant soupçonnées dans les parties aériennes de quelques essences d'arbres[1].
Au début du XXIe siècle, des chercheurs intrigués par la capacité de certaines essences pionnières à s'enraciner et à grandir rapidement dans des substrats trop pauvres pour leur offrir une quantité suffisante d'azote ont soupçonné qu'il existait aussi des endosymbioses aériennes chez les certains arbres (pins, robiners et aulnes) avec des effets d'abord uniquement expliqués par des réactions de dénitrification[15],[1].
Deux études récentes (2012 et 2016) montrent que des résineux croissant sur des substrats rocheux très pauvres en azote pouvaient également abriter à l’intérieur de leurs aiguilles des colonies de bactéries fixatrices d'azote ; il s'agit des essences américaines du Pin tordu (Pinus contorta)[7], du Thuya géant (Thuja plicata)[16] dont certains tissus abritent des bactéries des genres Paenibacillus et Dyadobacter, fixatrices d'azote[17] et du Pin flexible (Pinus flexilis)[18].
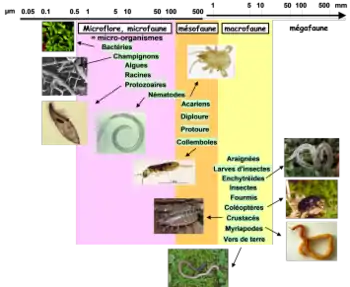
Composition (de la communauté associée)

.jpg.webp)

- Fonge : la plupart des espèces végétales terrestres ont une ou plusieurs espèces de champignons qui les mycorhizent.
- Bactéries : selon les données disponibles au début des années 2010, la diversité taxonomique des bactéries du microbiote est relativement réduite, avec composition phylogénétique se résumant à quelques embranchements bactériens avec pour la rhizosphère notamment Actinobacteria, Bacteroidetes, Firmicutes & Proteobacteria[19].
Fonctions
Les animaux sont associés à un microbiote interne et externe qui semble toujours principalement bactérien bien qu'il abrite également des champignons et des protozoaires et quelques organismes parasites ou commensaux (qui aident généralement leurs hôtes à mieux vivre). Ce microbiote influence notamment l'efficacité de la nutrition et la qualité du système immunitaire vital pour la santé de l'hôte. Comme chez les plantes[20], cette association se réalise avec d'autres communautés et quelques spécificités.
Comme les animaux et toutes les espèces connues, les plantes ont besoin d'un nutriment vital : l'azote (N). Elles ne peuvent cependant pas l'utiliser sous sa forme N2 la plus commune (plus de 75 % de l’air), elles doivent le capter dans l'environnement sous forme de nitrates principalement mais il y est parfois rare. Au cours de l'évolution et de la coévolution entre les plantes et les micro-organismes abondamment présents dans les sols, la plupart des plantes ont développé des relations symbiotiques en s'associant certaines bactéries, capables en milieu anoxique ou appauvri en oxygène, de transformer l'azote de l'atmosphère (présent dans un sol suffisamment aéré) en azote biodisponible. Elles le font via un enzyme, la nitrogénase que les plantes ne peuvent biosynthétiser et qui ne fonctionne qu'à l’abri de l’oxygène[1].
Ce microbiote végétal rend certaines plantes plus tolérantes au sel, aux températures extrêmes et, permet la production de vitamines et phytohormones pour un meilleur captage des oligo-éléments, augmente leur résistance à certains microbes pathogènes, détoxifie certains polluants (dans la plante et aussi le sol) et, augmente fortement la capacité des végétaux à prélever des nutriments dans le sol, l'air et/ou l'eau[19],[21],[22],[23] et par suite à décolmater le sol de leurs exsudats et de leur nécromasse, de l'enrichir au profit de l'humification, du captage de carbone (puits de carbone) et plus généralement de la biodiversité des sols (pédoflore et pédofaune) et de la biosphère.
Enjeux
Mieux connaitre et comprendre ces symbioses est un enjeu dans de nombreux domaines.
Services écosystémiques
- les espèces pionnières comme le saule et peuplier offrent d'importants services environnementaux pour l'eau, l'air, les sols, les puits de carbone, les paysages, le tourisme, etc.[24]. Les symbiotes microbiotiques permettent à certains arbres de pousser plus en altitude (jusqu'au niveau de la fonte des neiges parfois - en limite supraforestière), et secondairement ils permettent ainsi à une espèce ingénieur comme le Castor de coloniser des milieux situés plus en altitude, (le castor fiber était autrefois présents en France jusqu'à 2 000 m d'altitude selon des données paléontologiques) et d'y édifier ses barrages qui contribuent à réguler le flux de l'eau ainsi qu'à offrir de nouveaux milieux propices à la biodiversité [38, 39].
- les endosymbioses aériennes récemment découvertes dans les branches d'arbres peuvent améliorer la ressource en bois-énergie, biomasse-énergie toute en contribuant à réguler la teneur de l’air en azote (eutrophisant et acidifiant des pluies) et en améliorant les puits de carbone d'altitude. Ce microbiote est donc aussi un enjeu pour les questions de gestion, restauration et protection de la nature [25].
- la stabilisation de phénomènes d'érosion des sols : de 2010 à 2012, plusieurs études ont porté sur l’identification du microbiome de Populus deltoides et du peuplier hybride, et sur son implication dans la promotion de la croissance de ces arbres, y compris en milieu pollué[26],[27],[28],[29],[30].
- dépollution de sols dégradés ou vulnérables : dans la nature, le peuplier P. trichocarpa peut prospérer sur des substrats neufs et presque dépourvus d’azote et de sol, là où la fonte de neiges alpine a érodé le sol et déposé des galets et du sable[31], comme en zone rivulaire de la Snoqualmie River[32] où le sol est presque exclusivement minéral (sable et galets) et où l’eau est naturellement très pauvre en azote (0,15 mg d'azote sous forme NO3− et 0,30 mg sous forme de NH4-[Quoi ?] par litre d’eau en 2011). On avait d’abord pensé que ce peuplier était capable d’exploiter au mieux la matière organique en place et notamment l'azote organique du milieu, mais ce milieu en est presque exempt. Une bactérie endophyte (Rhizobium tropici) a d’abord été observée à l’intérieur de peupliers hybrides cultivé en serre (dans des substrats hydroponiques ou de gélose préparés pour qu’ils ne contiennent pas d’azote). Puis plusieurs autres espèces endophytes diazotrophes ont été isolées à partir de peuplier sauvage dans une zone riveraine naturelle dominée par des galets[33] (les bactéries ont été extraites de l’intérieur d’échantillons de branches d’abord préalablement désinfectés sur toute leur surface). En inoculant ces endophytes elles se sont montrées être des symbiotes efficaces chez d'autres espèces et familles de plantes, dont chez des graminées[34], le maïs[35], le riz[36], et d’autres plantes cultivées aussi différentes que la tomate, le poivron, la courge ou encore l'herbe utilisée pour les gazons[37] (ce qui pourrait intéresser les propriétaires de golf qui dépensent beaucoup d'argent en engrais et pesticides (Cf article Golf et environnement). Toutes ces plantes ont montré après inoculation une meilleure croissance et une bonne santé dans de mauvaises conditions nutritives (sol carencé en azote). Ces bactéries endophytes ont ainsi permis de doubler le rendement de deux variétés de tomates inoculées, et la teneur en azote foliaire des feuilles de plants d'ivraie expérimentalement inoculés a augmenté (jusqu'à + 26 %) et jusqu'à 6 fois pour l’azote racinaire[37].
- Dépollution de l'eau par les plantes ; le microbiote de végétaux aquatique (hélophytes ou arbres tels que l'aulne) contribue à mieux « pomper » l'azote qui est un eutrophisant problématique de l'eau. Une partie de ce microbiote semble aussi capable de minéraliser certains surfactants qui sont d'autres polluants préoccupants de l'eau[38]
Agriculture
Agriculture de façon large : La culture sélective des plantes constitue un enjeu majeur depuis l'émergence de la pratique agricole, il y a plusieurs milliers d'années.
- De nombreuses études ont porté sur l'amélioration de la productivité des céréales et notamment du blé[39],[1] ;
- santé environnementale ; elle passe par le bon état des écosystèmes, et donc notamment de l'arbre, des ripisylves des haies et des forêts (touchées depuis quelques décennies par des maladies émergentes); les arbres étant condamnés à une immobilité relative, leurs symbioses microbiennes leur sont particulièrement vitales. Comprendre ce phénomène et quelles sont les bactéries impliquées pourrait conduire à améliorer la productivité agricole. Le microbiote récemment découvert chez certains arbres pionniers, leur permet de pousser sur des sols considérés comme particulièrement infertiles (oligotrophes) en améliorant localement le puits de carbone, en protégeant les sols[1].
- une certaine agriculture pourrait devenir moins dépendante des engrais azotés de synthèse, au profit d’une façon plus naturelle de stimuler la productivité de plantes cultivées (Cf. permaculture). En effet, le microbiote rhizosphérique peut suppléer à une partie significative de l'azote aujourd'hui apporté par des engrais de synthèse[40]. Il a été montré que les communautés microbiennes isolées sur les branches du peuplier Populus trichocarpa et de saules en situation pionnière sur des sols pauvres en azote, se sont aussi montrées capables d’aider le maïs, la tomates et le poivrons comme les graminées et des arbres de la forêt à croître avec moins d’engrais[1].
Sylviculture :
- Domaine des bioénergies : bouleaux, saules et peupliers ne sont pas les bois les plus intéressants énergétiquement (en termes de biomasse énergie), mais ils sont parfois utilisés pour la bioénergie ainsi que par la filière bois-matériau[1].
- sylviculture & agrosylviculture ; Il est maintenant démontré que des bactéries endophytes diazotrophes peuvent être prélevées à l'intérieur de tiges d'espèces sauvages, et inoculées à d'autre espèces : Ceci a été expérimenté à partir de peupliers sauvages avec des bactéries prélevées, cultivées et inoculées chez des peupliers hybrides élevés en conditions contrôlée (sous serre). Cette inoculation a entraîné une augmentation de la teneur totale en chlorophylle des feuilles et de la teneur totale en azote des racines. Chez les plantes inoculées, il a été estimé que 65 % de leur azote provenait d'une fixation biologique de l’azote atmosphérique[41].
- néo-boisements et reforestation ; On a déjà montré que l'inoculation de micro-organismes symbiotes de la rhizosphère pouvait faciliter l'installation et la croissance d'arbres[1] ou d'autres plantes[42],[43].
L'inoculation en pépinière de certaines bactéries à certaines essences d'arbres pourrait peut-être permettre de diminuer les taux d'échecs de nombreux projets de restauration de sols et de ceintures vertes et boisements en zone aride (sahélienne notamment) ou salinisée, ce qui pourrait être une alternative efficace et moins coûteuse et socialement plus acceptable que la transgenèse déjà testée dans cette perspective.
Perspectives et pistes de recherche
Les conditions favorisantes (ou au contraire inhibantes) des associations optimales de plante avec un microbiote spécifique sont encore très mal comprises, en particulier pour les endosymbioses. Cette question intéresse tant les sciences fondamentales que la recherche appliquée.
Mieux connaitre le devenir et le rôle éventuel des bactéries et champignons ainsi « captés » par la plante, par exemple lors de l'utilisation de mulch ou dans le cadre de phénomènes de résilience écologique observés avec l'utilisation de bois raméal fragmenté ou lors de certaines colonisation ou régénérations forestières (post-tempête ou suivant certaines coupes rases ou incendies de forêt[44]) sont des questions d'intérêt scientifique, mais également intéressantes pour le génie écologique et toutes les techniques de cultures de végétaux aériens ou de l'estran (Les plantes aquatiques marines de la zones de l'estran, Fucaceae par exemple, pourraient également présenter des symbioses d'intérêt).
Des études pluridisciplinaires associant la botanique, la génétique des plantes, la pédologie et la microbiologie des sols, l'écologie, devraient permettre de mieux comprendre les phénomènes de fixation rapide de l'azote atmosphérique[45], et leur importance relative dans le cycle de l'azote et éventuellement les utiliser au profit d'activités humaines plus soutenables à l'égard de l'environnement[15]. La Recherche porte aussi sur l'identification de probiotiques utilisables pour les cultures de végétaux[46],[47].
Ces études[41],[1] ont montré sans ambigüité qu'il peut être avantageux d’inoculer certains végétaux cultivés par des endophytes provenant de la même espèce, et même d'autres espèces, mais on ignore encore si (et dans quelle mesure) la quantité d’azote fixé par les peupliers sauvages dépend aussi de la composition, densité et répartition de son microbiote naturel.
De plus, pour identifier les bactéries testées, on les met habituellement d'abord en culture (sur trois types de médiums différents dans l’étude évoquée ci-dessus), ce qui fait qu’on ne connait (et qu’on n’a testé) que des bactéries « cultivables » (qui ne sont peut-être pas les plus performantes). Enfin, si les tests d’inoculations sur d’autres plantes (dont d’autres espèces) ont clairement montré que ces bactéries étaient responsables d’une meilleure fixation de l’azote, il est possible qu’il en existe d’autres non encore repérées[1].
Il a été récemment prouvé avec des preuves expérimentales que le microbiome des graines est transmis au développement des semences pendant la germination. Le microbiome transmis a également une voie de transmission très spécifique, ce qui signifie que certaines bactéries et champignons se déplacent de la même manière vers les feuilles des plantes et d'autres vers les racines des plantes. Il a également été montré dans cette étude que presque tout le microbiome des graines est en fait transmis à la nouvelle plante, avec très peu de micro-organismes qui restent dans les graines [48],[49].
Le microbiote comprend aussi des bactéries qui peuvent dans certaines conditions devenir pathogènes voire mortelles pour la plante (ou pour l'homme comme les salmonelles[50]). Certaines associations qui semblent délétères pour la plante[51] doivent aussi être mieux comprises.
On cherche aussi à mieux comprendre comment le système immunitaire et le génome d'une plante "choisissent", "invitent" ou "acceptent" ces organismes symbiotes (y compris sur les surfaces foliaires)[52], et comment le microbiote interfère dans les relations entre des plantes d'espèces différentes et entre individus végétaux d'une même espèce [53], de même que le rôle du microbiote dans la décomposition des feuilles mortes et le recyclage des éléments qu'elles contiennent[54].
Le microbiote des plantes est - sans surprise - vulnérable aux fongicides et aussi à de nombreux autres biocides dont certains sont des polluants émergents non-biodégradables, comme le Nano-argent[55].
La recherche porte aussi sur le rôle évolutif du microbiote des plantes via l'étude de la théorie hologénomique de l'évolution (en)[56],[57].
Voir aussi
Articles connexes
- Symbiosphère, Symbiose
- Coiffe (botanique)
- Racines
- Biodiversité du sol
- Sol (pédologie)
- Humus
- Édaphologie
- Hologénome
- Microbiome
Bibliographie
- Bulgarelli, D., Rott, M., Schlaeppi, K., van Themaat, E. V. L., Ahmadinejad, N., Assenza, F., etc. & Peplies, J. (2012). Revealing structure and assembly cues for Arabidopsis root-inhabiting bacterial microbiota. Nature, 488(7409), 91-95.
- Doty S.L et al (2016) Variable Nitrogen Fixation in Wild Populus (fixation variable de l'azote chez les peupliers sauvages), PLOS ONE (2016). DOI: 10.1371 / journal.pone.0155979 (licence cc-by-san 4.0)
- Duke, S. O., Lydon, J., Koskinen, W. C., Moorman, T. B., Chaney, R. L., & Hammerschmidt, R. (2012). Glyphosate effects on plant mineral nutrition, crop rhizosphere microbiota, and plant disease in glyphosate-resistant crops. Journal of agricultural and food chemistry, 60(42), 10375-10397.
- Federle, T. W., McKinley, V. L., & Vestal, J. R. (1982). Effects of nutrient enrichment on the colonization and decomposition of plant detritus by the microbiota of an arctic lake. Canadian Journal of Microbiology, 28(11), 1199-1205 (résumé).
- Li CY, Massicote HB, Moore LVH. 1992. Nitrogen-fixing Bacillus sp. associated with Douglas-fir tuberculate ectomycorrhizae. Plant Soil 140(1): 35-40
- Ringelberg, D. B., Stair, J. O., Almeida, J., Norby, R. J., O'Neill, E. G., & White, D. C. (1997). Consequences of rising atmospheric carbon dioxide levels for the belowground microbiota associated with white oak. Journal of Environmental Quality, 26(2), 495-503.
- Sharon L. Doty et al, Variable Nitrogen Fixation in Wild Populus (fixation variable de l'azote chez les peupliers sauvages), PLOS ONE (2016). DOI: 10.1371 / journal.pone.0155979
- Vandenkoornhuyse, P., Quaiser, A., Duhamel, M., Le Van, A., & Dufresne, A. (2015). The importance of the microbiome of the plant holobiont. New Phytologist, 206(4), 1196-1206.
- Wang, H. X., Geng, Z. L., Zeng, Y., & Shen, Y. M. (2008). Enriching plant microbiota for a metagenomic library construction. Environmental microbiology, 10(10), 2684-2691.
- Wei-xiang, W., Qing-fu, Y., Hang, M., Xue-jun, D., & Wen-ming, J. (2004). Bt-transgenic rice straw affects the culturable microbiota and dehydrogenase and phosphatase activities in a flooded paddy soil. Soil Biology and Biochemistry, 36(2), 289-295.
- (en) Ahmed Abdelfattah, Michael Wisniewski, Leonardo Schena et Ayco J. M. Tack, « Experimental evidence of microbial inheritance in plants and transmission routes from seed to phyllosphere and root », Environmental Microbiology, , p. 1462–2920.15392 (ISSN 1462-2912 et 1462-2920, DOI 10.1111/1462-2920.15392, lire en ligne, consulté le )
Notes et références
- Doty S.L et al., 2016 - Variable Nitrogen Fixation in Wild Populus (fixation variable de l'azote chez les peupliers sauvages), PLOS ONE (2016). DOI: 10.1371 / journal.pone.0155979 (licence cc-by-san 4.0)
- (en) Murali Gopal & Alka Gupta, « Microbiome Selection Could Spur Next-Generation Plant Breeding Strategies », Front. Microbiol., vol. 7, no 1971, (DOI 10.3389/fmicb.2016.01971).
- Rastogi G., Coaker G.L. & Leveau J.H., 2013 - New insights into the structure and function of phyllosphere microbiota through high-throughput molecular approaches. FEMS microbiology letters, 348(1), 1-10
- Morris, C. E., & Kinkel, L. L. (2002). Fifty years of phyllosphere microbiology: significant contributions to research in related fields. Phyllosphere microbiology, 365-375.
- Rosenberg E., Sharon G., Atad I. & Zilber‐Rosenberg I., 2010 - The evolution of animals and plants via symbiosis with microorganisms. Environmental microbiology reports, 2(4), 500-506 (résumé)
- Holl F.B., Chanway C.P., 1992 - Rhizosphere colonization and seedling growth promotion of lodgepole pine by Bacillus polymyxa. Can. J. Microbiol., 38(4): 303-308
- Bal A., Chanway C.P., 2012 - Evidence of nitrogen fixation in lodgepole pine inoculated with diazotrophic Paenibacillus polymyxa. Botany, 90: 891–896. doi: 10.1139/b2012-044
- Hallmann J., Quadt-Hallmann A., Mahaffee W.F., Kloepper J.W., 1997 - Bacterial endophytes in agricultural crops. Can. J. Microbiol., 43 (10): 895-914
- Boddey R.M., Urquiaga S., Reis V., Dobereiner J., 1991 - Biological nitrogen fixation associated with sugar cane. Plant Soil, 137(1): 111-117
- Doty S.L., Oakley B., Xin G., Kang J.W., Singleton G., Khan Z., Vajzovic A., Staley J.T., 2009 - Diazotrophic endophytes of native black cottonwood and willow. Symbiosis 47(1): 23-33
- Marc-André Selosse, « La biodiversité invisible et active des micro-organismes », Le Râle d’eau, no 148, , p. 9.
- (en) Lynne Boddy, A. D. M. Rayner, « Origins of decay in living deciduous trees: the role of moisture content and a re-appraisal of the expanded concept of tree decay », New Phytologist, vol. 94, no 4, , p. 623-641 (DOI 10.1111/j.1469-8137.1983.tb04871.x)
- (en) Lynne Boddy, O.M. Gibbon, M.A. Grundy, « Ecology of Daldinia concentrica: Effect of abiotic variables on mycelial extension and interspecific interactions », Transactions of the British Mycological Society, vol. 85, no 2, , p. 201-211 (DOI 10.1016/S0007-1536(85)80183-2).
- Marc-André Selosse, Jamais seul. Ces microbes qui construisent les plantes, les animaux et les civilisations, Actes Sud Nature, , p. 89.
- Bormann B.T., Bormann F.H., Bowden W.B., Piece R.S;, Hamburg S.P., Wang D., Snyder M.C., Li C.Y., Ingersoll R.C., 1993 - Rapid N2 fixation in pines, alder, and locust: evidence from the sandbox ecosystems study. Ecology, 74 (2): 583-598 (résumé)
- Bal A.S., Anand R., Berge O., Chanway C.P., 2012 - Isolation and identification of diazotrophic bacteria from internal tissues of Pinus contorta and Thuja plicata. Can. J. For. Res., 42(4): 807-813
- Anand R., 2010 - Endophytic colonization and N fixation by Paenibacillus polymyxa in association with lodgepole pine and western red cedar. Dissertation, University of British Columbia
- Moyes A.B., Kueppers L.M., Pett-Ridge J., Carper D.L., Vandehey N., O'Neil J. et al., 2016 - Evidence for foliar endophytic nitrogen fixation in a widely distributed subalpine conifer. New Phytologist. doi: 10.1111/nph.13850 (résumé)
- Bulgarelli D., Schlaeppi K., Spaepen S., Ver Loren van T.E., Schulze-Lefert P., 2013 - Structure and functions of the bacterial microbiota of plants. Annu Rev Plant Biol, 64: 807–838. Doi: 10.1146/annurev-arplant-050312-120106.
- Berendsen R.L., Pieterse C.M. & Bakker P.A., 2012 - The rhizosphere microbiome and plant health. Trends in plant science, 17(8), 478-486
- Khan Z., Doty S.L., 2011- Endophyte-assisted phytoremediation. Current Topics in Plant Biology, 12: 97–105
- Rodriguez R.J., White J.F. Jr, Arnold A.E., Redman R.S., 2009 - Tansley Review: Fungal endophytes: diversity and functional roles. New Phytol, 182: 314–330. doi: 10.1111/j.1469-8137.2009.02773.x
- Vandenkoornhuyse P., Quaiser A., Duhamel M., Le V.A., Dufresne A., 2015 - The importance of the microbiome of the plant holobiont. New Phytol, 206: 1196–1206. doi: 10.1111/nph.13312.
- Isebrands J.G., Aronsson P., Carlson M., Ceulemans R., Coleman M., et al. , 2014 - Environmental Applications of Poplars and Willows. In Isebrands JG, Richardson J, editors. Poplars and Willows. Rome: The Food and Agriculture Organization of the United Nations, 258–336
- Stettler R.F., Bradshaw H.D., Heilman P.E., Hinckley T.M., 1996 - Biology of Populus and its Implications for Management and Conservation. Ottawa: NRC Research Press
- Weyens N., Truyens S, Dupae J., Newman L., Taghavi S., van der Lelie D. et al., 2010 - Potential of the TCE-degrading endophyte Pseudomonas putida W619-TCE to improve plant growth and reduce TCE phytotoxicity and evapotranspiration in poplar cuttings. Environ Pollut 158: 2915–2919. S0269-7491(10)00223-X [pii]; doi: 10.1016/j.envpol.2010.06.004.
- Kang J.W., Khan Z., Doty S.L., 2012 - Biodegradation of trichloroethylene (TCE) by an endophyte of hybrid poplar. Appl Environ Microbiol 78: 3504–3507. doi: 10.1128/AEM.06852-11.
- Khan Z., Roman D., Kintz T., delas Alas M., Yap R., Doty S.L., 2014 - Degradation, phytoprotection, and phytoremediation of phenanthrene by endophyte Pseudomonas putida PD1. Appl Environ Microbiol 48: 12221–12228. doi: 10.1021/es503880t
- Ulrich K., Ulrich A., Ewald D., 2008 - Diversity of endophytic bacterial communities in poplar grown under field conditions. FEMS Microbiol Ecol 63: 169–180. doi: 10.1111/j.1574-6941.2007.00419.x.
- Gottel N.R., Castro H.F., Kerley M., Yang Z., Pelletier D.A., Podar M. et al., 2011 - Distinct microbial communities within the endosphere and rhizosphere of Populus deltoides roots across contrasting soil types. Appl Environ Microbiol 77: 5934–5944. AEM.05255-11 [pii]; doi: 10.1128/AEM.05255-11.
- Stettler R.F., 2009 - Cottonwood and the River of Time: on Trees, Evolution, and Society. Seattle: University of Washington Press
- Three Forks Natural Area ; King County, WA ; Snoqualmie River (coordonnées du site : +47° 31' 14.30", -121° 46' 28.32")
- Doty S.L., Oakely B, Xin G., Kang JW, Singleton G, Khan Z et al. (2009) Diazotrophic endophytes of native black cottonwood and willow. Symbiosis 47: 23–33. doi: 10.1007/bf03179967
- Xin G, Zhang G, Kang JW, Staley JT, Doty SL (2009) A diazotrophic, indole-3-acetic acid-producing endophyte from wild cottonwood. Biology and Fertility of Soils 45: 669–674. doi: 10.1007/s00374-009-0377-8
- Knoth J, Kim S-H, Ettl G, Doty SL (2013) Effects of cross host species inoculation of nitrogen-fixing endophytes on growth and leaf physiology of maize. GCB Bioenergy 5: 408–418. doi: 10.1111/gcbb.12006
- Kandel S, Herschberger N, Kim S-H, Doty SL (2015) Diazotrophic endophytes of poplar and willow promote growth of rice plants in nutrient-limited conditions. Crop Science 55: 1765–1772. doi: 10.2135/cropsci2014.08.0570
- Khan Z, Guelich G, Phan H, Redman RS, Doty SL (2012) Bacterial and yeast endophytes from poplar and willow promote growth in crop plants and grasses. ISRN Agronomy doi: 10.5402/2012/890280.
- Federle, T. W., & Schwab, B. S. (1989). Mineralization of surfactants by microbiota of aquatic plants. Applied and environmental microbiology, 55(8), 2092-2094.
- Chanway C.P., Nelson L.M., Holl F.B., 1988 - Cultivar-specific growth promotion of spring wheat (Triticum aestivum L.) by coexistent Bacillus species. Can. J. Microbiol. 34(7): 925-929 Lien, ISI. Abstract
- Kucey R.M.N., 1988 - Alteration of size of wheat root systems and nitrogen fixation by associative nitrogen-fixing bacteria measured under field conditions. Can. J. Microbiol. 34(6): 735-739 résumé
- Knoth JL, Kim SH, Ettl GJ, Doty SL (2014) Biological nitrogen fixation and biomass accumulation within poplar clones as a result of inoculations with diazotrophic endophyte consortia. New Phytol 201: 599–609. doi: 10.1111/nph.12536.
- Nelson LM. (2004) Plant growth promoting rhizobacteria (PGPR): prospects for new inoculants. Crop Management.
- Rennie RJ, Thomas JB. 1987. 15N-determined effect of inoculation with N2-fixing bacteria on nitrogen assimilation in Western Canadian wheats. Plant Soil 100(1–3): 213-223
- Metzger KL, Smithwick EAH, Tinker DB, Romme WH, Balser TC, Turner MG. (2008) Influence of coarse wood and pine saplings on nitrogen mineralization and microbial communities in young post-fire Pinus contorta. For. Ecol. Manage. 256(1–2): 59-67 (résumé)
- Postgate, J.R. (1998) Nitrogen fixation. Cambridge University Press, Cambridge
- Berlec, A. (2012). Novel techniques and findings in the study of plant microbiota: search for plant probiotics. Plant science, 193, 96-102. (résumé)
- (en) « Seeds transfer their microbes to the next generation », sur EurekAlert! (consulté le )
- (en) « Experimental Evidence of Microbial Inheritance in Plants and Transmission Routes from Seed to Phyllosphere and Root », Research Square (prépublication), (DOI 10.21203/rs.3.rs-27656/v1, lire en ligne, consulté le )
- (en) Ahmed Abdelfattah, Michael Wisniewski, Leonardo Schena et Ayco J. M. Tack, « Experimental evidence of microbial inheritance in plants and transmission routes from seed to phyllosphere and root », Environmental Microbiology, vol. n/a, no n/a, (ISSN 1462-2920, DOI 10.1111/1462-2920.15392, lire en ligne, consulté le )
- Brandl M.T., Cox C.E & Teplitski M., 2013 Salmonella interactions with plants and their associated microbiota, Phytopathology, 103 (4) : 316-325
- Kremer, R.J. 2006. Deleterious rhizobacteria. In Plant-associated bacteria. Edited by S.S. Gnanamanickam. Springer, Dordrecht, The Netherlands. 335–358
- Bodenhausen N., Bortfeld-Miller M., Ackermann M. & Vorholt J.A., 2014 A synthetic community approach reveals plant genotypes affecting the phyllosphere microbiota. PLoS Genet, 10(4), e1004283
- Sanon A., Andrianjaka Z.N., Prin Y., Bally R., Thioulouse J., Comte G., & Duponnois R., 2009 - Rhizosphere microbiota interfers with plant-plant interactions. Plant and Soil, 321(1-2) : 259-278
- Aubert M., Margerie P., Trap J. & Bureau F., 2010 - Aboveground–belowground relationships in temperate forests: plant litter composes and microbiota orchestrates. Forest Ecology and Management, 259 (3) : 563-572
- Hänsch M. & Emmerling C., 2010 - Effects of silver nanoparticles on the microbiota and enzyme activity in soil. Journal of Plant Nutrition and Soil Science, 173(4), 554-558 résumé)
- Zilber-Rosenberg I. & Rosenberg E., 2008 - Role of microorganisms in the evolution of animals and plants: the hologenome theory of evolution. FEMS microbiology reviews, 32(5), 723-735
- (en) Ahmed Abdelfattah, Ayco J. M. Tack, Birgit Wasserman et Jia Liu, « Evidence for host–microbiome co-evolution in apple », New Phytologist, vol. n/a, no n/a, (ISSN 1469-8137, DOI 10.1111/nph.17820, lire en ligne, consulté le ).
- Portail de la microbiologie
- Portail de la botanique