Laurylsulfate de sodium
Le laurylsulfate de sodium (LSS) ou dodécylsulfate de sodium (en anglais, sodium dodecyl sulfate ou SDS), plus connu sous sa dénomination INCI sodium lauryl sulfate ou SLS, est un détergent et tensioactif ionique fort, couramment utilisé en biochimie et biologie moléculaire.
Pour les articles homonymes, voir SLS.
Ne doit pas être confondu avec Laureth sulfate de sodium.
| Laurylsulfate de sodium | ||
| ||
 | ||
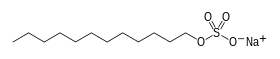
| Structure du laurylsulfate de sodium | ||
| Identification | ||
|---|---|---|
| Synonymes |
dodécylsulfate de sodium |
|
| No CAS | ||
| No ECHA | 100.005.263 | |
| No CE | 205-788-1 | |
| DrugBank | DB00815 | |
| PubChem | 3423265 | |
| ChEBI | 8984 | |
| No E | E487 | |
| SMILES | ||
| InChI | ||
| Apparence | solide de formes variables, blanc, d'odeur caractéristique[1] | |
| Propriétés chimiques | ||
| Formule | C12H25NaO4S [Isomères] |
|
| Masse molaire[2] | 288,379 ± 0,018 g/mol C 49,98 %, H 8,74 %, Na 7,97 %, O 22,19 %, S 11,12 %, |
|
| Propriétés physiques | ||
| T° fusion | 204 à 207 °C[1] | |
| Solubilité | dans l'eau : 100 g·l-1[1] | |
| Masse volumique | 1,01 g·cm-3[réf. souhaitée] | |
| Précautions | ||
| SGH[3] | ||
   |
||
| SIMDUT[4] | ||
 D2B, |
||
| Unités du SI et CNTP, sauf indication contraire. | ||
Il est utilisé dans les produits ménagers tels que les dentifrices, shampooings, mousses à raser ou encore bains moussants pour ses effets épaississants et sa capacité à créer une mousse ; il est également repris comme additif alimentaire par le codex alimentaire (E487).
Le SDS est utilisé aussi bien dans les procédés industriels que pour les produits cosmétiques destinés au grand public. Comme tous les détergents surfactants (incluant les savons), il enlève l’huile de la peau, et peut causer des irritations de la peau et des yeux. Le SDS peut être converti en laureth sulfate de sodium (également nommé Sodium Lauryl Ether Sulfate ou SLES) par éthoxylation ; ce dernier est moins irritant pour la peau, probablement parce qu’il provoque moins de dénaturation des protéines par rapport à la substance non-éthoxylée (SDS).
Chimie
La molécule (C12H25NaO4S) est composée d’une chaîne de douze atomes de carbone, rattachée à un groupement sulfate conférant à la molécule les propriétés amphiphiles requises pour un détergent. Le SDS est préparé par sulfonation du dodécan-1-ol (alcool de lauryl, C12H25OH), suivie par une neutralisation par du carbonate de sodium.
Plus récemment, le SDS a trouvé une application comme surfactant pour les réactions de formation d’hydrates de gaz ou d’hydrates de méthane, augmentant le taux de formation de près de sept cents fois[5].
La concentration micellaire critique du SDS varie de 0,007 à 0,01 mol/L dans l'eau à 25 °C[6].
Biochimie
En laboratoire , le SDS est communément utilisé afin de préparer des protéines pour réaliser une électrophorèse sur gel de polyacrylamide (SDS-PAGE). Le SDS supprime les liaisons non-covalentes de la protéine, permettant la dénaturation de la protéine, la molécule perd donc à terme sa conformation initiale. De plus, les anions du SDS se lient aux peptides à raison d’un anion du SDS tous les deux acides aminés. Cela confère à la protéine une charge globale négative qui est proportionnelle à la masse de la protéine (environ 1,4 g de SDS pour 1 g de protéine)[7]. Les nombreuses charges négatives apportées par les groupements sulfate du SDS dominent la charge totale du complexe formé avec la protéine. La répulsion électrostatique qui est créée par la liaison du SDS cause aussi le dépliement de la structure 3D de la protéine qui adopte alors une conformation étendue, ainsi les différences dues à la conformation de la protéine, apparaissant habituellement au cours de la séparation du gel, sont écartées.
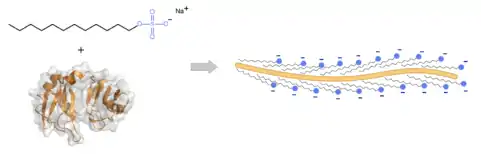
Problèmes liés au SDS
Un certain nombre de conditions de sécurité lors de l’utilisation de SDS ont été consignées dans les publications[8],[9],[10]. Elles incluent les recommandations suivantes :
- le SDS peut causer des affections de la peau (dont le nom général est la dermatite), certaines personnes étant plus affectées que d’autres[10],[11],[12] ;
- les recherches toxicologiques effectuées par l'OSHA (Occupational Safety and Health Administration), le NTP (United States Department of Health and Human Services) ainsi que le CIRC (Centre international de recherche sur le cancer) appuient les conclusions de la Cosmetic, Toiletry and Fragrance Association (CTFA) ainsi que l'American Cancer Society qui déclarent que SLES n'est pas cancérogène[13] ;
- bien que le SLES soit légèrement moins irritant que le SDS, il peut se révéler dangereux par le fait qu’il n’est pas métabolisable par le foie[réf. nécessaire] ;
- le SDS est connu pour causer des ulcères aphteux ; il est référencé dans certains pays comme « rongeur de plaie »[14],[15] ;
- le SDS peut être utilisé en remplacement des SLES (pourtant moins irritants) pour la fabrication de savons, shampooings, lessives, dentifrices et autres produits de bains en raison de son faible coût.
Le laurylsulfate de sodium est employé comme ingrédient non-médicinal dans l'assemblage du médicament Cymbalta(MC) utilisé pour soulager la dépression et la douleur associée au diabète (neuropathie périphérique).
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Sodium dodecyl sulfate » (voir la liste des auteurs).
- LAURYLSULFATE DE SODIUM, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Sodium dodecyl sulphate », sur European Chemicals Agency (ECHA),
- « Sulfate de dodécyle et de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Kazuyoshi Watanabe, Shuntaro Imai et Yasuhiko H. Mori., Surfactant effects on hydrate formation in an unstirred gas/liquid system: An experimental study using HFC-32 and sodium dodecyl sulfate, Department of Mechanical Engineering, Keio University, 3-14-1 Hiyoshi, Kohoku-ku, Yokohama 223-8522, Japan. Chemical Engineering Science, vol. 60, no 17, septembre 2005, p. 4846-4857, résumé
- A. Helenius, D. R. McCaslin, E. Fries et C. Tanford, « Properties of detergents », Methods in Enzymology, vol. 56, , p. 734–749 (ISSN 0076-6879, lire en ligne, consulté le )
- J. A. Reynolds et C. Tanford, « Binding of dodecyl sulfate to proteins at high binding ratios. Possible implications for the state of proteins in biological membranes », Proceedings of the National Academy of Sciences of the United States of America, vol. 66, , p. 1002–1007 (ISSN 0027-8424, lire en ligne, consulté le )
- Agner T., Susceptibility of atopic dermatitis patients to irritant dermatitis caused by sodium lauryl sulphate, Acta Derm. Venereol., 1991, 71(4):296-300,
- A. Nassif, S. C. Chan, F. J. Storrs et J. M. Hanifin, Abstract: Abnormal skin irritancy in atopic dermatitis and in atopy without dermatitis, Arch. Dermatol., novembre 1994, 130(11):1402, résumé
- Marrakchi S, Maibach HI., Sodium lauryl sulfate-induced irritation in the human face: regional and age-related differences, Skin Pharmacol. Physiol. 2006, 19(3):177-80, EPub 4 mai 2006,
- CIR publication, Final Report on the Safety Assessment of Sodium Lauryl Sulfate and Ammonium Lauryl Sulfate, Journal of the American College of Toxicology, 1983, vol. 2, no 7, p. 127-181.
- Loffler H, Effendy I., Skin susceptibility of atopic individuals, Department of Dermatology, University of Marburg, Allemagne, Contact Dermatitis., mai 1999, 40(5):239-42,
- Rumor: Sodium Lauryl Sulfate Causes Cancer, The Cosmetic, Toiletry, and Fragrance Association, 13 octobre 2000, « lire en ligne »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- Chahine L, Sempson N, Wagoner C., The effect of sodium lauryl sulfate on recurrent aphthous ulcers: a clinical study, Compend. Contin. Educ. Dent., décembre 1997, 18(12):1238-40,
- Herlofson BB, Barkvoll P., The effect of two toothpaste detergents on the frequency of recurrent aphthous ulcers, Acta Odontol. Scand., juin 1996, 54(3):150-3,
- Portail de la chimie
- Portail de la biochimie