Théorie des stratégies CSR
La tolérance au stress est une stratégie écologique des plantes décrite par Grime dans le cadre de sa théorie des stratégies CSR élaborée en 1974[1]. La théorie des stratégies CSR (Compétitives, Stress-tolérantes et Rudérales) est un modèle de stratégie des plantes énoncé par John Philip Grime en 1974[2].
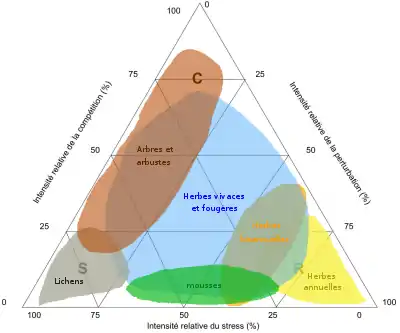
Selon lui il existe trois stratégies végétales principales sélectionnées en réponse à différents facteurs environnementaux (biotiques ou abiotiques) : la compétition (C), le stress (S), et la perturbation (D pour disturbance en anglais). Ces stratégies sont la stratégie compétitive (C), tolérante au stress (S) et rudérale (R).
Ce modèle repose sur le principe de l'allocation des ressources (correspondant à l'allocation de nutriments en nutrition microbienne, fongique, végétale et animale) destinées au développement (caractérisé par le taux de croissance, les patrons d'allocation de la biomasse produite aux différentes parties de l'organisme, la durée de développement et survie…), à la maintenance des fonctions somatiques (nutrition, respiration, régulation, défense, relation…) et reproductives (allocation des ressources à la reproduction (en) caractérisée par la fécondation et la fertilité), et qui reflète l'existence de compromis évolutifs entre différents traits biologiques.
Cette théorie s'accorde avec la représentation ordonnée des espèces sous forme d'un triangle équilatéral communément dénommé « triangle de Grime » ou « triangle C-S-R », où chaque plante aurait sa place déterminant sa stratégie.
L'une de ses motivations était de compléter le modèle r/K, dans lequel la majorité des espèces trouvait sa place entre les deux extrêmes r et K[3].
Les trois facteurs principaux : C, S, et D
La compétition est définie par Grime comme « la tendance des plantes voisines à utiliser le même quantum de lumière, le même nutriment minéral ionique, la même molécule d'eau, ou le même volume de l'espace ».
Il définit le stress comme « les contraintes externes qui limitent le taux de production de matière sèche d'une partie de la végétation ou de la végétation tout entière » (exemple : manque de ressources).
La perturbation est définie comme « les mécanismes qui limitent la biomasse végétale en causant sa destruction » (exemple : inondation, herbivorie)[3].
John Philip Grime propose que les facteurs limitant la biomasse des plantes dans tout habitat peuvent être classés selon deux catégories : stress et perturbation. La part de compétition dans un environnement diminue avec l'augmentation du stress et/ou de la perturbation. Une telle approche suggère que la compétition apparaît comme une situation par défaut, là où le stress et la perturbation sont abaissés. Cette interaction entre les individus n'existerait cependant pas là où le stress ou la perturbation sont à leur maximum. Au même titre qu'ils excluent la compétition, le stress et la perturbation s'excluent mutuellement dans le modèle de Grime[4]. Il est facilement concevable qu'une plante ne pourra être sélectionnée pour pousser dans un milieu où stress et perturbation sont à leur maximum, puisque le stress la contraint à une croissance lente et que la perturbation aboutit à sa destruction. Sa fitness sera donc négligeable. Selon Grime, c'est donc la proportion relative de ces composantes qui permet de caractériser un habitat.
Les trois stratégies fondamentales C, S, et R
La compétitivité (stratégie C) des plantes consiste ici en une capacité à capter les ressources. Cette aptitude compétitive se mesure en absence de stress et de perturbation. En présence de ces facteurs externes, son importance diminue et ne permet plus à elle seule de déterminer l'issue d'une « lutte pour l'existence ». Grime la présente comme une stratégie alternative qui émerge en absence de facteurs externes contraignants. En maximisant la capture des ressources, cette stratégie permet l'occupation exclusive des terres fertiles non perturbées et une croissance végétative rapide[5].
Les individus tolérants au stress sont caractérisés par la spécialisation de certains traits dans l'exploitation de milieux non-productifs (stratégie S). Vivant dans un milieu peu fertile et perturbé, ils ont une croissance lente[5] et développent plusieurs mécanisme de tolérance à ces stress : l'échappement ou esquive, stratégie qui consiste, pendant la période de stress, en un arrêt de l'activité de la plante qui effectue son cycle de croissance pendant les périodes favorables (phénologie accélérée, vie suspendue, vie ralentie telles que la quiescence ou la dormance hivernale ou estivale, production de graines notamment chez les espèces annuelles) ; l'évitement, mode d'adaptation qui consiste à maintenir un bon état de la plante (maintien de l'homéostasie) en situation de stress ; la tolérance stricto sensu, capacité de la plante à maintenir ses grandes fonctions physiologiques mais à un rythme plus réduit (perte d'homéostasie induisant une réduction de croissance)[6].
Des perturbations sévères sélectionnent des espèces présentant des traits adaptés à l'exploitation temporaire des conditions favorables (stratégie R). Vivant dans des milieux très fertiles et très perturbés, ils ont une croissance rapide avant d'investir dans la production de graines[5].
D'après ces éléments on détermine des caractéristiques propres à chaque stratégie associées aux habitats[2],[3],[7], qui sont résumées dans le tableau ci-dessous.
| Stratégie Compétitive (C) | Stratégie Tolérante au stress (S) | Stratégie Rudérale (R) | |
|---|---|---|---|
| Caractéristiques de la plante | Feuillage élevé et dense, ramification latérale importante des systèmes aérien et racinaire, croissance forte et reproduction faible | Souvent de petite taille, sempervirente, croissance lente et reproduction faible | Petite taille, ramification limitée, cycle de vie court, croissance rapide et forte reproduction |
| Exemples d'habitats | Bords de route délaissés, rives de cours d'eau... | Désert, haute altitude, sous-bois... | Jachère arable, déblais récents, chemin piétiné... |
| Types de plantes | Herbes pérennes, arbres, et arbustes | Lichen, herbes pérennes, arbres, et arbustes | Plantes annuelles ou bisannuelles |
| Exemples d'espèces | Épilobe à grandes fleurs (Epilobium hirsutum), Fougère aigle (Pteridium aquilinum) | Scabieuse colombaire (Scabiosa columbaria), Violette de Rivinus (Viola riviniana) | Mouron des oiseaux (Stellaria media), Pâturin annuel (Poa annua) |
Il existe aussi des stratégies secondaires, intermédiaires des stratégies fondamentales (CS, SR, CR, CSR) (voir fig.1)[7].
Triangle de Grime
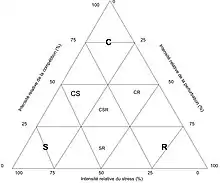
Ce triangle équilatéral permet une représentation schématique et simplifiée en deux dimensions de la théorie de Grime (voir fig.1). Chaque facteur atteint son maximum d'intensité à l'un des sommets, cette intensité diminuant graduellement jusqu'à zéro en s'éloignant du sommet. On peut donc attribuer à chaque point du triangle des habitats spécifiques et y replacer les stratégies associées. Connaissant la stratégie d'une plante, on pourra déterminer son habitat, et inversement[8].
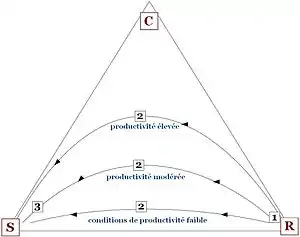
Ce triangle permet également de rendre compte des successions végétales[2],[3] au même titre que le modèle r/K de Robert MacArthur et Wilson. Les étapes de succession sont orientées globalement depuis le sommet R vers le sommet S, en passant par le milieu du triangle où l'importance du facteur C est maximisée. On peut donc distinguer trois phases, par exemple en conditions de forte productivité :
- phase initiale au sommet R (C et S ont peu d'impact), où l'on trouve les espèces à cycle de vie court.
- phase intermédiaire où les trois facteurs sont influents, où l'on retrouve les herbes pérennes et fougères puis des arbres et arbustes sensibles au stress (essentiellement l'ombrage).
- phase finale au sommet S (où C et R ont peu d'impact), où l'on retrouve les grands arbres et arbustes (forêt) et lichens.
Pour des milieux moins productifs, l'influence de la compétition est abaissée et donc les types de végétation au cours de la succession sont différents (voir fig.2).
Critiques de ce modèle
La discussion autour de cette théorie est toujours d'actualité, elle a d'ailleurs fait l'objet de nombreuses critiques[9] dont quelques-unes sont évoquées ici.
- La plus vive critique à l'égard de cette théorie a été formulée par G. David Tilman et porte sur les notions de compétition et de stress. D'après lui le concept universel de stress est erroné car différents types de stress vont favoriser différents types d'espèces. Il considère aussi qu'avec une augmentation du stress la compétition devient plus forte du fait que la ressource est plus limitée, et non l'inverse comme le propose Grime. À travers les idées de Grime et celles de Tilman ce sont deux courants de l'écologie théorique qui s'opposent sur la question de la compétition, des processus et des effets qui y sont rattachés.
- L'une des principales critiques de la forme triangulaire suggère qu'il y a une perte d'information à la suite de la réduction du triangle à deux dimensions, alors que les données portent sur trois dimensions (les facteurs étant au nombre de trois)[10].
- De plus, il n'existe pas de consensus scientifique sur la notion de stress et de compétition. Le modèle de Grime implique que les trois paramètres C, S et D s'excluent mutuellement, mais cette notion peut être remise en cause. Par exemple, la compétition ne sera-t-elle pas plus importante dans des conditions de stress du fait de la limitation des ressources[9]?
- On pourrait aussi envisager l'existence d'espèces qui expriment un phénotype tolérant au stress quand le facteur S est le plus important, et un phénotype compétitif quand le facteur C est dominant. Un tel organisme serait donc représenté par deux points dans le triangle, ce qui n'est pas envisagé par Grime[11].
- Au même titre que le modèle r/K s'applique aussi aux animaux et champignons, les espèces appartenant à ces deux groupes pourraient aussi être replacées au sein du triangle C-S-R. On peut retrouver des caractéristiques analogues à celles des stratégies C, S, ou R des plantes. Par exemple l'augmentation rapide et élevée du taux de croissance d'une population de pucerons lorsque les ressources sont temporairement abondantes peut être interprétée comme une stratégie rudérale[3].
- « Ces stratégies reposent sur l'intégration d'un grand nombre de traits de vie, répondant parfois différemment aux gradients, ce qui complexifie leur interprétation et limite leur usage. Dès la fin des années 1990, l'accumulation de nombreuses mesures de traits de vie au sein de bases de données (Poschlod et al. 2003[12] ; Kleyer et al. 2008[13] ; Kattge et al. 2011[14]) a néanmoins permis l'émergence de nouvelles stratégies plus synthétiques basées sur un nombre restreint de traits comme les stratégies LHS ("Leaf, Height, Seed") (Westoby 1998[15] ; Westoby et al. 2002)[16]. Le modèle LHS oppose des espèces investissant (i) dans la surface foliaire afin d'optimiser l'usage des ressources, notamment leur capacité photosynthétique, (ii) dans la hauteur végétative afin d'améliorer leur capacité compétitive, notamment pour accéder à la lumière, et (iii) dans la masse des graines afin d'améliorer leur dissémination et/ou germination[17] »
Ainsi, si le modèle de Grime « reste aujourd’hui la tentative la plus aboutie de connexion entre le phénotype et l’environnement », il est « pertinent pour une description des différences phénotypiques entre espèces provenant d’habitats différents mais il ne permet pas une description détaillée de la diversité phénotypique observée au sein d’un environnement[18] ».
Références
- (en) JP Grime, « Vegetation classification by reference to strategies », Nature, vol. 250, no 5461, , p. 26-31 (DOI 10.1038 / 250026a0).
- Vegetation classification by reference to strategies, JP Grime, Nature, 1974, 250, pp. 26-31.
- (en) John Philip Grime, « Evidence for the existence of three primary strategies in plants and its relevance to ecological and evolutionary theory » [« Preuve de l'existence de trois stratégies de vie chez les plantes et ses intérêts dans la théorie de l'évolution et en écologie »], The American Naturalist, no 111(982), , p. 1169-1194 (lire en ligne)
- An experimental test of plant strategy theroy, B D. Campbell & JP Grime, Ecology, 1992, 73(1), pp. 15-29.
- (en) Craine JM & Reich PB, Leaf-level light compensation points in shade-tolerant woody seedlings, New Phytol. 2005 Jun;166(3):710-3.
- (en) Jacob Levitt, Responses of Plants to Environmental Stresses. J. Levitt, Academic Press, , 698 p.
- Growth of 27 herbs and grasses in relation to ozone exposure and plant strategy, H Pleijiel et H Danielsson, New Phytologist, 1996, 135(2) pp. 361-367.
- Allocating CSR plant functionnal types : a soft approach to a hard problem, JG Hodgson et al., OIKOS, 1999, 85, p. 282-294.
- C-S-R triangle theory : community-level predictions, tests, evaluation of criticisms, and relation to other theories, J Bastow Wilson & W G. Lee, OIKOS, 2000, 91, pp. 77-96.
- Problems with the triangular model for representing plant strategies, C Loehle, Ecology, 1988, 69(1), p. 284-286.
- A demographic interpretation of Grime's triangle, Silvertown et al., Functionnal Ecology, 1992, 6, p. 130-136.
- (en) Poschlod, P., Kleyer, M., Jackel, A.-K., Dannemann, A. & Tackenberg, O. (2003) BIOPOP— a database of plant traits and internet application for nature conservation. Folia Geobotanica, 38, 263–271.
- (en) M. Kleyer et al. (2008) The LEDA Traitbase: a database of life-history traits of the Northwest European flora. Journal of Ecology, 96, 1266–1274.
- (en) J. Kattge et al. (2011) TRY - a global database of plant traits. Global Change Biology, 17, 2905–2935.
- (en) Westoby, M. (1998) A leaf-height-seed (LHS) plant ecology strategy scheme. Plant and Soil, 99, 213–227.
- (en) Westoby, M., Falster, D.S., Moles, A.T., Vesk, P.A. & Wright, I.J. (2002) Plant ecological strategies: some leading dimensions of variation between species. Annual Review of Ecology and Systematics, 33, 125–159
- Maxime Burst. Les communautés végétales des interfaces forêt-prairie et leur environnement face aux cas d’afforestation et de déforestation. Ecosystèmes. Université de Lorraine, 2017, p. 22
- Jules Segrestin, « Intégration de la phénologie et de la défense mécanique dans l’espace phénotypique des plantes », thèse en Biologie végétale, Université Montpellier, 2018, p.11-12