Synthèse de quinoléine de Friedlaender
La synthèse de quinoléine de Friedlaender, condensation de Friedlaender ou simplement synthèse de Friedlaender (également orthographié « Friedländer ») est une réaction de chimie organique principalement utilisée pour produire de la quinoléine. Elle porte le nom du chimiste allemand Paul Friedlaender (1857-1923) qui l'a découverte[1].
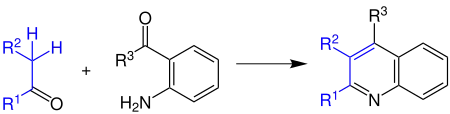
Cette réaction fait réagir un 2-aminobenzaldéhyde (ou un dérivé cétone) avec des aldéhydes ou cétones pour former des quinoléines[2],[3] :
Les groupes Reste R1 à R3 peuvent être des atomes d'hydrogène ou des groupes organyle. La synthèse peut est catalysée par des acides ou des bases, mais elle fonctionne mieux avec les acides[4].
Parmi les catalyseurs utilisés, on peut citer l'acide trifluoroacétique[5], l'acide paratoluènesulfonique[6], le diiode[7] et les acides de Lewis[8].
La réaction doit toujours être réalisée dans des solvants, sinon elle doit être réalisée dans des conditions drastiques, comme des températures allant jusqu'à 200 °C.
Mécanisme réactionnel
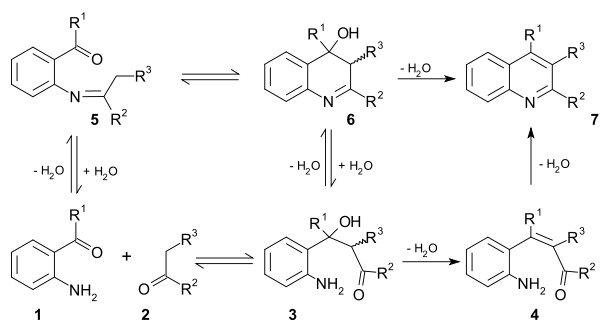
Il existe deux mécanismes réactionnels viables pour cette réaction. Dans le premier, le dérivé substitué du 2-aminobenzaldéhyde (1) et le composé carbonylé (2) se condensent (aldolisation) dans une étape cinétiquement limitante pour former l'adduit aldol (3). Celui-ci perd ensuite une molécule d'eau (crotonisation) pour former une énone α,β-insaturée (4), qui perd à nouveau une molécule d'eau par une réaction de formation d'imine produisant la quinoléine (7).
Dans le second mécanisme, la première étape est la formation d'une base de Schiff (5), suivie par une cyclisation formant le composé hydroxylé (6), et enfin une élimination (déshydratation) pour former la quinoléine (7)[9].
Utilisation
La synthèse de la quinoléine de Friedlaender est utilisée pour produire des quinoléines, des naphtyridines et d'autres dérivés hétérocycliques polycycliques, généralement avec des rendements élevés[4].
Variantes
La réaction de Pfitzinger et la synthèse de quinoléine de Niementowski sont des variantes de la synthèse de Friedlaender. Dans la première, on part de l'isatine qu'on condense avec un composé carbonylé pour obtenir une quinoléine substituée, dans la seconde, on part de l'acide anthranilique.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Friedländer synthesis » (voir la liste des auteurs).
- Winfried R. Pötsch u. a.: Lexikon bedeutender Chemiker. Bibliographisches Institut, Leipzig 1998, (ISBN 3-323-00185-0), p. 157–158.
- Friedländer, P., « Ueber o-Amidobenzaldehyd », Chemische Berichte, vol. 15, no 2, , p. 2572–2575 (DOI 10.1002/cber.188201502219, lire en ligne)
- Friedländer, P. et Gohring, C. F., « Ueber eine Darstellungsmethode im Pyridinkern substituirter Chinolinderivate », Ber., vol. 16, no 2, , p. 1833–1839 (DOI 10.1002/cber.18830160265, lire en ligne)
- Zerong Wang, Comprehensive Organic Name Reactions and Reagents, New Jersey, John Wiley & Sons, , 1137–1141 p. (ISBN 978-0-471-70450-8)
- Shaabani, A., Soleimani, E. et Badri, Z., « Triflouroacetic Acid as an Efficient Catalyst for the Synthesis of Quinoline », Synthetic Communications, vol. 37, no 4, , p. 629–635 (DOI 10.1080/00397910601055230)
- Jia, C.-S., Zhang, Z., Tu, S.-J. et Wang, G.-W., « Rapid and efficient synthesis of poly-substituted quinolines assisted by p-toluene sulphonic acid under solvent-free conditions: Comparative study of microwave irradiation versus conventional heating », Org. Biomol. Chem., vol. 4, , p. 104–110 (DOI 10.1039/b513721g)
- Wu, J., Xia, H.-G. et Gao, K., « Molecular iodine: A highly efficient catalyst in the synthesis of quinolines via Friedländer annulation », Org. Biomol. Chem., vol. 4, , p. 126–129 (DOI 10.1039/b514635f)
- Varala, R., Enugala, R. et Adapa, S. R., « Efficient and Rapid Friedlander Synthesis of Functionalized Quinolines Catalyzed by Neodymium(III) Nitrate Hexahydrate », Synthesis, vol. 2006, no 22, , p. 3825–3830 (DOI 10.1055/s-2006-950296)
- Jose Marco-Contelles, Elena Perez-Mayoral, Abdelouahid Samadi, Marıa do Carmo Carreiras et Elena Soriano, « Recent Advances in the Friedlander Reaction », Chemical Reviews, vol. 109, no 6, , p. 2652–71 (PMID 19361199, DOI 10.1021/cr800482c)
Voir aussi
- Synthèse de quinoléine de Camps
- Synthèse de quinoléine de Conrad-Limpach
- Réaction de Pfitzinger
- Réaction de Skraup
- Réaction de Gould-Jacobs
- Réaction de Doebner
- Réaction de Doebner-Miller
- Réaction de Povarov
- Portail de la chimie