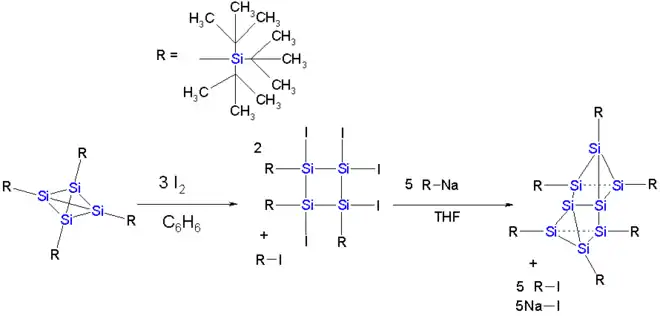
Tétraédrane
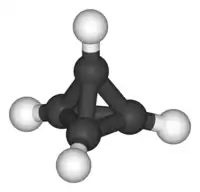
En 1978, Günther Maier a préparé le premier tétraédrane substitué stable, le tétra-tert-butyl tétraédrane[1]. Ces substituants ter-butyl sont très encombrants et enveloppent complètement le cœur tétraédrique. Les liaisons dans ce cœur ne peuvent se briser en raison des forces de Van der Waals qui maintiennent les substituants très proches entre eux (effet corset).
Tétra(triméthylsilyl) tétraédrane
Dans le tétra(triméthylsilyl)tétraédrane (I)[2], les groupes ter-butyl ont été remplacés par des groupes triméthylsilyle. Ce composé est remarquablement plus stable que l'analogue tert-butyl. Pourtant, la liaison silicium-carbone (187 picomètre, 1,87 Angstrom)[3] est sensiblement plus longue qu'une liaison carbone-carbone (154 pm, 1,54 Å)[4] et donc l'effet corset est réduit. D'un autre côté, le groupe triméthylsilyle est un sigma donneur ce qui explique la plus grande stabilité de ce tétraédrane. Alors que le dérivé tert-butyl fond à 135 °C, température à laquelle sa décomposition en cyclobutadiène commence, le triméthyl silyl tétraédrane fond à la température bien plus haute de 202 °C et est stable jusqu'à 300 °C, température à laquelle il se convertit dans le dérivé acétylènique qui a servi au début de sa synthèse.
Les liaisons du squelette du tétraédrane sont coudées (liaisons bananes), l'hybridation des orbitales des carbones a un caractère sigma marqué. Du spectre RMN peut être déduite une hybridation sp des orbitales du carbone ce qui correspond normalement à des triples liaisons. En conséquence, la longueur de 152pm (1,52 Å) des simples liaisons carbone-carbone est inhabituellement courte.
Le dernier développement est la synthèse et la caractérisation du dimère tétraédranyl-tétraédrane (II). La liaison de connexion entre les deux tétraédranes est encore plus courte, 143,6 pm (1,436 Å)! -une liaison simple carbone-carbone ordinaire mesure 154 pm (1,54 Å)-.
Tétrasila-tétraédrane
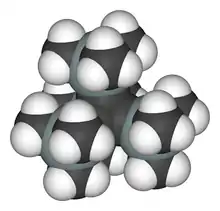
Dans le tétrasila-tétraédrane, les atomes de carbone sont remplacés par du silicium. La longueur standard des liaisons Si-Si est plus grande (235 pm). Seuls les dérivés substitués par des silyl très larges ont le cœur tétraédrique suffisamment enveloppé, pour être thermiquement stables.
Le tétra-(R-silyl)-tétrasila-tétraédrane, figuré ci-dessous, peut être réduit par le potassium-graphite pour former le sel tri-(R-silyl)-tétrasila-tétraédranure de potassium. Dans ce composé, un des atomes de silicium du cœur a perdu son substituant R-silyl et porte une charge négative. Le cation potassium peut être capturé par un éther couronne et alors le complexe de potassium et l'anion silyl se retrouvent séparés par une distance de 885 pm. Une des deux liaisons Si− - Si mesure 272 pm et le Si− garde un symétrie tétraédrique car le doublet électronique qu'il porte, pointe vers l'extérieur du tétrasila-tétraédrane. Cependant les quatre atomes de silicium du cœur sont équivalents à l'échelle de temps de la spectroscopie RMN (Résonance Magnétique Nucléaire), ce qui est dû à la migration ultra-rapide des substituants R-silyl autour du cœur[5].
La réaction de dimérisation observée pour le tétratriméthylsilyl tétraédrane était aussi attendue pour un tétrasila-tétraédrane[6].
Dans le tétrasila-tétraédrane figuré ci-dessous, le cœur est encagé par 4 groupes super silyle dans lesquels chaque atome de silicium a trois substituants ter-butyl. Mais le dimère ne peut être synthétisé. En revanche, une réaction avec de l'iode dans le benzène suivie par une réaction de l'anion tri-ter-butyl sila-, forme un cluster à huit atomes de silicium qui peut être décrit comme un axe Si2 (long de 229 pm et avec, pour les Si, une géométrie telle que les 4 liaisons soient orientées d'un même côté de l'espace) pris en sandwich entre deux cycles Si3 quasiment parallèles.
Il est connu que dans les clusters à huit atomes des éléments du même groupe chimique que le silicium, Sn8R6 pour l'étain et Ge8R6 pour le germanium, ces huit atomes sont localisés aux sommets d'un cube.
Perspectives
Le tétraédrane non substitué nous échappe pour l'instant mais il est prédit être cinétiquement stable. Une stratégie qui a été explorée mais est vaine pour l'instant est la réaction du propène avec du carbone atomique[7]. Encapsuler un tétraédrane dans un fullerène a seulement été essayé in silico[8].
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Tetrahedrane » (voir la liste des auteurs).
- (en) Tetra-tert-butyltetrahedrane, G. Maier, S. Pfriem, U. Schäfer and R. Matusch; 1978; Angewandte Chemie International Edition in English, 17 (7), pp 520–521. DOI:10.1002/anie.197805201
- Hexakis(trimethylsilyl)tetrahedranyltetrahedrane, M. Tanaka and A. Sekiguchi; 2005; Angewandte Chemie International, 44 (36), pp 5821–5823. DOI:10.1002/anie.200501605
- Yahoo | Mail, Weather, Search, Politics, News, Finance, Sports & Videos
- en:Bond length
- Tetrasilatetrahedranide: A Silicon Cage Anion, Masaaki Ichinohe, Masafumi Toyoshima, Rei Kinjo, and Akira Sekiguchi; 2003; J. Am. Chem. Soc., 125 (44), pp 13328–13329. DOI:10.1021/ja0305050
- , Si8(Si-tert-Bu3)6: A Hitherto Unknown Cluster Structure in Silicon Chemistry, G. Fischer, V. Huch, P. Mayer, S. K. Vasisht, M. Veith and N. Wiberg; 2005; Angewandte Chemie International Edition, 44 (48), pp 7884–7887. DOI:10.1002/anie.200501289
- Tetrahedrane—Dossier of an Unknown,Adelina Nemirowski, Hans Peter Reisenauer, and Peter R. Schreiner; Chem. Eur. J.; 2006, 12, pp 7411 – 7420. DOI:10.1002/chem.200600451
- Endohedral complex of fullerene C60 with tetrahedrane, C4H4@C60, Xiao-Yuan Ren a, Cai-Ying Jiang a, Jiang Wanga, Zi-Yang Liu; Journal of Molecular Graphics and Modelling; 2008, 27, pp 558–562. DOI:10.1016/j.jmgm.2008.09.010
- Portail de la chimie