Terpyridine
La terpyridine, ou 2,2’;6’,2’’-terpyridine, souvent abrégée Terpy ou Tpy, est un composé hétérocyclique dérivé de la pyridine. Il s'agit d'un solide blanc, soluble dans la plupart des solvants organiques. Elle est utilisée essentiellement comme ligand tridentate en chimie de coordination. Elle se lie aux métaux M en formant deux cycles de chélation MN2C2 adjacents[3]. Comme les autres polypyridines telles que la 2,2’-bipyridine et la 1,10-phénanthroline, elle forme des complexes avec la plupart des métaux de transition. Il est courant de rencontrer des complexes ayant deux terpyridines, par exemple [M(Terpy)2]n+, qui diffèrent cependant des complexes [M(Bipy)3]n+ qui leur sont apparentés en ce qu'ils sont achiraux.
| Terpyridine | |||
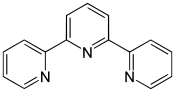
| |||
| Structure de la terpyridine | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 2,6-dipyridin-2-ylpyridine | ||
| No CAS | |||
| No ECHA | 100.013.235 | ||
| No CE | 214-559-5 | ||
| PubChem | 70848 | ||
| ChEBI | 245199 | ||
| SMILES | |||
| InChI | |||
| Apparence | solide jaune inodore[1] | ||
| Propriétés chimiques | |||
| Formule | C15H11N3 |
||
| Masse molaire[2] | 233,267 9 ± 0,013 4 g/mol C 77,23 %, H 4,75 %, N 18,01 %, |
||
| Propriétés physiques | |||
| T° fusion | 89 à 91 °C[1] | ||
| T° ébullition | 370 °C[1] | ||
| Précautions | |||
| SGH[1] | |||
 Danger |
|||
| NFPA 704[1] | |||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Synthèse
La terpyridine a été synthétisée pour la première fois en 1932 par couplage oxydant (en) de pyridines, ce qui ne donnait que de faibles rendements. D'autres synthèses plus efficaces ont depuis été décrites, essentiellement à partir de 2-acétylpyridine (en)[4]. L'une de ces méthodes produit une énaminone par réaction de 2-acétylpyridine avec le diméthylacétal de N,N-diméthylformamide[5]. La réaction à catalyse basique de la 2-acétylpyridine avec le disulfure de carbone CS2 suivie de l'alkylation par l'iodométhane CH3I donne C5H4NCOCH=C(SCH3)2, qui se condense avec la 2-acétylpyridine pour former la 1,5-dicétone correspondante, qui se condense à son tour avec l'acétate d'ammonium CH3COONH4 pour former une terpyridine. Le traitement de ce dérivé par le nickel de Raney permet d'éliminer le groupe thioéther[6].
D'autres méthodes ont été développées pour la synthèse de la terpyridine et de ses dérivés substitués[7]. Les terpyridines substituées sont également synthétisées à partir de réactions de couplage croisé (en) catalysées par du palladium. On peut les obtenir à partir de bis-triazinylbipyridines (en).
Propriétés
Les complexes de terpyridine, comme les autres complexes de polypyridine, présentent des propriétés optiques et électrochimiques caractéristiques : transfert de charge (en) métal-ligand (MLCT) dans le domaine visible, réduction et oxydation réversibles et luminescence assez intense.
Comme ce sont des π-accepteurs, la terpyridine et la bipyridine ont tendance à stabiliser les métaux dans des états d'oxydation plus faibles. Par exemple, dans une solution d'acétonitrile, il est possible de produire le [M(Terpy)2]+ (M = Ni, Co).
Notes et références
- « Fiche du composé 2,2':6',2-Terpyridine, 97% », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Anna L. Gavrilova et Brice Bosnich, « Principles of Mononucleating and Binucleating Ligand Design », Chemical Reviews, vol. 104, no 2, , p. 349-384 (PMID 14871128, DOI 10.1021/cr020604g, lire en ligne)
- (en) Harald Hofmeier et Ulrich S. Schubert, « Recent developments in the supramolecular chemistry of terpyridine–metal complexes », Chemical Society Reviews, vol. 33, no 6, , p. 373-399 (PMID 15280970, DOI 10.1039/B400653B, lire en ligne)
- (en) Donald L. Jameson, Lisa E. Guise, Carol A. Bessel et Kenneth Takeuchi, « 2,2′:6′,2″-Terpyridine », Inorganic Syntheses, vol. 32, (DOI 10.1002/9780470132630.ch7, lire en ligne)
- (en) Kevin T. Potts, Philip Ralli, George Theodoridis et Paul Winslow, « 2,2' : 6',2' -Terpyridine », Organic Syntheses, vol. 64, , p. 189 (DOI 10.15227/orgsyn.064.0189, lire en ligne)
- (en) Kouji Kamata, Atsuko Suzuki, Yuta Nakai et Hiroshi Nakazawa, « Catalytic Hydrosilylation of Alkenes by Iron Complexes Containing Terpyridine Derivatives as Ancillary Ligands », Organometallics, vol. 31, no 10, , p. 3825-3828 (DOI 10.1021/om300279t, lire en ligne)
- Portail de la chimie