Thalamus
Le thalamus (du grec θάλαμος, chambre à coucher) est une structure anatomique paire de substance grise cérébrale diencéphalique. Les deux thalamus sont situés de part et d'autre du IIIe ventricule dont ils constituent les parois latérales. Situé en position intermédiaire entre cortex et tronc cérébral, le thalamus a principalement une fonction de relais et d'intégration des afférences sensitives et sensorielles et des efférences motrices, ainsi que de régulation de la conscience, de la vigilance et du sommeil.
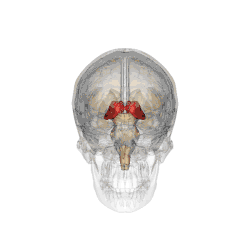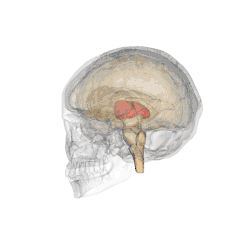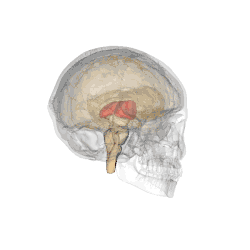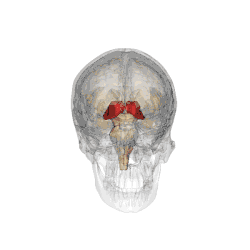
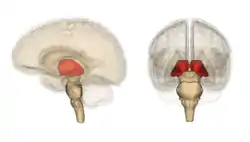
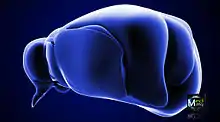
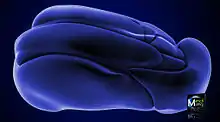
On doit la dénomination du thalamus à Galien qui lui donna le nom de couche optique (thalamus nervorum opticorum, le mot thalamos signifiant littéralement dans ce contexte chambre nuptiale ou plus exactement couche nuptiale[1]), car aux yeux des premiers anatomistes qui disséquaient le cerveau en partant de sa face inférieure, les voies optiques semblaient étendues sur cette couche[2].
Anatomie
Morphologie
Les deux noyaux thalamiques se présentent comme deux masses ovoïdes de substance grise, obliques en avant et en dedans selon un axe d'environ 60°, à grosse extrémité postérieure (pulvinar) et essentiellement en rapport avec :
- En dedans, le troisième ventricule et les ventricules latéraux ;
- Au-dessus, la tête et le corps du noyau caudé dont ils sont séparés par le sillon thalamo-strié ;
- En bas, la région sous-thalamique incluant la zona incerta, le noyau sous-thalamique et la substantia nigra (plus précisément, en avant : le champ de Forel H1 où se situe le faisceau thalamique, et, en arrière : le tegmentum mésencéphalique avec le neorubrum) ;
- En dehors, la capsule interne.
La face médiale des thalamus est limitée en haut par le pédoncule antérieur de l'épiphyse, ou habenula, et, en bas, par le sillon hypothalamique (de Monro). Les deux thalamus peuvent être réunis par une commissure grise interthalamique située dans le IIIe ventricule.
Au sein et autour des deux thalamus se rencontrent des cloisons fibreuses formées de fibres myélinisées, appelées « lames médullaires ». À l'intérieur de deux thalamus, se trouve la lame médullaire interne qui bifurque en avant et en arrière, laissant apparaître des compartiments extramédullaires (antérieur, latéral, postérieur et dorso-médian) et intramédullaires où se logeront des subdivisions nucléaires thalamiques. La région latérale des thalamus est recouverte de la lame médullaire externe laquelle est séparée de la capsule interne par le noyau réticulaire du thalamus, tandis que la région dorso-médiale est recouverte par le stratum zonale, incluant le pulvinar.
Chacun des noyaux thalamiques est subdivisé en différents sous-noyaux en fonction de leur localisation et de leurs afférences/efférences notamment corticales, striatales et cérébelleuses :
- Noyau antérieur (antérodorsal, antéroventral, antéromédial) ;
- Noyau ventral antérieur ;
- Noyau ventral latéral (antérieur, postérieur, médian) ;
- Noyau ventral postérieur (médial, latéral, inférieur) ;
- Noyau latéral dorsal ;
- Noyau latéral postérieur ;
- Noyau dorsomédian (magnocellulaire, parvocellulaire, paralaminaire) ;
- Pulvinar (postérieur, latéral, médian, inférieur) ;
- Noyaux intralaminaires (rostraux : paracentral, central latéral, centro-médian, et caudaux : parafasciculaire, centro-médian) ;
- Noyaux médians (paratenial, paraventriculaire, reuniens) ;
- Noyaux postérieurs (supragéniculé, limitans, posterieur) ;
- Corps genouillés médian et latéral ;
- Noyau réticulaire.
Les efférences issues du thalamus forment les pédoncules thalamiques antérieur, latéral, supérieur, postérieur et ventral.
Afférences et efférences
- Noyau antérieur : des corps mammillaires, prétectum/ vers les cortex cingulaire, rétrosplénial et subiculaire ;
- Noyau ventral antérieur : du pallidum, de la substance noire/ vers les cortex préfrontal et cingulaire ;
- Noyau ventral latéral : du pallidum, de la substance noire, des noyaux cérébelleux profonds/ vers les cortex prémoteur et moteur ;
- Noyau ventral postérieur : du lemniscus médian et trigéminal, faisceau néospinothalamique, faisceau trigéminothalamique, du pédoncule cérébelleux, des faisceaux vestibulothalamique et solitariothalamique/ vers le cortex sensoriel primaire S1 (BA 3/1/2) et secondaire S2, l'insula, le cortex vestibulaire ;
- Noyau latéral dorsal : connexions réciproques avec les cortex cingulaire, rétrosplénial et subiculaire ;
- Noyau latéral postérieur : colliculus supérieur, prétectum, lobules pariétaux supérieur et inférieur, lobe occipital (BA 17/18/19) ;
- Noyau dorsomédian :
- Pour la pars parvocellularis (latérale) : colliculus supérieur, noyau vestibulaire, substance noire/ vers le cortex préfrontal et frontal (BA 8),
- Pour la pars magnocellularis (médiale) : amygdale latérale, pallidum ventral/ vers les cortex orbitofrontal, préfrontal médial (connexions réciproques), et temporal médial et polaire ;
- Pulvinar : cortex associatifs pariétal, occipital et temporal, lobule pariétal supérieur, pôle temporal, sillon temporal supérieur, cortex inférotemporal, colliculus supérieur et prétectum ;
- Noyaux intralaminaires : des faisceaux spinothalamique et trigéminothalamique, pallidum, cervelet, formation réticulée du tronc cérébral surtout ponto-mésencéphalique, connexions réciproques avec les cortex préfrontal, cingulaire et sensorimoteur/ vers le putamen et le noyau caudé ;
- Corps genouillé médian : du lemniscus latéral / vers le cortex auditif primaire (gyrus de Heschl : BA 41) et secondaire (BA 42) au niveau de la première circonvolution temporale ;
- Corps genouillé latéral : de la rétine (15 %) par le nerf optique, du cortex occipital (BA 17/18)/ vers le cortex visuel primaire (BA 17) ;
- Noyau réticulaire : de collatérales des noyaux thalamiques dorsaux, et du cortex cérébral / vers les noyaux thalamiques dorsaux.
Histologie
Le thalamus renferme :
- Des neurones relais activateurs glutaminergiques ;
- Des neurones relais inhibiteurs GABAergiques au sein du noyau réticulaire ;
- Des interneurones inhibiteurs GABAergiques (environ 25 % chez le primates) avec ou sans axones.
Les neurones et interneurones GABAergiques possèdent des extrémités dendritiques « axoniformes » d'aspect variqueux, contenant des vésicules et réalisant des synapses « en passant » avec d'autres neurones. Les dendrites des neurones réticulaires peuvent aussi se connecter entre eux par des jonctions communicantes.
Les afférences sensorielles font synapses au sein de glomérules avec les neurones relais et les interneurones. Ces glomérules sont recouverts par une enveloppe gliale (astrocytaire). Cette glie participe activement au fonctionnement de la synapse : par exemple, elle dispose de récepteurs postsynaptique au Glutamate lesquels, activés, peuvent provoquer une libération gliale de D-sérine qui se fixe, à son tour, sur les sites glycinergiques des récepteurs neuronaux NMDA.
Neurophysiologie
Le thalamus renferme des neurones de projections et des interneurones GABAergiques lesquels exercent un effet inhibiteur postsynaptique via des récepteurs postsynaptiques ionotropes GABA-A ou métabotropes GABA-B. Le noyau réticulaire se compose également de neurones inhibiteurs GABAergiques qui reçoivent des afférences de collatérales des neurones thalamo-corticaux ainsi que des cellules pyramidales du cortex cérébral de la couche 6, et se projettent, à leur tour, sur les neurones thalamiques relais. Le post-potentiel inhibiteur qu'ils génèrent au sein des neurones thalamocorticaux peut être suivi par une bouffée de potentiels d'action (activité de rebond), parfois de manière oscillatoire par la mise en jeu de conductances calciques de bas seuil. Le noyau réticulaire est particulièrement impliqué dans la genèse des fuseaux du sommeil (spindles) lors du sommeil lent.
Les neurones cortico-thalamiques provoquent chez leurs cibles une activation des récepteurs NMDA et surtout AMPA des neurones relais ainsi que leur inhibition di-synaptique et GABAergique par activation des interneurones locaux et des neurones réticulaires.
Les neurones thalamo-corticaux peuvent générer deux types différents de décharges : toniques et phasiques (burst). Lors d'une décharge tonique, une stimulation efficace > −65 mV entraîne l'émission de potentiels d'action Na+-dépendants (spike). La réponse du neurone est alors linéaire et « reflète » l'activation afférente. Lors d'une décharge phasique, une hyperpolarisation aux alentours de −55 mV, par exemple après inhibition ou réduction des activations, peut entraîner l'activation de conductances somato-dendritiques, Ca2+-dépendantes de bas seuil (iT) suivie d'une période réfractaire. La réponse alors observée est non linéaire et dépend de l'état passé du neurone. La transition inactivation → activation de iT dure environ 100 ms.
Il peut aussi en résulter une activité oscillatoire par l’interaction entre la conductance iT et une conductance cationique (ih) activée (plus précisément désinactivée) par une hyperpolarisation aux alentours de −60 mV. Il en résulte l'enchaînement suivant des recrutements des conductances membranaires : hyperpolarisation → activation/désinactivation de ih ⇒ dépolarisation infraliminaire membranaire → activation de iT ⇒ dépolarisation membranaire supraliminaire → bouffée de potentiel d'action Na+/K+-dépendants + inactivation ih et iT → hyperpolarisation ⇒ activation/déinactivation de ih, et ainsi de suite. Cette activation oscillatoire est à la base du rythme delta observé au cours du sommeil lent et est caractéristique de cet état de conscience.
Le type d'activité des neurones thalamiques, tonique, phasique et oscillatoire, dépend donc de la valeur de la polarisation membranaire, donc des caractéristiques de leurs afférences (activatrices, inhibitrices, fréquence et durée de stimulation...). Les afférences comprennent aussi des entrées modulatrices noradrénergiques (locus coeruleus{'), histaminergique (noyau tubéromammillaire), acétyl-choline (noyaux pédunculopontique et tegmental latérodorsal) et sérotoninergique (raphé) qui peuvent modifier la polarité membranaire. Il peut s'agir selon la nature du récepteur postsynaptique soit d'une dépolarisation membranaire par réduction de courants de fuite au potassium (iKL) favorisant ainsi des décharges toniques, soit un accroissement de l'activation de la conductance ih favorisant le mode phasique.
Fonction
Le thalamus serait impliqué :
- À l'état de veille, dans le transfert et filtrage des informations sensorielles périphériques spécifiques vers le cortex ou des signaux transitant par des boucles cortico-thalamo-corticales (système striatal et cérébelleux), et dans l'activation non spécifique du cortex cérébral (vigilance) via les projections corticopètes diffuses des noyaux intralaminaires ;
- Lors du sommeil lent, dans la déconnexion du cortex d'avec les stimulations sensorielles, et dans des processus de consolidation mnésique en stimulant des processus Ca2+-dépendants au sein du cortex cérébral.
La formation réticulée activatrice (notamment par les projections acétyl-cholinergiques) contrôle le mode de fonctionnement du thalamus (tonique versus phasique = veille/REM versus sommeil lent), et donc la transition veille/sommeil.
Il a été également suggéré que l'activité phasique et non linéaire des neurones thalamiques durant l'état de veille pouvait servir comme indicateur de stimulus saillant/nouveau pour une réallocation attentionnelle, alors que l'activité tonique et linéaire participerait à l'analyse fine des signaux sensoriels. L'émission d'une bouffée de potentiel d'action jouerait le rôle de commutateur pour passer en mode tonique.
En effet, la bouffée de potentiel générée à la suite d'un tel stimulus est transmise aux neurones corticaux de la couche 4, mais également via une collatérale aux neurones cortico-thalamiques de la couche 6, lesquels dépolarisent, en retour, les premiers neurones thalamo-corticaux qui passent en mode tonique.
Pathologie
Le syndrome thalamique désigne un ensemble de troubles dont la nature et l'ampleur dépendent de la localisation et de l'étendue de la lésion causale. Parmi les déficits observables, on compte :
- des troubles sensitifs et douleurs thalamiques ;
- des troubles moteurs (déficit musculaire, syncinésies, contractures, hémichorée, astérixis, myoclonies d'intention et d'action, astasie/abasie, négligence motrice) ;
- extinctions sensorielles ;
- négligence spatiale lors de lésions préférentielles latéralisées à droite ;
- aphasie lors de lésions latéralisées à gauche (réduction de la fluence verbale, paraphasies, persévérations, agrammatismes).
Notes et références
- C'est à François Chaussier (1746-1828), professeur à la maternité de Paris, que l'on doit l'utilisation de cette acception.
- P Gailloud, A Carota, J Bogousslavsky et J Fasel, « Histoire de l’anatomie du thalamus de l’antiquité à la fin du XIXe siècle », Schweiz Arch Neurol Psychiatrl, vol. 154, , p. 49-58. (lire en ligne).
Voir aussi
Bibliographie
- (en) Nieuwenhuys, Voogd, van Huijzen (2008) The human central nervous system. Fourth edition. Springer.
- (en) Sherman SM, Guillery RW (2006) Exploring the thalamus and its role in cortical function. Second edition. MIT Press.
- (en) Steriade M, McCormick DA, Sejnowski TJ, « Thalamocortical oscillations in the sleeping and aroused brain » Science 1993;262:679-85.
- (en) McCormick DA, Bal T, « Sleep and arousal: thalamocortical mechanisms » Annu. Rev Neurosci. 1997;20:185-215.
Articles connexes
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Ressources relatives à la santé :
- Uberon
- (en) Medical Subject Headings
- (en) NCI Thesaurus
- (la + en) TA98
- (cs + sk) WikiSkripta
- (en) Article « Thalamus » sur Scholarpedia, par S. Murray Sherman de l'université de Chicago.
- Portail de l’anatomie
- Portail de la médecine
- Portail des neurosciences
- Portail de la physiologie