Titrage
La titrimétrie est une technique de dosage utilisée en chimie analytique afin de déterminer la concentration ou l'activité d'une espèce chimique en solution, ou une activité biologique – le titre désignant une de ces grandeurs. Le titrage correspond à la réalisation du dosage et la titration au résultat d'un tel dosage à partir d'un ensemble de mesures pour différents ratios titré/tirant (tableau ou courbe, et non une seule mesure pour un dosage). Le titrage met en œuvre une réaction chimique ou biochimique (ou une interaction physicochimique ou biologique) entre le composé à doser (titré) et un réactif connu qui est ajouté par incréments (le titrant), réaction qui doit être rapide, totale, univoque, et mesurable (pH, conductivité, couleur, etc.). Le résultat final correspond à la mesure estimée doit correspondre à une équivalence entre le titré et le titrant, typiquement un changement de couleur, ou le point d'inflexion de la courbe des mesures, ou 50 % de la variation entre l'excès de titré et l'excès de titrant.

Méthodes de titration
La méthode de titrage la plus utilisée est le titrage volumétrique. Elle consiste à ajouter graduellement une solution de réactif titrant (avec une concentration volumique connue) afin de « neutraliser » l'espèce à déterminer (à titrer) dans la solution inconnue (appelée analyte). Il existe d'autres types de titrage[1] :
- le titrage gravimétrique : ce titrage diffère du titrage volumétrique en ce que la quantité de solution ajoutée pour compléter la réaction est mesurée en masse plutôt qu'en volume ;
- le titrage coulométrique : le réactif titrant est généré par voie électrolytique plutôt que d'être ajouté comme solution standard[2] ;
- la titration immunométrique : ce titrage fait varier, à volume constant, la concentration d'analyte à titrer (+ou- dilué préalablement) tandis que l'agent titrant (anticorps marqué) est en concentration constante.
La suite de cet article traitera surtout du titrage volumétrique, et en partie au titrage immunométrique.
Types et réactions de titrage
L'analyse titrimétrique repose sur des réactions chimiques (échange/liaisons d'ions, changements d'état d'oxydation c'est-à-dire des transferts d'électrons[3] insolubles).
Le titrage acido-basique est basé sur des réactions acido-basiques, avec une mesure du pH ou de couleur d'un indicateur coloré. Tous les acides et les bases peuvent être titrés avec des solutions de bases fortes ou d’acides forts respectivement. Ce sont les titrages volumétriques les plus répandus. Selon le type d'agent titrant, on parle de :
- titrage acidimétrique ou titrage acide-base : l'opérateur fait couler goutte à goutte un acide dans un volume déterminé de base ;
- titrage alcalimétrique ou titrage base-acide : l'opérateur fait couler goutte à goutte une base dans un volume déterminé d'acide.
Le titrage par oxydoréduction est basé sur les réactions d'oxydo-réduction. Les oxydants peuvent être titrés par des réducteurs et vice versa. Cependant, n’importe quel oxydant ne peut pas être titré par n’importe quel réducteur. L’échelle des potentiels normaux est d’une grande utilité puisqu’elle peut renseigner sur la possibilité du titrage. Les principales méthodes oxydoréductimétriques sont la manganimétrie (permanganate de potassium), la cérimétrie, la chromimétrie (dichromate de potassium) et principalement l’iodométrie sous ses différentes formes.
Le titrage par complexation est basé sur des réactions de complexation. Le réactif titrant et typiquement un agent chélatant qui forme un complexe soluble et coloré avec l'analyte titré (ex. : ion métallique titré par l’acide éthylènediaminetétraacétique (EDTA)). Ce peut aussi être un colorant organique qui se complexe à l'analyte par adsorption et change de couleur (virage d'un indicateur de pH).
Le titrage par précipitation est basé sur les réactions de précipitation, c'est-à-dire insolubilisation ou agrégation de l'analyte complexé par un agent précipitant comme le nitrate d'argent (argentimétrie[1]). Le titrage par précipitation est limité à des analytes de solubilité limitée, et par la faible vitesse de formation de la plupart des précipités.
La titration immunométrique réalise une réaction anticorps/antigène, encore moins rapide, totale et univoque qu'une précipitation, pour identifier et semi-quantifier soit l'anticorps soit l'antigène (ou plusieurs) avec un système de détection colorimétrique ou fluorimétrique ou chemiluminométrique ou radiométrique, sur différents supports et formats dont le plus courant est l'ELISA en mode direct/capture/sandwich ou inhibition/compétition. Titrer par exemple une hormone (analyte) d'un sérum (échantillon), c'est analyser simultanément différentes dilutions du sérum pour déterminer celle qui donne un signal donné spécifique de l'hormone (typiquement le point d'inflexion de la courbe signal = f(dilution)). Le titre du sérum peut être converti en concentration ou activité biologique de l'hormone en le reportant sur la titration de l'hormone purifiée ou d'un sérum calibré en hormone (standard connu en concentration ou activité). On parle plus souvent de dosage ou test immunologique, mais c'est bien un dosage indirect et le plus souvent une titration.
Point d'équivalence
- Avant et au début de l'ajout de la solution titrante, le réactif titrant est limitant tandis que l'analyte (à titrer) est en excès. Son ajout fait diminuer la concentration en analyte jusqu'à ce que ce dernier devienne limitant.
L'équivalence de la titration se produit quand la solution titrante et la solution titrée ont réagi dans les proportions stœchiométriques (les deux réactifs sont limitants).
En poursuivant l'ajout de solution titrante, l'analyte est consommé (ou neutralisé, non disponible pour la réaction), jusqu'à l’être entièrement alors que le réactif titrant ne l'est plus (plateau de la réaction).
Dans le cas d'ions titrés, le point d'équivalence correspond en général au virage d'un indicateur coloré, ou au point d'inflexion de la courbe de la conductivité qui augmente entre deux plateaux de la réaction.
Dans le cas d'une titration immunométrique, le point d’équivalence est déterminé comme 50 % de la fraction liée/libre (B/B0).
Titrages direct et indirect
- Titrage direct : l'analyte A réagit directement avec le réactif titrant B :
- Titrage indirect : l'analyte A réagit dans une première réaction chimique et l'équivalence est déterminée avec une autre réaction chimique :
- Dans le cas où un analyte ne peut être dosé directement, il est possible de s'appuyer sur 2 autres types de titrages
- titrage en retour : l'analyte A réagit en premier lieu avec une solution titrée B en excès connu, on titre ensuite l'excès restant de B par un nouveau réactif E.
B restant + E → F + G
- titrage par déplacement : l'analyte A réagit en premier lieu avec une solution B en excès inconnu, ensuite le produit C formé par cette réaction est titré par un nouveau réactif E.
C formé + E → F + G
Matériel nécessaire
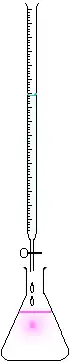
On utilise en général une burette graduée quand le titrage est manuel ou un titrimètre automatique quand on souhaite améliorer la répétabilité et la traçabilité. Le volume de l'échantillon est prélevé au moyen d'une pipette de volume déterminé et est placé dans un erlenmeyer ; un bécher convient mieux s'il faut placer les sondes pH/conductimétriques. La burette contient toujours la solution de réactif titrante dont on connaît la concentration. La graduation de la burette indique le volume versé de solution titrante et donc donnera le point à l'équivalence. La solution à doser sera toujours dans un bécher ou autre récipient propre, son volume sera exactement connu.
Titrage en solution aqueuse
Pour réaliser un titrage, on réalise une réaction chimique où l'espèce en solution réagit avec une autre substance. L'espèce à doser est appelée réactif titré et la substance ajoutée est appelée réactif titrant.
Selon la méthode utilisée pour la détection du point de neutralisation, il est possible de réaliser un titrage par indicateurs colorés, un titrage conductimétrique, un titrage potentiométrique (pH-métrique dans le cas d'un titrage acide-base), un titrage spectrophotométrique, etc.
Titrage pH-métrique
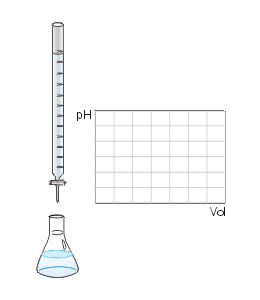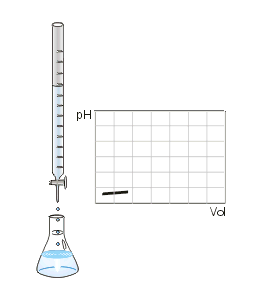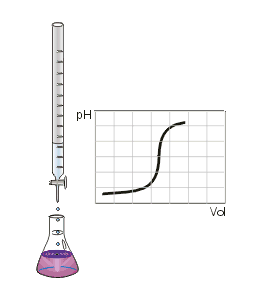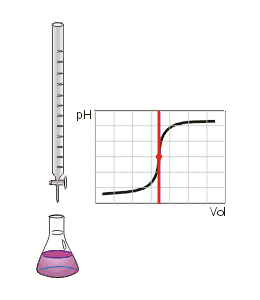
Ce type de titrage est réalisable uniquement avec des acides et des bases, faibles ou forts, et au moyen d'un pH-mètre.
Titrage d'un acide fort par une base forte
En solution, les acides forts comme l'acide chlorhydrique sont totalement dissociés et donnent des ions . De même, les bases fortes se dissocient totalement pour libérer des ions .
Les ions et réagissent de la façon suivante :
Au volume à l'équivalence, tous les ions et ont réagi, la seule réaction qui se produit est celle de l'autoprotolyse de l'eau. Le pH est alors égal à 7. L'équivalence est indiquée soit par un indicateur de pH, soit indirectement par une courbe de titrage représentant le pH en fonction du volume de base versé. On doit pour cela relever les valeurs du pH-mètre pour chaque millilitre de solution versée. Quand le pH commence à augmenter de façon significative, verser alors 0,2 ml de solution entre chaque mesure de pH. Une fois que le pH sera redevenu relativement stable, refaire une mesure de pH tous les millilitres. En traçant la courbe du pH en fonction du volume de base versée, on obtient la courbe représentée comme sur le dessin ci-contre. Pour retrouver le volume à l'équivalence, on doit tracer deux tangentes de part et d'autre du point d'inflexion (qui correspond à l'équivalence). Les tangentes doivent être parallèles. Tracer une perpendiculaire à ces deux droites, puis grâce à un compas, tracer la médiatrice de la perpendiculaire. La médiatrice doit être parallèle aux tangentes. Le volume à l'équivalence est l'endroit où la médiatrice et la courbe se rencontrent, pour un pH de 7.
Calculs
Le but d'un titrage est de trouver la concentration en un élément donné. Il existe pour cela deux moyens possibles : par le calcul et par un tableau d'avancement. Dans les deux cas il faut connaître l'équation bilan de la réaction.
Méthode considérant la stœchiométrie
- À l'équivalence, on a :
→ - donc :
× × - d'où :
× × - donc :
avec :
- : concentration molaire de la solution inconnue en mol·L−1 ;
- : volume d'échantillon utilisé en litres (L) ;
- : concentration molaire de la solution connue en mol·L−1 ;
- : volume de titrant coulé en litres (L) ;
- p et t : coefficients stœchiométriques ;
Cette formule est générale quels que soient les coefficients (ou nombres) stœchiométriques.
En raisonnant avec les concentrations, les coefficients stœchiométriques interviennent.
Tableau d'avancement
Le bilan de la réaction s'écrit comme ceci :
| État initial | ||||
| État intermédiaire | ||||
| État final |
Au début du titrage, (quand on n'a encore rien versé), on n'a que des réactifs et aucun produit de réaction. Au fur et à mesure que la réaction se déroule, une quantité x de réactif disparaît, alors qu'en même temps une quantité x de produit apparaît. C'est l'application de la loi de Lavoisier. À la fin du titrage, c'est-à-dire quand un des réactifs a totalement disparu (celui se trouvant dans l'erlenmeyer) on a atteint l'avancement maximal, la réaction ne peut pas aller plus loin.
À ce moment-là :
- donc :
- .
Ce tableau permet de comprendre ce qui se passe pendant la réaction et de ne pas se tromper avec les coefficients. En effet, on a juste à les reporter devant le x. Normalement quand on a de l'eau dans la réaction on doit écrire « en excès » (on a toujours plus d'eau qu'il n'en faut pour que la réaction se déroule).
Calcul d'un excès
Au départ la solution titrée est en excès. Après l'équivalence, c'est la solution titrante qui est en excès. Pour une réaction acido-basique, l'acide est limitant au début et pour une oxydoréduction, c'est l'oxydant qui est limitant avant l'équivalence.
Un excès est une partie des réactifs qui ne réagit pas pendant une réaction chimique et qui se retrouve donc dans les produits de la réaction. On peut doser l'excès de réactif avec une deuxième réaction chimique : c'est un dosage en retour.
Rappels
- Le nombre de mole n correspond à la quantité de matière d'une espèce chimique.
- La masse molaire M d'un élément est la quantité de matière qu'il faut pour avoir une mole de cet élément.
Exemple : MC = 12 g/mol, il faut 12 grammes de carbone pour avoir 1 mole.
- La masse m est la quantité de matière pesée.
- La concentration est la quantité de matière contenue dans un litre de solution. Elle est exprimée en mol/L pour la concentration molaire c(1) ou en g/L pour la concentration massique ρ(2).
Exemple de calcul
On fait réagir du chlorure de sodium NaCl avec du nitrate d'argent AgNO3.
On verse 10 ml de NaCl à 0,2 mol/L dans un bécher contenant 20 ml de AgNO3 à 0,2 mol/L.
- = 47 g/mol
- = 14 g/mol
- = 16 g/mol
Détermination de la masse de l'excès de AgNO3 :
| + | = | ||||
|---|---|---|---|---|---|
| État initial | |||||
| État intermédiaire | |||||
| État final |
- .
Références
- Douglas Skoog, Donald West et F. James Holler, Chimie analytique, De Boeck Supérieur, .
- (en) « titration », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- J. Mendham, Ronald C. Denney, J. Barnes, Mike Thomas, Collectif, Analyse chimique quantitative de Vogel, De Boeck, 2005.
Articles connexes
- Poids équivalent
- Graphe de Gran : linéarisation graphique permettant la détermination du point d'équivalence, du pKW (ou pKa) et autres paramètres.
Bibliographie
- L. Lopes, « Réactions totales en solution aqueuse », Bulletin de l’union des physiciens, vol. 99, no 872(1), , p. 385-396 (lire en ligne [PDF]).
Liens externes
- L. Lopes, « Titrages acidobasiques de mélanges contenant une espèce forte et une espèce faible : successifs ou simultanés ? » [PDF], sur educnet.education.fr.
- (en) Titrages pH-métriques - résolution ou simulation avec Excel.
- François Byasson, Un fichier Geogebra pour simuler des courbes de titrage acido-basiques, ou analyser les courbes expérimentales
- Portail de la chimie