Tortue marine
Chelonioidea

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Reptilia |
| Sous-classe | Chelonii |
| Ordre | Testudines |
| Sous-ordre | Cryptodira |
Les tortues marines sont les tortues de la super-famille des Chelonioidea[1]. Elles sont présentes dans tous les océans du monde à l'exception de l'océan Arctique.
La tortue luth est la plus grande, mesurant 2 m de long, de 1 m à 1,5 m de large et pesant 600 kg. La taille moyenne des autres espèces va de 50 cm à 1 m et est proportionnellement moins large.
Ces espèces sont toutes vulnérables ou menacées. Elles font localement l'objet de protection ou de plan de restauration, mais la pollution, le braconnage et les prises accidentelles par engins de pêche restent des causes préoccupantes de recul de populations, déjà très relictuelles[2].
Liste des familles
Selon TFTSG (30 juin 2011)[3] et NCBI (17 mai 2014)[4], les 7 espèces actuelles de tortues marines sont réparties en 2 familles et 6 genres :
- famille Cheloniidae Oppel, 1811
- genre Caretta
- Caretta caretta (Linnaeus, 1758) — Caouanne (statut de conservation : « Vulnérable »
 )
)
- Caretta caretta (Linnaeus, 1758) — Caouanne (statut de conservation : « Vulnérable »
- genre Chelonia
- Chelonia mydas (Linnaeus, 1758) — tortue verte (statut de conservation : « En Danger »
 )
)
- Chelonia mydas (Linnaeus, 1758) — tortue verte (statut de conservation : « En Danger »
- genre Eretmochelys
- Eretmochelys imbricata (Linnaeus, 1766) — tortue imbriquée (statut de conservation : « En danger critique d'extinction »
 )
)
- Eretmochelys imbricata (Linnaeus, 1766) — tortue imbriquée (statut de conservation : « En danger critique d'extinction »
- genre Lepidochelys
- Lepidochelys kempii (Garman, 1880) — tortue de Kemp (statut de conservation : « En danger critique d'extinction »
 )
) - Lepidochelys olivacea (Eschscholtz, 1829) — tortue olivâtre (statut de conservation : « Vulnérable »
 )
)
- Lepidochelys kempii (Garman, 1880) — tortue de Kemp (statut de conservation : « En danger critique d'extinction »
- genre Natator
- Natator depressus (Garman, 1880) — tortue à dos plat (statut de conservation : « Données insuffisantes »
 )
)
- Natator depressus (Garman, 1880) — tortue à dos plat (statut de conservation : « Données insuffisantes »
- genre Caretta
- famille Dermochelyidae Fitzinger, 1843
- genre Dermochelys
- Dermochelys coriacea (Vandelli, 1761) — tortue luth (statut de conservation : « Vulnérable »
 )
)
- Dermochelys coriacea (Vandelli, 1761) — tortue luth (statut de conservation : « Vulnérable »
- genre Dermochelys
et les familles fossiles :
- † Protostegidae
- † Thalassemyidae
- † Toxochelyidae

Tortue caouanne 




.jpg.webp)
Description
Les tortues marines, comme les autres tortues (Testudines) sont des reptiles ectothermes disposant d'un système respiratoire pulmonaire, qui correspondait à une adaptation complète à la vie terrestre. En supplément des reins, des glandes lacrymales près de leurs yeux sont capables d'expulser les excédents de sel de leur circulation sanguine. Ces glandes lacrymales transformées en « glandes à sel » expliquent notamment les larmes des femelles lorsqu'elles viennent pondre[5]. Leur métabolisme est capable de supporter des fortes concentrations de CO2 lors des plongées profondes. Elles peuvent extraire 35 à 52 % de l'oxygène de leur respiration[6]. Leur vision est très développée. Les yeux sont protégés par trois paupières, leur ouïe est particulièrement fine même si elles n'ont pas d'oreilles externes, mais une oreille interne, sous une plaque auditive. Leur odorat est en revanche assez peu performant. Les tortues marines n'ont qu'un seul orifice excréteur, qui sert également pour la reproduction.
Le sexe des tortues n'est pas apparent, aussi c'est d'après leurs caractères sexuels secondaires que l'on peut le déterminer. On définit par puberté la période où ceux-ci apparaissent. Le plus flagrant est la taille de la queue, beaucoup plus grande chez les mâles. La taille des griffes chez les chelonidés en est un autre. Cependant, ces caractères sexuels ne sont pas très marqués et certaines femelles peuvent les arborer. Seul un examen génétique permet d'être certain du sexe de l'animal.
Voir aussi: Osmorégulation
Plongée et respiration
Les tortues marines sont des reptiles qui respirent l'air et qui ont donc des poumons. Elles doivent donc régulièrement faire surface pour respirer. Elles passent la majorité de leur temps sous l'eau et doivent donc pouvoir retenir leur souffle longtemps. La durée de la plongée dépend en grande partie de l'activité. Une tortue marine en quête de nourriture peut passer de 5 à 40 minutes sous l'eau, tandis qu'une tortue de mer endormie dépense moins d'oxygène et peut rester sous l'eau pendant 4 à 7 heures.
Lorsqu'elle fait surface pour respirer, une tortue marine peut rapidement remplir ses poumons avec une seule expiration explosive et une inspiration rapide. Leurs grands poumons permettent un échange rapide d'oxygène.
La carapace

Leurs carapaces aplaties leur confèrent de meilleures caractéristiques hydrodynamiques et jouent un rôle évident de protection, mais certains scientifiques pensent qu'elles leur permettent d'emmagasiner la chaleur. Cette adaptation, acquise après leur retour dans le milieu marin, leur permet de descendre très profondément, là où les températures de l'eau sont basses[7]. En contrepartie, elles ont perdu leur capacité d'y rétracter leurs membres. Comme pour les autres tortues aquatiques, leurs carapaces sont plus légères car munies de fontanelles. Les Dermochelyidae, les plus volumineuses des tortues marines, ont d'ailleurs perdu leurs écailles et leurs carapaces sont recouvertes d'un cuir épais. Comme les autres tortues, elles ne muent pas et connaissent une exfoliation superficielle partielle des plaques cornées du squelette.
Selon certaines théories[7], leur carapace, du moins pour la tortue luth, les aide à conserver une température corporelle suffisante lorsqu'elles s'aventurent dans les eaux plus froides ou qu'elles plongent. Mais cette hypothèse est discutée, du fait que les reptiles, animaux à sang froid, sont censés être poïkilothermes.
Il est fréquent de trouver l'équivalent d'un « périphyton » et diverses formes de vies plus ou moins durablement fixées sur des carapaces de tortues marines. Les tortues peuvent alors transporter des organismes et/ou leurs propagules sur de grandes distances, sans qu'on sache si ces relations épibiontiques sont symbiotiques ou non[8]. Mais parmi les animaux fixés sur la tortue (l'épizoaire), les ectoproctes qui pourtant se fixent facilement sur des roches, du bois ou les surfaces foliaires et résistent pour certains très bien au courant semblent très rares sur les tortues.
Seules quelques espèces (moins d'une dizaine) en ont été trouvés sur des carapaces. Ces espèces étaient généralement typiques des habitats côtiers marins intertidaux et subtidaux[8]. Curieusement alors que des formes de vie épipélagiques variées ont été trouvées sur des carapaces de nautiles ou sur des écailles de serpents de mer, les Bryozoa semblent incapables de coloniser ces reptiles[8]. Caretta caretta semble posséder la carapace la plus colonisables par des bryozoaires, alors qu'ils semblent toujours absents chez Dermochelys coriacea ou Eretmochelys imbricata, ce qui pourrait être lié aux caractéristiques surfaciques de leur peau et de leurs écailles, comme aux comportements écologiques des tortues[8].
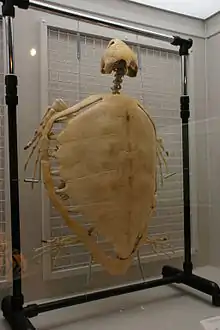 Un squelette de Caouanne, avec la carapace pleine comme les autres Chéloniidés
Un squelette de Caouanne, avec la carapace pleine comme les autres Chéloniidés
Caractéristiques
Elles peuvent nager rapidement et plusieurs espèces sont capables de vitesses pouvant atteindre 35 km/h ; à la différence des tortues d'eau douce, elles avancent par l'action simultanée des membres antérieurs.
À la naissance, il n'y a chez les tortues marines aucun élément anatomique externe qui permette de distinguer un sexe de l'autre.
On pense que certaines tortues marines peuvent dépasser les 150 ans. On a mesuré un record de plongée de 6 heures pour une tortue verte[9].
Reproduction

Les pontes collectives des tortues marines sont appelées arribadas. Elles ont lieu sur les plages au début et à la fin des cycles lunaires quand la marée est au plus bas et le ressac le plus faible.
Après plusieurs années de maturation, les tortues peuvent se reproduire. Les accouplements ont lieu en mer à proximité des sites de nidification ou lors des migrations (entre les sites d'alimentation et les sites de ponte) un ou deux mois avant le début de la ponte.
Lors de l'accouplement, le mâle s'accroche par ses deux griffes antérieures (qui sont donc des caractères sexuels secondaires) à la carapace de la femelle. Les femelles peuvent conserver les spermatozoïdes des mâles durant plusieurs mois ou années dans un repli de leur oviducte. Les femelles ne pondent que sur leur lieu de naissance, à quelques mètres ou centaines de mètres près suivant les espèces. C'est en général à la faveur de la nuit (une exposition trop longue au soleil leur serait fatale), au crépuscule, souvent à la marée montante que les femelles sortent pour pondre sur leur plage de sable d'origine. La femelle peut stocker les spermatozoïdes pour féconder des pontes successives[10]. Le sexe des jeunes dépend de la température pendant l'incubation des œufs, mâles pour la fourchette basse de température, femelles pour la fourchette haute. À cause du réchauffement climatique, il a été constaté depuis quelques années, une diminution de la proportion de mâles.
Elles creusent un trou dans le sable avec leurs pattes ou rames le plus souvent en arrière et y pondent de 70 à 200 œufs (selon les espèces) avant de les recouvrir et retourner à la mer. Certains des œufs ne sont pas fertilisés, les autres incubent pendant environ deux mois. Comme pour les autres tortues, le sexe de l'embryon dépend de la température du nid à une certaine période de l'incubation. Toutes les jeunes tortues éclosent en même temps et se dirigent vers la mer.
Seule une très petite portion (environ 1 sur 1000[11]) reviendra sur la plage qui les a vus naître car elles sont la proie de nombreux prédateurs.
Stades de vie
En fonction de son âge, la tortue ne se nourrit pas de la même façon et ne vit pas dans les mêmes environnements. On distingue :
- Le stade œuf
- Le stade nouveau-né : le nouveau-né sort de l'œuf, émerge du nid le plus souvent en groupe et se réfugie en mer où il nage activement vers le large durant plusieurs jours (de trois à six selon les espèces)[12].
- Le stade juvénile pélagique : ce stade débute lorsque les jeunes tortues abandonnent leur comportement de nage active et se concentrent davantage sur l'alimentation en se laissant porter par les courants marins. Les observations à ce stade sont extrêmement rares. Les comportements peuvent également être différents selon les espèces. Les livrées différentes donnent à penser que toutes les espèces ne vivent pas dans le même biotope.
- Le stade juvénile benthique : les juvéniles se sédentarisent sur les zones benthiques (excepté pour la tortue luth). Leurs habitudes alimentaires semblent changer, leurs prédateurs aussi.

- Le stade subadulte : il commence à la puberté, lorsque les caractères sexuels secondaires apparaissent. Les tortues marines d'une même espèce ne deviennent pas matures sexuellement à la même taille.
- Le stade adulte : les adultes migrent de leur zone de vie à leur zone de ponte. Toutes les espèces de tortues marines sont fidèles à leur lieu de ponte, avec quelques variations en fonction de l'espèce.
Alimentation
Les tortues de mer sont toutes omnivores avec des tendances plus marquées vers les végétaux ou l'alimentation carnée. Ainsi, la tortue verte et la tortue franche du Pacifique sont avant tout herbivores. La tortue caouanne, la tortue olivâtre et la tortue à dos plat sont surtout carnivores et consomment des mollusques, des crustacés, des petits poissons et autre invertébrés marins. La tortue luth est omnivore et consomme en plus des cnidaires. La tortue imbriquée, elle aussi omnivore, consomme, comme la tortue luth, des cnidaires mais est aussi, fait rare pour un vertébré, spongivore.
Les tortues doivent stocker beaucoup d'énergie pour leurs migrations et leurs pontes. Pour cette raison, leur alimentation joue un rôle direct sur leur fécondité. Cela a été démontré en corroborant les nombres de pontes et El Niño qui, en réchauffant l'eau et en leur fournissant plus de végétation, augmente le nombre des migrations deux ans plus tard, tandis qu'un refroidissement abaisse le nombre des migrations deux ans plus tard[13].
Identification des adultes
La plus facile à identifier est bien sûr la tortue luth en raison de son absence d'écailles. C'est aussi la plus grosse des tortues marines. Les Cheloniidea, quant à eux, disposent d'une carapace sans carène et des écailles. Lorsqu'elle possède plus de six paires de plaques latérales sur la dossière, il peut s'agir d'une tortue olivâtre ; avec cinq ou six paires, ce peut être une caouanne ou une tortue de Kemp. Avec quatre paires, c'est une tortue verte ou une tortue imbriquée. On distingue facilement la caouanne et la tortue de Kemp par leur couleur ; la première est rouge orangé et la seconde gris-vert. On distingue également la tortue verte de la tortue imbriquée par la forme du bec et le nombre d'écailles préfrontales. La tortue à dos plat dispose d'une seule griffe par nageoire, d'écailles marginales parfois recourbées vers le haut, d'une seule paire d'écailles préfrontales. On peut signaler que la tortue olivâtre et la tortue de Kemp disposent de quatre paires de plaques inframarginales, chacune percée d'un pore près de son bord postérieur.
 Tortue verte, on l'identifie à ses 2 écailles préfrontales allongées et son écaille nucale
Tortue verte, on l'identifie à ses 2 écailles préfrontales allongées et son écaille nucale
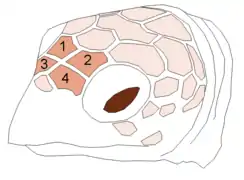 Les 4 écailles préfrontales dessinent une croix blanche entre les deux yeux d'une tortue imbriquée
Les 4 écailles préfrontales dessinent une croix blanche entre les deux yeux d'une tortue imbriquée les 4 préfrontales d'une Caouanne, séparées en leur milieu
les 4 préfrontales d'une Caouanne, séparées en leur milieu Tortue luth et sa carapace sans écaille
Tortue luth et sa carapace sans écaille
Identification des nouveau-nés
- Le nouveau-né de caouanne est couleur brun foncé avec bord clair, nageoire bordée de jaune pale[10].
- Le nouveau-né luth a des nageoires beaucoup plus grandes et peau rugueuse, avec une disposition réticulée de petites écailles. Sa dossière est noire, avec des crêtes latérales blanches tandis que son plastron blanc, marbré de brun clair[10].
- Le nouveau-né de tortue verte a une dossière noir brunâtre, sa partie postérieure et les pattes-nageoires avec un bord blanc; le dessous du cou, le corps et pattes-nageoires sont blanc jaunâtre[10].
- Le nouveau-né de tortue imbriquée est brun rougeâtre[10].
- La dossière gris foncé du nouveau-né de tortue de Kemp dispose de trois crêtes longitudinales. On retrouve deux crêtes sur le plastron plus pâle. Chez quelques individus, les nageoires sont bordées de blanc, leur région axillaire teintée de verdâtre[10].
- Les écailles du nouveau-né de la tortue à dos plat sont marron mais bordurées foncées si bien qu'on les distingue facilement[14].
 nouveau-né de tortue caouanne
nouveau-né de tortue caouanne nouveau-né de tortue verte
nouveau-né de tortue verte nouveau-né de tortue imbriquée
nouveau-né de tortue imbriquée nouveau-né de tortue de Kemp
nouveau-né de tortue de Kemp nouveau-né de tortue olivâtre
nouveau-né de tortue olivâtre nouveau-né de tortue à dos plat
nouveau-né de tortue à dos plat nouveau-né de tortue luth
nouveau-né de tortue luth
Maladies
La fibropapillomatose est une maladie de peau des tortues marines.
Chorologie
Écologie

Les tortues sont souvent observées accompagnées de rémoras qui se nourrissent de leurs parasites. Cette particularité est utilisée par certains chasseurs de tortues de l'océan Indien qui pêchent la tortue verte ou imbriquée. Le rémora attaché agrippe la tortue qui peut donc ensuite être pêchée. Comme pour d'autres tortues, on peut également observer des balanes et des algues filamenteuses sur leurs carapaces.
Répartition
On les trouve dans toutes les mers du globe avec une nette prédilection pour les zones équatoriales où elles doivent venir pondre, excepté la Caouanne qui pond dans les zones méditerranéennes. La tortue luth est la seule tortue qui peut vivre jusqu'en Scandinavie. Les Chelonidae restent dans les eaux plus chaudes mais on a pu en faire quelques observations jusqu'en Manche. Elles préfèrent une température de l'eau allant de 25 à 30 °C. Elles n'hibernent donc pas mais leur activité baisse durant la saison froide. Les jeunes vivent en général à moins de 5 m de la surface, où les eaux sont plus chaudes.
Migration
Toutes les tortues marines semblent migrer, excepté les mâles olivâtres[15]. Elles semblent régulièrement utiliser certains corridors biologiques sous-marins, notamment pour retrouver leurs lieux de ponte, grâce à un extraordinaire sens du temps et de l'orientation. On pense qu'elles sont notamment sensibles au champ magnétique terrestre[16],[17] et qu'elles l'utilisent pour leurs migrations. On sait par ailleurs qu'elles suivent dans leur migration les courants marins. De nombreuses études cherchent à comprendre leurs migrations pour mieux les protéger.
Le fait que la plupart des espèces reviennent pondre à l'endroit où elles ont éclos semble indiquer qu'elles en ont mémorisé les caractéristiques y compris magnétiques.
Prédateurs
Les tortues marines possèdent des ennemis naturels tels le grand requin blanc, le Requin tigre et le Requin bouledogue[18] comme en témoignent les cicatrices trouvées sur leurs carapaces[18], mais surtout l'homme. Cependant elles sont surtout vulnérables à cause de leur système de reproduction. Elles doivent s'approcher des côtes pour pondre, l'homme est là, son principal prédateur. Les œufs sont laissés sans surveillance. L'homme n'est pas le seul à prélever des œufs. On a pu montrer que des petits mammifères[19], des chiens et même des mangoustes (sur les plages Virginie) pillent les nids[20]. Plus surprenant encore, les œufs sont aussi directement menacés par les insectes et, en Guyane française notamment pour la tortue luth, par la courtilière[21]. Puis les nouveau-nés, très vulnérables, sortent en général la nuit, dès que la température baisse. À la moindre hausse de la température, ils stoppent toute activité.
Lorsqu'ils émergent du sable, ils se dirigent vers des signaux lumineux, habituellement les vagues qui clignotent à la lueur de la lune ou des étoiles[18]. Leur survie est donc fortement gênée par l'urbanisation et les lumières qui en résultent. Ces lumières changent les trajectoires des bébés tortues qui ne se dirigent plus forcément vers la mer.
Ils doivent gagner la mer le plus vite possible, pour cela, il faut échapper aux mammifères comme les chiens ou, par exemple pour les tortues luth de Guyane, aux coatis[22]), oiseaux, lézards, et aux crabes qui sont des omnivores très voraces. Enfin ils doivent atteindre des zones marines plus isolées ou protégées en échappant à une grosse prédation venue des gros poissons, céphalopodes (poulpes, calamars) ou oiseaux marins venus les attendre[18]. On pense que les nouveau-nés s'orientent aussi en mer (de nuit) grâce au champ magnétique terrestre. Une fois au large et dans les courants, ils s'abritent dans les masses flottantes environnantes[18].
Outre les prédateurs, les glissements de terrain et le tassement du sable peuvent endommager ou détruire le nid[18].
Les populations
Pour la plupart des espèces, il est très difficile de connaitre très précisément le nombre des tortues marines en raison de deux comportements : d'une part leur comportement migrateur ne nous permet pas de déduire le nombre de tortues des observations localisées, leur densité, pouvant varier en fonction des lieux, des périodes, etc. ; d'autre part, on ne peut déduire le nombre de femelles en surveillant les pontes, car leur fréquence de ponte varie fortement en fonction des lieux et de l'âge des tortues. Le grand nombre de plages où elles vont pondre, leur grande longévité, ainsi que le temps important avant d'atteindre la maturité sexuelle, ont permis à l'espèce de résister aux prélèvements massifs opérés par les humains, cependant lorsque ces prélèvements atteignent une taille critique, la population de tortues chute et peut mettre plusieurs dizaines d'années avant de croitre à nouveau[23].
Il a cependant été observé des augmentations au niveau local. D'après une étude rendue publique à Kélonia le , la population de tortues marines observée sur l'île Europa a progressé selon un taux de croissance annuel moyen de 6 % entre 1983 et 2007[24].
Les tortues marines et l'Homme
Menace sur les tortues marines

Les populations de tortues de mer semblent avoir été autrefois très denses et importantes. Leur chasse à grande échelle pour leur viande, graisse ou carapace semble ancienne, et les populations côtières ont « toujours » récolté les œufs de tortues.
Aux Antilles, parmi les premiers chroniqueurs, le Père Breton, le Père Du Tertre et le Père Labat estimaient qu'elles étaient sans doute déjà moins nombreuses que quand les premiers habitants de ces îles les ont découvertes vers 2 000 ans av. J.-C.[25]. Mais au XVIe et XVIIe siècles, ces reptiles étaient encore très communs. Le Père Du Tertre (1667-1671) pour la Guadeloupe écrivait : « (...) on ne saurait croire combien de lamantins, de tortues et tous les autres poissons se plaisent autour des îlets. Il semble que la grande mer s'en épuise pour les remplir ; car je suis très certain que pendant les dix premières années que l'isle a été habitée, on a tiré chaque année plus de trois à quatre mille tortues, un très grand nombre de lamantins, et que l'on en tire encore tous les jours quantité, et il s'en tirera jusqu'à la fin du monde sans les épuiser (..). ».
Cette prédiction ne s'est par réalisée. En 1976, Kermarrec parlait pour la zone caraïbe d'un véritable génocide, qui a, au début des années 1990, engagé l'administration française à, théoriquement, strictement protéger les tortues marines des Antilles françaises[26]. 15 ans après, un début de restauration des effectifs de certaines espèces de tortues marines semble en cours dans les caraïbes françaises.
Mais dans le monde, toutes les tortues marines restent menacées, la tortue luth étant en danger critique d'extinction (liste rouge de l'UICN).
La plus grande menace actuelle est la pêche accidentelle au palangrier ou au chaluts, notamment lors de la pêche au thon. Il est estimé que 40 000 tortues meurent chaque année de la pêche au palangrier. D'après des chercheurs du 24e congrès sur la conservation et la biologie des tortues marines au Costa Rica, la tortue luth n'a plus que dix ans avant extinction si rien n'est fait pour régler ces problèmes.
Des changements simples et peu chers comme des hameçons plus gros ou des pièges dont les tortues peuvent s'échapper peuvent faire chuter de manière spectaculaire le taux de mortalité.
D'autres dangers sont les déchets marins flottants tels que des filets de pêches abandonnés dans lesquels elles sont piégées et se noient ou les sac plastiques qu'elles prennent pour des méduses (un de leurs aliments) et leur provoquent des occlusions digestives et/ou un faux sentiment de satiété. Des débris de plastique sont retrouvés dans l'estomac de près de 80 % des tortues marines échouées dans le bassin méditerranéen occidental[27].
.jpg.webp)
Le développement touristique ou l'urbanisation de certaines plages de ponte[28] est également une sérieuse menace pour les tortues de mer. Il y a donc eu un mouvement pour protéger ces zones de ponte, parfois même par la police. Dans certains endroits comme en Floride, après qu'une tortue a pondu ses œufs, ceux-ci sont ramassés et replacés dans des nurseries où ils sont protégés. Ce n'est pas la meilleure solution car les tortues reviennent pondre sur leur plage d'origine.
La pollution lumineuse est une autre cause de mortalité, mais la réglementation de l'éclairage peut éviter que les bébés tortues ne confondent les lumières artificielles avec celle de la Lune ou du Soleil sur la mer et n'aillent dans la mauvaise direction après l'émergence.
Le braconnage et le marché noir de la viande ou des œufs de tortue reste un problème dans le monde entier, spécialement en Inde, Indonésie et chez les nations côtières d'Amérique latine. Des estimations font état de 35 000 tortues tuées par an au Mexique et autant au Nicaragua.
Chasse traditionnelle
Sur les plages au moment de la ponte, les tortues sont renversées sur le dos, puis au petit matin emmenées. Mais beaucoup de tortues sont prises dans des filets fixes ou dérivants. En Haïti les pêcheurs utilisent des dispositifs appelés "fol" constitués d'une nappe de filet avec beaucoup de mou. Un autre dispositif de capture appelé "bobèche" est composé de morceaux de bois rappelant la forme d'une tortue et l'ensemble est recouverte d'alèses de filets dans lequel vient s'emmêler la tortue mâle qui croyait avoir affaire à une femelle[29].
Dans l'Océan Indien et dans l'Océan Pacifique, la queue d'Echeneis naucrates, un rémora, est attachée à une corde et la tortue est pêchée lorsque celui-ci se fixe sur sa carapace.
Consommation
La consommation de tortues marines est cependant risquée : ces animaux vivent très vieux et accumulent donc dans leur chair des années de toxines et métaux lourds non métabolisables, qui peuvent facilement rendre cette viande toxique, même après cuisson[30]. Par exemple, en novembre 2017 après qu'un pêcheur malgache a cuisiné pour son village une tortue verte d'1,20 m fraîchement pêchée, plus de 40 villageois sont tombés gravement malades et ont dû être hospitalisés en urgence, et 10 d'entre eux sont morts, notamment de jeunes enfants[31].
La menace chimique
Les polluants chimiques et plus particulièrement les métaux s'accumulent dans le foie, les reins et les muscles des tortues marines[32]. Cette accumulation de polluants pourrait avoir un rôle dans la propagation de maladies comme la fibropapillomatose[33].
La dégradation des habitats
La dégradation des mers et de la barrière corallienne est une menace pour les populations de certaines espèces.
Protection
Les constats alarmants sur les populations de tortues marines ont poussé certaines instances internationales (UICN, WWF, etc.) à les considérer en danger d'extinction. Depuis 1981, toutes les espèces sont inscrites à l’annexe I de la Convention de Washington. Malgré cela, les effectifs diminuent.
Des campagnes d'éducation ont été lancées au Mexique et aux États-Unis impliquant des personnalités comme Jean-Paul II, Dorismar, Los Tigres del Norte et Maná.
De septembre à mars, trois espèces de tortues marines, dont la tortue luth, la plus grande, viennent pondre sur la plage de Mexiquillo, ville du Mexique. Menacées par le braconnage et l'urbanisation, elles sont protégées par la Profepa, un organisme d'État, avec la collaboration des Indiens Nahuas. Pendant la saison de ponte, un contingent de la marine nationale arpente les 36 km de plages classées réserve naturelle depuis 1986.
Des tortues marines blessées sont parfois secourues et soignées par des organisations comme le Marine Mammal Center en Californie, et au centre Kélonia sur l'île de la Réunion (outre-mer français de l'océan Indien).
Pour empêcher les captures accidentelles par les chalutiers, les Américains ont mis en place un dispositif d'exclusion des tortues qui permet de les limiter.
En France

Six espèces de tortues marines vivent sur le territoire national : Tortue Luth (Dermochelys coriacea), Tortue caouanne (Caretta caretta), Tortue verte (Chelonia mydas), Tortue de Kemp (Lepidochelys kempii), Tortue imbriquée (Eretmochelys imbricata), et Tortue olivâtre (Lepidochelys olivacea). Des données sont collectées par un Observatoire des Tortues marines sur les échouages de tortues sur les côtes de France métropolitaine (Atlantique, Manche, mer du Nord), systématiquement depuis 1980 via le réseau de correspondants créé en 1972 pour le suivi des mammifères marins. En 2015, ce réseau comprenait 123 correspondants intervenant dans 16 départements. Ces données sont envoyées à un coordinateur national (R. Duguy) qui en publie une synthèse annuelle[34]. Sur la façade Méditerranéenne, un réseau du même type s'est mis en place à partir de 1996 (via la Société herpétologique de France avec début 2015 94 correspondants œuvrant dans 9 départements[34]), puis cette mission d'observation des tortues marines a en France métropolitaine été confiée aux deux réseaux d’échouage, de sauvetage et d'observation[34]. Des données d'intérêt scientifique sont recueillies sur les animaux échoués ou capturés accidentellement, permettant de mieux décrire les tendances démographiques et sanitaires ou de détecter des évènements affectant une ou plusieurs espèces de tortues, tout en évaluant mieux les pressions anthropiques subies par ces animaux. Des campagnes et sorties en mer sont aussi sources de données.
Pour faire face à la régression de ces espèces, en 1991, la Direction de la Nature et des Paysages a créé un « Groupe Tortues marines »[34].
Un plan d'action en faveur des Tortues Marines a été mis en place avec en 1993 la production d'un « cahier des charges » contenant des orientations d'étude sur les tortues marines de France métropolitaine et d'outre-mer[34].
Les tortues imbriquées, vertes, luths, caouannes et olivâtres sont, aux Antilles françaises, concernées par un « plan de restauration », plan local et régional. Ce plan est subdivisé en :
- un Plan de Restauration des Tortues Marines de Guadeloupe,
- un Plan de Restauration des Tortues Marines de Martinique,
- un projet de programme de coopération internationale à développer à échelle géographique plus large, voire planétaire afin de mieux prendre en compte les métapopulations et la diversité génétique des espèces.
En Guyane, un des plus importants sites de ponte des tortues marines au niveau mondial (en particulier pour la tortue luth), un plan a été mis en place en 2007, et validé par le Conseil National de Protection de la Nature du Ministère de l'Environnement. Il a été coordonné depuis 2008 par le WWF (Fonds Mondial pour la Nature) et l'Office National de la Chasse et de la Faune Sauvage (ONCFS), sous pilotage de la Direction de l'Environnement, de l'Aménagement et du Logement (DEAL) qui l'a soutenu financièrement. Ce plan a bénéficié également d'un soutien financier de l'Europe (dans le cadre du Feder-PO Amazonie, projet Caret2 porté par le WWF). Ce Plan de Restauration concernait trois espèces nidifiant régulièrement dans ce département d'Outre-mer à savoir : la tortue luth (Dermochelys coriacea), la tortue olivâtre (Lepidochelys olivacea) et la tortue verte (Chelonia mydas). Il avait pour objectif d'améliorer l'état de conservation des espèces ciblées[35]. D'importantes avancées ont vu le jour, tel que le TTED (Trash and Turtle Excluder Device) qui équipe aujourd'hui tous les chalutiers crevettiers de Guyane grâce à l'implication des professionnels de la pêche, l'amélioration des connaissances des espèces, la réduction du braconnage (Alors qu'en 1999, l'ONCFS estimait que près de 80 % des nids de tortues faisaient l'objet de pillages sur les plages isolées, la lutte contre ce braconnage semble commencer à porter des fruits[36] ; sur les plages surveillées par l'ONCFS en 2011 et 2012, le taux de pillage des nids de tortues marines serait inférieur à 1 %).
À l'inverse, sur l'île française de Mayotte, le braconnage de tortues vertes est quasiment industriel : on estime qu'environ 400 tortues sont dépecées chaque année sur les plages où elles viennent pondre, alimentant un important marché clandestin[37].
En 2014, un nouveau Plan national d'action en faveur des tortues marines entre en vigueur pour une durée de 10 ans. Il fait suite à un important travail de concertation et de réflexion avec une trentaine de partenaires. Il fixe différents objectifs (réduction des menaces, amélioration des connaissances, coopération transfrontalière...) et des actions prioritaires : réduire la pêche illégale (1re menace pour les tortues marines en Guyane), évaluer les interactions de la pêche légale côtière, évaluer les impacts de la recherche pétrolière off-shore...
Observatoires et centres de soins français
De nombreux associations, musées et bureaux d'études œuvrent pour la préservation des tortues marines et la sensibilisation du public sur le territoire français :
- Kelonia est un observatoire, un musée et un centre de soins situés à Saint-Leu, La Réunion[38]. Le site est ouvert au public et les visiteurs sont invités à admirer les tortues en soins tout en s'informant sur leur biologie, l'Histoire qui leur est liée et les menaces qui pèsent sur elles. La vie de ce centre d'étude et de sensibilisation s'articule autour de 4 grands bassins et de nombreux bassins mineurs. Les tortues en soin suivent un parcours spécifique d'un bassin à l'autre en fonction de leur état de santé.
- Le CEST-med est un centre de soins et d'étude des tortues marines de Méditerranée situé au Grau-du-Roi[39]. Outre ses actions de sauvetage et de conservation, ce centre propose des activités de sensibilisation pédagogique pour les scolaires et le grand public.
- Le CESTM est un centre de soins dont la zone de responsabilité s'étend sur toute la côte Atlantique de France métropolitaine. Il est situé à l'aquarium de La Rochelle, et a mis en place de nombreux partenariats avec les usagers de l'océan à travers le réseau Tortues Marines Atlantique Est qu'il coordonne[40].
- Te mana o te moana est un observatoire de la vie marine situé à Moorea couplé à un centre de soins pour tortues marines, qui anime un réseau d'observation et met régulièrement en place des actions de sensibilisation à l'attention du public scolaire. Son statut est associatif.[41]
- Kwata est une association guyanaise d'étude et de protection de la nature qui assure l'observation et le suivi des pontes de tortues luth sur les plages du département. Elle sensibilise les promeneurs qui assistent à ces pontes aux bonnes pratiques et techniques d'observation afin de ne pas déranger les animaux et assurer leur succès reproducteur[42].
Les données et actualités scientifiques et pédagogiques de l'ensemble des réseaux et observatoires français sont centralisées et compilées par le Groupe Tortues Marines France (GTMF), animé par le Muséum National d'Histoire Naturelle à Paris[43].

L'élevage

Depuis les années 1970, quelques élevages marins de tortues ont été créés dont des fermes intégrant des tortues imbriquées. cependant ces élevages sont contestés. Leurs objectifs sont quadruples :
- aider à la recherche sur les tortues ;
- fournir un cadre de découverte pour que le grand public découvre les tortues et soit sensibilisé aux problèmes de l'environnement marin ;
- faire des relâchés ;
- vendre les écailles pour faire financer le projet.
Le quatrième point est le plus controversé, en favorisant un commerce légal il entraine nécessairement un trafic parallèle de carapaces de tortues sauvages. D'autre part, il est très difficile de contrôler si les œufs sont des œufs de nids sauvages pillés (« ranch ») ou obtenus à la suite de l'accouplement d'adultes déjà en captivité (« ferme »).
Ces élevages se font généralement en bassin fermé (toute tentative en bassin ouvert ayant échoué). Leur alimentation, habituellement très pauvre en calories, impossible à reproduire en captivité et qui entraîne une croissance lente, est modifiée. Elle est plus riche en protéines. L'eau est également chauffée pour accélérer leur croissance. Ces projets sont généralement jugés non rentables en raison des coûts liés à l'entretien des bassins et à la surveillance médicale, sauf les élevages de tortues imbriquées qui pourraient s'avérer économiquement viables en raison de la valeur de son écaille. L'absence de certitudes quant à l'effet d'un relâchage et la possibilité de provoquer des épidémies dissuadent les gouvernements de soutenir ces initiatives[44]. Ils semblent avoir tous fermé[réf. nécessaire].
Origine
Les plus vieux fossiles de tortues marines dont nous disposons datent de 110 Ma[45]. On pense donc que, après quelque 150 Ma de vie terrestre et d'essais de colonisation des milieux aquatiques, des tortues ont gagné la mer avec tous les caractères adaptatifs liés à cet élément liquide. Le squelette s'est allégé, les membres transformés en palettes natatoires et en gouvernail, la carapace s'est aplatie, les poumons se sont adaptés à de longues apnées, la vision s'est adaptée, leur cou a perdu sa capacité de rétraction dans la carapace. La différenciation qui allait donner naissance à la lignée des Dermochelyoidea et des Cheloniidae s'est faite, dès le début de cette colonisation au Crétacé entre 100 et 150 Ma[45]. Quatre familles des tortues de mer ont survécu à l'extinction massive du Crétacé, les Toxochelyidae, Protostegidae, Cheloniidae et Dermochelyidae. La famille des Toxochelyidae s'est éteinte durant l'Éocène, la famille des Protostegidae durant l'Oligocène.
Paléontologie
La Montagne Saint-Pierre en Belgique est un site de découvertes de tortues marines fossiles en Europe.
Taxonomie et systématique
Toutes les tortues marines appartiennent à la Superfamille Chelonioidea. Aujourd'hui il n'y a que 7 espèces de tortues dans deux familles alors qu'il y a eu dans le passé cinq familles contenant des douzaines d'espèces. La classification simplifiée présentée ici est tirée de Hirayama (1997, 1997), Lapparent de Broin (2000), et Parham (2005)[46].
o polycryptodira |--o Chelydridae `--o Procoelocryptodira |--o Chelonioidea Bauer, 1893, les tortues marines | |--o | | |--o †Toxochelyidae | | `—o Cheloniidae, dont les tortues imbriquées, vertes... | `--o Dermochelyoidea | |--o Dermochelyidae dont la tortue luth | `—o †Protostegidae dont Archelon, Santanachelys `--o Chelomacryptodira, c'est-à-dire les autres tortues cryptodires non marines
Voir aussi : Testudines (classification phylogénétique)
Les sept espèces de tortues marines vivantes :
- tortue caouanne
- Tortue luth
- tortue imbriquée
- Tortue verte
- Natator depressus
- tortue olivâtre
- Tortue de Kemp
Le statut taxonomique de la tortue franche du Pacifique est toujours discuté.
Voir aussi
Article connexe
Il n'existe qu'une seule tortue non chélonioidé et qui puisse vivre aussi dans l'eau de mer. Chelodina siebenrocki vit dans l'eau douce et s'aventure dans les mangroves.
Publication originale
- Baur, 1893 : Notes on the classification of the Cryptodira. The American Naturalist, vol. 27, p. 672–674 (texte intégral).
Références taxonomiques
- (en) Référence Fauna Europaea : Chelonioidea
- (en) Référence NCBI : Chelonioidea (taxons inclus)
- (en) Référence TFTSG : [PDF]
- (en) Référence uBio : Chelonioidea
Bibliographie
- Robert Calcagno, Tortues marines. La grande odyssée, édition Glénat, 2017, 144 p.
- (en) Spotila, James R. (2004). "Sea Turtles: A Complete Guide to Their Biology, Behavior, and Conservation." Baltimore: Johns Hopkins University Press. (ISBN 0-8018-8007-6).
- David Graff et Javier Juste Ballesta, « Les tortues marines des îles du Golfe de Guinée », Canopée, vol. 5, (lire en ligne)
- René Márquez M. et M.-L. Bauchot, Les tortues, FAO (lire en ligne)
- Arrêté du 9 novembre 2000 fixant la liste des tortues marines protégées sur le territoire national français J.O. Numéro 283 du 7 décembre 2000
- Chevalier et Lartiges, Les tortues marines des Antilles (lire en ligne)
- (en) Luschi P., Benhamou S., Girard .C, Ciccione S.,Roos D., Sudre J., Benvenuti .S, « Marine turtles use geomagnetic cues during open-sea homing. », Current Biology, vol. 17, , p. 126–133.
- Girard C., Sudre j., Benhamoun S., Roos D., Luschi P., « Homing in green turtle Chelonia mydas : oceanic currents act as a contraint rather than a information source. », Marine Ecology Progress series, vol. 322, , p. 281-289.
- (en) Pelletier D, Roos D, Ciccione S, « Oceanic survival and movements of wild and captive-reared immature green turtles (Chelonia mydas) in the Indian Ocean. », Aqua Liv Res, vol. 16, , p. 35-41
- Bourjea J, Sauvignet H & Ciccione S (2018) Les tortues marines 70 clés pour comprendre ; Ed Quae, 112 pages | (ISBN 978-2-7592-2693-1) | paru : 31/08/2017
Liens externes
- Ressources relatives au vivant :
- (en) EU-nomen
- (en) Fauna Europaea
- (en) Paleobiology Database
- (mul + en) iNaturalist
- (en) Système d'information taxonomique intégré
- (en) Universal Biological Indexer and Organizer
- (en) World Register of Marine Species
- (en) Référence Fauna Europaea : Chelonioidea
- (en) Référence NCBI : Chelonioidea (taxons inclus)
Notes et références
- Turtles of the World, 2010 Update:Annotated Checklist of Taxonomy, Synonymy, Distribution, and Conservation Status (Checklist 000v3), p. 92
- Les tortues de mer de Sipadan, musique et fabrication : Christoph Brüx
- TFTSG, consulté le 30 juin 2011
- NCBI, consulté le 17 mai 2014
- Franck Bonin, Bernard Devaux et Alain Dupré, Toutes les tortues du monde, Delachaux et Niestlé, , p. 10.
- Les tortues, vol.2, Animalia Édition (ISBN 2951645198)
- « Toutes les tortues du monde » de Franck Bonin, Bernard Devaux et Alain Dupré, deuxième édition (1998), éditions Delachaux et Niestlé/WWF.
- Frazier, J. G., Winston, J. E., & Ruckdeschel, C. A. (1992). Epizoan communities on marine turtles. III. Bryozoa. Bulletin of marine science, 51(1), 1-8. (résumé)
- « Cours Les TORTUES », Corinne CUROT
- René Marquez M. et M.-L. Bauchot, Les tortues, FAO (lire en ligne)
- « Connaissances des sites de pontes des tortues marines à la Réunion », Association Vie Océane (consulté le )
- « Les Tortues Marines », Réseau tortue marine de Guadeloupe
- C. J. Limpus et N. Nicholls, The southern oscillation regulates the number of green turtles (Chelonia mydas) breeding around northern Australia, vol. 15, Australian Wildlife Research, , p. 157-161
- « Tortue à dos plas », RITMO, réseau d'information sur les tortues d'Outre Mer (consulté le )
- (en) « Kemp's ridley turtle », WWF
- « L'influence de la météo sur la tortue luth », site canadien Espace pour les espèces.
- « Loggerhead Sea Turtle », WWF (consulté le )
- « Aspect biologique de la tortue imbriqué », CITES (consulté le )
- (en) « Hawksbill Sea Turtle », marinebio.org (consulté le )
- (en) David Nellis, Vonnie Small, « Mongoose Predation on Sea Turtle Eggs and Nests », Biotropica, The Association for Tropical Biology and Conservation, no 2, , p. 159–160 (résumé)
- Rapport d'activité de la Réserve Naturelle de l'Amana en 2003 rédigé par Noémi Morgensterne
- « À la découverte des tortues marines... », sur Terres de Guyane (consulté le )
- « Situation des tortues imbriquées au plan mondial et régional », CITES (consulté le )
- Un responsable de l'IFREMER, journal télévisé de Télé Réunion, .
- Pregill et al., 1994
- Cf. Arrêtés de protection de 1991 en Guadeloupe et de 1993 en Martinique
- Service de l'observation et des statistiques - Commissariat Général au Développement Durable, L'environnement en France : édition 2014, La Défense, Ministère du développement durable, , 383 p. (ISBN 978-2-11-138802-4, lire en ligne), p. 74.
- (en) « Turning Turtle », Greenpeace (consulté le ) Pour les tortues olivâtres
- Rapport à Haïti
- Frédéric Ducarme, « Les tortues du lagon de Mayotte », sur MayotteHebdo.com, .
- « Une tortue nous plonge dans l'horreur », sur antsapeche.net, .
- (en) Yasumi Anan, Takashi Kunito, Izumi Watanabe, Haruya Sakai, and Shinsuke Tanabe, « TRACE ELEMENT ACCUMULATION IN HAWKSBILL TURTLES (ERETMOCHELYS IMBRICATA) AND GREEN TURTLES (CHELONIA MYDAS) FROM YAEYAMA ISLANDS, JAPAN », Society of Environmental Toxicology and Chemistry, vol. 20, no 12, , p. 2802–2814 (lire en ligne)
- Jones, 2004, Sea turtles: old viruses and new tricks. Current Biology, 14, R842-R843
- 2015-01171_MNHNtortues_marines_20162020 (format pdf - 399.6 ko - 26/08/2016
- ONCFS, La lutte anti-braconnage de tortues marines porte ses fruits, consulté 2013-04-03
- Ornella Lamberti (AFP), « A Mayotte, la difficile lutte contre le braconnage des tortues vertes », sur Sciences et Avenir, .
- « Site du musée Kelonia »
- « CESTMed, tortue marine, protection tortues marines, mediterrannée », sur CestMed - Sauvegarde des tortues marines (consulté le )
- Quai Louis Prunier-BP 417002 La Rochelle Cedex 1Tél. +335 46 34 00 00, « Le Centre des Tortues - CESTM », sur Aquarium La Rochelle - Site Officiel, (consulté le )
- « Qui sommes-nous ? » (consulté le )
- « Association Kwata - Protection de la nature en Guyane », sur www.kwata.net (consulté le )
- « GTMF » (consulté le )
- « ELEVAGE EN RANCH ET REPRODUCTION EN CAPTIVITE », CITES
- « SWOT rapport »
- « Polycryptodira – recent cryptodires », sur Mikko's Phylogeny Archive (consulté le )
- Portail de l’herpétologie
- Portail de la biologie marine
.jpg.webp)