Triflate
L'ion triflate ou trifluorométhylsulfonate CF3SO3− est la base conjuguée de l'acide trifluorométhanesulfonique (acide triflique) CF3SO3H (abrégé TfOH), un superacide mille fois plus fort que l'acide sulfurique concentré. Ces deux espèces ont la faculté de résister aux réactions d'oxydo-réduction. L'anion triflate est un nucléophile très faible.
Sels
Triflate de cuivre(II)
Le triflate de cuivre(II) est un catalyseur de la condensation de Mannich[1]. Il peut aussi catalyser la réaction de Friedel-Crafts[2].
Triflate d'argent(I)
Le triflate d'argent trouve de nombreuses applications en synthèse organique. Comme catalyseur, il est très efficace pour la cyclopropanation d'alcynes internes [3], ou l'addition intramoléculaire d'un groupement alcool ou acide carboxylique à un alcène pour former des éthers cycliques ou des lactones[4]. Le triflate d'argent peut réagir avec la sym-collidine pour former le triflate d'argent bis(sym-collidine) qui, par réaction avec le dibrome, forme le triflate de bromonium bis(sym-collidine), un réactif qui permet d'ouvrir le 6-méthoxy-1-tétralol[5].
Triflate de gallium(III)
Le triflate de gallium, qui se prépare par réaction à reflux d'un excès d'acide triflique avec du gallium ou du chlorure de gallium, est un acide de Lewis stable dans l'eau. Ainsi il est possible de l'utiliser pour des réactions de chimie verte[6].
Triflates de diazonium
Les triflates d'arènediazonium sont des composés relativement stables. Ils peuvent ainsi remplacer perchlorates et tétrafluoroborates.
Liquides ioniques
Les liquides ioniques utilisant l'anion triflate ne sont pas hydrolysables contrairement aux anions tétrafluoroborates et hexafluorophophates. Ils ont ainsi trouvé de nombreuses applications en chimie[7].
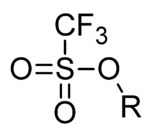
Esters trifliques
Les esters de l'acide triflique sont aussi appelés triflates (par exemple triflate de méthyle, CF3SO3CH3 ou triflate de triméthylsilyle, TMSOTf). La conversion d'un alcool en ester triflique se nomme triflation. Elle est utile en synthèse organique car le groupement fonctionnel triflate peut être considéré comme un pseudohalogène et, étant la base conjuguée de l'acide trifluorométhanesulfonique, un superacide, est une base très faible et constitue donc un excellent groupe partant, c'est-à-dire qu'il est substituable par un grand nombre d'autres groupes, contrairement aux fonctions ol ou one. En effet, Il est possible par exemple de convertir une cétone en triflate d'énol et d'utiliser ce dernier dans des réactions de couplage.
Formation
La réaction de triflation peut se faire en faisant réagir un alcoolate, phénolate ou énolate avec un donneur de triflyle tel que le phényltriflimide ou le réactif de Comins. Ces esters peuvent être aussi formés plus vigoureusement sur tout type d'alcools par réaction avec du chlorure de l'acide trifluorométhanesulfonique ou de l'anhydride triflique en présence d'une base comme la pyridine[8],[9] ou la triéthylamine.


Notes et références
- DOI:10.1021/ol200766t
Cette citation sera générée dans quelques minutes. Vous pouvez sauter la queue ou la compléter à la main. - DOI:10.1039/C1CC10263J
Cette citation sera générée dans quelques minutes. Vous pouvez sauter la queue ou la compléter à la main. - DOI:10.1021/ol201503j
Cette citation sera générée dans quelques minutes. Vous pouvez sauter la queue ou la compléter à la main. - DOI:10.1021/ol051065f
Cette citation sera générée dans quelques minutes. Vous pouvez sauter la queue ou la compléter à la main. - Guillaume Médard, (−)-Astrogorgiadiol: a shorter route to A-ring synthon, Tetrahedron, 2013, vol. 69 (10), p. 2348–2351.DOI:10.1016/j.tet.2012.12.087.
- (en) G. K. Surya Prakash, Thomas Mathew, George A. Olah, « Gallium(III) Triflate: An Efficient and a Sustainable Lewis Acid Catalyst for Organic Synthetic Transformations », Accounts of Chemical Research, vol. 45, no 4, , p. 565 (DOI 10.1021/ar2002039, lire en ligne, consulté le ).
- DOI:10.3390/molecules17055319
Cette citation sera générée dans quelques minutes. Vous pouvez sauter la queue ou la compléter à la main. - (en) PREPARATION OF n-BUTYL 4-CHLOROPHENYL SULFIDE, Organic Synthèses, 2002, 79, 43.
- (en) (R)-(+)- AND (S)-(−)-2,2'-BIS(DIPHENYLPHOSPHINO)-1,1'-BINAPHTHYL (BINAP), Organic Synthesis, 1999, 76, 6.
Voir aussi
Articles connexes
- Portail de la chimie