Uromoduline
L'uromoduline ou protéine de Tamm-Horsfall est une glycoprotéine produite exclusivement par le rein, c'est la protéine la plus abondante des urines[2]. Des mutations dans le gène UMOD causent des maladies rénales.
| Uromoduline | ||
| Caractéristiques générales | ||
|---|---|---|
| Nom approuvé | Uromoduline | |
| Symbole | UMOD | |
| Synonymes | Glycoprotéine urinaire de Tamm-Horsfall | |
| Homo sapiens | ||
| Locus | 16p12.3 | |
| Masse moléculaire | 69 761 Da[1] | |
| Nombre de résidus | 640 acides aminés[1] | |
| Entrez | 7369 | |
| HUGO | 12559 | |
| OMIM | 191845 | |
| UniProt | P07911 | |
| RefSeq (ARNm) | NM_001008389.2, NM_001278614.1, NM_003361.3 | |
| RefSeq (protéine) | NP_001008390.1, NP_001265543.1, NP_003352.2 | |
| Ensembl | ENSG00000169344 | |
|
GENATLAS • GeneTests • GoPubmed • HCOP • H-InvDB • Treefam • Vega | ||
| Liens accessibles depuis GeneCards et HUGO. | ||
Découverte
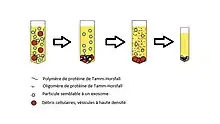
La protéine a été décrite en tant que « mucoprotéine urinaire » par Kah Morner[3] puis a été purifiée pour la première fois en 1952 par Igor Tamm et Frank Horsfall (en) dans l'urine d'individus en bonne santé (figure 1)[4]. L’uromoduline a ensuite été détecté dans l'urine de tous les placentas de mammifères étudiés[5].
Gène

Le gène UMOD humain est situé sur le chromosome 16 (figure 2). Bien que plusieurs variants de transcription puissent exister pour ce gène, les natures complètes de deux seulement ont été décrites à ce jour[6],[7]. Ces deux représentent les principales variantes de ce gène et codent la même isoforme[6],[7].
Protéine et structure 3D
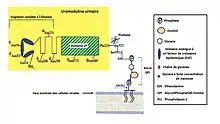
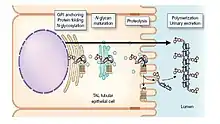

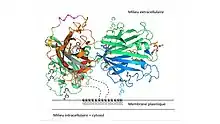
La séquence protéique (figure 3) contient un peptide signal N-terminal de 24 acides aminés, suivi de trois domaines analogues à un facteur de croissance épidermique (EGF pour Epidermal Growth Factor), un domaine zona pellucida (en) (ZP) et un site de fixation d'ancrage GPI[8]. Le peptide C-terminal d'origine intracellulaire est constitué d'acides aminés hydrophobes qui agissent comme un signal pour la ER-transpeptidase (ER pour Réticulum Endoplasmique)[8]. Après clivage du peptide hydrophobe par cette enzyme (ER-transpeptidase), une ancre GPI préformée est ajoutée à la « nouvelle » extrémité C-terminale[9]. Après une maturation supplémentaire dans l'appareil de Golgi, l'uromoduline est transportée vers la membrane plasmique apicale sous forme de polymères libérés dans la lumière (tubulaire) après clivage protéolytique (destruction des protéines en leurs éléments constitutifs, qui est assurée dans la cellule vivante par des enzymes dites protéolytiques ; en biochimie, la protéolyse est l'hydrolyse des protéines sous l'action des enzymes : la protéine se décompose en plusieurs morceaux) par une protéase inconnue (figure 4)[9]. Le clivage est nécessaire pour la polymérisation des monomères d'uromoduline dans la lumière tubulaire, processus probablement facilité par le domaine ZP[9].
L’uromoduline est synthétisée dans des cellules épithéliales tubulaires épaisses à membres ascendants (TAL). Il est inséré de manière co-traductionnelle dans le réticulum endoplasmique où ont lieu les ancrages GPI, la formation de ponts disulfures intramoléculaires (au sein de la THP) puis la N-glycosylation. Dans le Golgi, toutes les chaînes de glucoses attachées à la protéine de Tamm-Horsfall sont modifiées, à l'exception de celle d'une asparagine qui conserve un fragment à haute teneur en mannose. L’uromoduline atteint la membrane plasmique dans une conformation incompétente de polymérisation maintenue par l'interaction de deux motifs hydrophobes (rouge), l'un dans le domaine ZP et l'autre localisé entre le domaine ZP et le site d'ancrage GPI. Le clivage protéolytique par une protéase inconnue libère l'interaction hydrophobe, générant un monomère qui est assemblé en polymères[9].
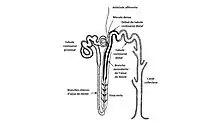
La THP est produite par la branche ascendante de l’anse de Henlé du rein de mammifère (figure 5)[10]. Alors que la molécule sous forme de monomère a un poids moléculaire (PM) d'environ 80 000 Daltons (Da), elle est physiologiquement présente dans l'urine en polymère pouvant atteindre 7 x 107 Da[10]. Lorsque cette protéine est concentrée à pH faible (pH inférieur au pH neutre ayant la valeur de 7,4), elle forme un gel[10]. L’uromoduline représente la protéine la plus abondante dans l'urine humaine normale (résultats basés sur les déterminations de spectrométrie de masse MS/MS)[10].
La structure tridimensionnelle de la protéine de Tamm-Horsfall (PDB: 4WRN) a été rapportée en janvier 2016. La protéine de Tamm-Horsfall a une densité électronique révélant un quatrième domaine de type EGF qui se situe avant le domaine ZP (figure 6)[11]. L'EGF IV consiste en une courte hélice alpha N-terminale et en un pont disulfure constitué d'un feuillet β antiparallèle (figure 7)[11].
Mode d'action et fonction
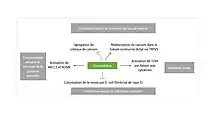
Sa fonction reste mal connue mais elle aurait potentiellement un rôle dans la régulation du sodium, un rôle protecteur dans les infections urinaires et les lithiases rénales[6],[12],[7]..
L'uromoduline peut agir comme un inhibiteur constitutif de la cristallisation du calcium dans les fluides rénaux[13]. L'excrétion de l'uromoduline dans l'urine peut constituer un moyen de défense contre les infections des voies urinaires causées par des bactéries uropathogènes[13].
Des études ont révélées que le THP peut jouer un rôle dans la physiologie règlementaire et participe effectivement à la fonction de transporteur[13]. Des études ont montré que Escherichia coli, qui exprime des pili sensibles au mannose, peut également être piégé par les chaînes latérales de la protéine de Tamm-Horsfall contenant du mannose[13]. La THP peut également jouer un rôle important dans la protection contre les lésions rénales par une régulation à la baisse de l'inflammation (figure 8)[13].
Structure et production
L'uromoduline est codée à partir du gène UMOD du chromosome 16. Elle est uniquement produite par le rein[6]. Elle est sécrétée par les tubules rénaux au niveau de l’anse de Henlé[14].
Catabolisme et élimination
Environ 80 mg d’uromoduline est éliminé par jour dans les urines.
Pathologies
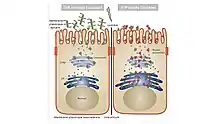
Une mutation du gène UMOD peut entraîner des pathologies comme la forme familiale de la néphropathie avec goutte précoce ou la maladie kystique médullaire rénale autosomique dominante[15].
L'uropontine, la néphrocalcine et l'uromoduline sont les trois glycoprotéines urinaires connues affectant la formation de calculs rénaux contenant du calcium. La diminution des taux de THP dans l'urine s'est révélée être un bon indicateur de calculs rénaux[16]. Les défauts de ce gène sont associés aux troubles rénaux autosomiques dominants de la néphropathie kystique rénale 2 (MCKD2) et de la néphropathie hyperurémique d'origine juvénile familiale (FJHN).
Ces troubles sont caractérisés par une hyperuricémie, une goutte et une insuffisance rénale progressive juvéniles[7].
Des anticorps contre la protéine de Tamm – Horsfall ont été observés dans diverses formes de néphrite (néphropathie balkanique, par exemple), mais il reste à déterminer si ces résultats présentent un intérêt physiopathologique[17]. Une autre maladie associée à des mutations dans ce gène est la "maladie rénale tubulo-interstitielle autosomique dominante"[13].
Dans le myélome multiple, le tubule contourné distal et le canal collecteur des reins contiennent souvent des protéines exprimées, constituées principalement de la chaîne légère de l'immunoglobuline, appelée protéine de Bence Jones, mais contenant également souvent la protéine de Tamm – Horsfall[18],[19].
Dans la MCKD2, la THP mutée s’accumule dans le réticulum endoplasmique rugueux (RER) et dans l’appareil de Golgi (figure 9)[13],[20].
Annexes
Notes et références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- Wai-Hoe Lau, Wing-Seng Leong, Zhari Ismail et Lay-Harn Gam, « Qualification and application of an ELISA for the determination of Tamm Horsfall Protein (THP) in human urine and its use for screening of Kidney Stone Disease », International Journal of Biological Sciences, vol. 4, no 4, , p. 215–222 (ISSN 1449-2288, PMID 18695745, PMCID 2500153, lire en ligne, consulté le )
- (de) MORNER KAH, « Untersuchungen uber die Proteinstoffe und die eiweissfallenden substanzen des normalen Meschenharns. », Skand Arch Physiol, vol. 6, , p. 332-337
- (en) TAMM I. et HORSFALL F.L., « A mucoprotein derived from human urine which reacts with influenza, mumps, and Newcastle disease viruses. », J Exp Med., vol. 1, , p. 71-97 (PMID 14907962, PMCID PMC2212053, DOI 10.1084/jem.95.1.71, lire en ligne)
- (en) WALLACE AC et NAIRN RC, « Tamm Horsfall protein in kidneys of human embryos and foreign species. », Pathology, vol. 3, no 4, , p. 303-310 (lire en ligne)
- (en) Olivier Devuyst, Eric Olinger et Luca Rampoldi, « Uromodulin: from physiology to rare and complex kidney disorders », Nature Reviews Nephrology, vol. 13, no 9, , p. 525–544 (ISSN 1759-507X, DOI 10.1038/nrneph.2017.101, lire en ligne, consulté le )
- (en) « UMOD uromodulin [ Homo sapiens (human) ] », sur www.ncbi.nlm.nih.gov, (consulté le )
- (en) Franca M. Iorember et V. Matti Vehaskari, « Uromodulin: old friend with new roles in health and disease. », Pediatr Nephrol., vol. 29, no 7, , p. 1151–1158 (PMID 23880785, DOI 10.1007/s00467-013-2563-z, lire en ligne)
- (en) Luca Rampoldi, Francesco Scolari, Antonio Amoroso, GianMarco Ghiggeri et Olivier Devuyst, « The rediscovery of uromodulin (Tamm–Horsfall protein): from tubulointerstitial nephropathy to chronic kidney disease. », Kidney International, vol. 80, no 4, , p. 338–347 (PMID 21654721, DOI 10.1038/ki.2011.134, lire en ligne)
- (en) Kumar S. et Muchmore A., « Tamm-Horsfall protein--uromodulin (1950-1990). », Kidney International, vol. 37, no 6, , p. 1395-1401 (PMID 2194064, lire en ligne)
- (en) Marcel Bokhove, Kaoru Nishimura, Martina Brunati, Ling Han, Daniele de Sanctis, Luca Rampoldi et Luca Jovine, « A structured interdomain linker directs self-polymerization of human uromodulin. », Proc. Natl. Acad. Sci. U.S.A., vol. 113, no 6, , p. 1552–1557 (PMID 26811476, PMCID PMC4760807, DOI 10.1073/pnas.1519803113, lire en ligne)
- (en) Jeanpierre C., Whitmore S.A., Austruy E., Cohen-Salmon M., Callen D.F. et Junien C., « Chromosomal assignment of the uromodulin gene (UMOD) to 16p13.11 », Cytogenet Cell Genet, vol. 62, no 4, , p. 185-187 (ISSN 1424-8581, PMID 8382593, DOI 10.1159/000133470, lire en ligne)
- (en) Olivier Devuyst, Eric Olinger et Luca Rampoldi, « Uromodulin: from physiology to rare and complex kidney disorders. », Nat Rev Nephrol, vol. 13, no 9, , p. 525-544 (PMID 28781372, DOI 10.1038/nrneph.2017.101, lire en ligne)
- (en) Arada Vinaiphat, Komgrid Charngkaew et Visith Thongboonkerd, « More complete polarization of renal tubular epithelial cells by artificial urine », Cell Death Discovery, vol. 4, no 1, , p. 1–14 (ISSN 2058-7716, DOI 10.1038/s41420-018-0112-z, lire en ligne, consulté le )
- (en) Genetics Home Reference, « Uromodulin-associated kidney disease », sur Genetics Home Reference (consulté le )
- (en) Lau WH, Leong WS, Ismail Z et Gam LH, « Qualification and application of an ELISA for the determination of Tamm Horsfall protein (THP) in human urine and its use for screening of kidney stone disease. », Int. J. Biol. Sci., vol. 4, no 4, , p. 215-222 (ISSN 1449-2288, PMID 18695745, PMCID 2500153, DOI 10.7150/ijbs.4.215, lire en ligne)
- (en) Vizjak A, Trnacević S, Ferluga D et Halilbasić A, « Renal function, proteinx ecretion, and pathology of Balkan endemic nephropathy. IV. Immunohistology. », Kidney Int. Suppl., vol. 34, , S68–S74 (PMID 1762338, lire en ligne)
- (en) Abbas AK, Gerber R, Mitchell RS, Kumar V et Fausto N, Pocket companion to Robbins and Cotran Pathologic Basis of Disease., Philadelphia, Elsevier, , p. 353
- (en) Aster JC, Robbins Basic Patholog, Philadelphia, Elsevier, (ISBN 1-4160-2973-7), The Hematopoietic and Lymphoid Systems (p. 455)
- (en) Hannah Loftus et Albert C. M. Ong, « Cystic kidney diseases: many ways to form a cyst. », Pediatr Nephrol, vol. 28, no 1, , p. 33–49 (PMID 22736301, PMCID PMC3505496, DOI 10.1007/s00467-012-2221-x, lire en ligne)
Articles connexes
Liens externes
- Ressource relative à la santé :
- Portail de la médecine
- Portail de la biochimie
- Portail de la chimie