Vinpocétine
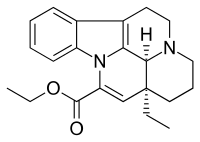
La vinpocétine (nom commercial : Cavinton, Intelectol ; nom chimique : apovincaminate d'éthyle) est un dérivé synthétique de la vincamine, un vinca-alcaloïde[4] extrait des feuilles de la petite pervenche. La vinpocétine est isolée de cette plante pour la première fois en 1975 par le chimiste hongrois Csaba Szántay. Sa production industrielle commence en 1978 par l'industrie pharmaceutique hongroise Gedeon Richter. La vinpocétine est un produit photosensible[3].
| Vinpocétine | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | ester éthylique de l'acide (3α,16α)-éburnamenine-14-carboxylique | |
| Synonymes |
(+)-cis-acide apovincaminoïque éthyle ester |
|
| No CAS | ||
| No ECHA | 100.050.917 | |
| No CE | 256-028-0 | |
| No RTECS | JW4792000 | |
| Code ATC | N06 | |
| PubChem | 443955 | |
| ChEBI | 71752 | |
| SMILES | ||
| InChI | ||
| Apparence | poudre cristalline blanche à jaune clair[1] | |
| Propriétés chimiques | ||
| Formule | C22H26N2O2 [Isomères] |
|
| Masse molaire[2] | 350,454 ± 0,020 4 g/mol C 75,4 %, H 7,48 %, N 7,99 %, O 9,13 %, |
|
| Propriétés physiques | ||
| T° fusion | 149-152 °C[1] | |
| Solubilité | pratiquement insol. dans l'eau, sol. dans le dichlorométhane, méthanol, chloroforme, acides minéraux et très soluble dans l'éthanol anhydre[1] 5 mg/mL DMSO[3] |
|
| Précautions | ||
| SGH[3] | ||
 |
||
| Écotoxicologie | ||
| DL50 | 503 mg/kg (rat, oral)[1] | |
| Données pharmacocinétiques | ||
| Biodisponibilité | 56,6 +/- 8,9% | |
| Métabolisme | hépatique | |
| Demi-vie d’élim. | 2,54 +/- 0.48 heures | |
| Excrétion | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
Elle est commercialisée comme complément alimentaire dans de nombreux produits. Alors qu'il n'existe pas de preuve scientifique de ces allégations, elle est vendue avec l'argument d'améliorer les performances cognitives et de réduire la graisse corporelle.
Tératogénicité
Des études chez l'animal ont montré qu'elle causait des pertes embryonnaires, des faibles poids des fœtus et des malformations congénitales graves, pour des concentrations sanguines proches de celles observées dans l'espèce humaine après ingestion de 10 mg[5].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Vinpocetine » (voir la liste des auteurs).
- [PDF] fiche Vinpocetine CRS chez EDQM, consulté le 30 avril 2009.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Vipocetine ≥98%, solid, consultée le 01/03/2017. + [PDF] Fiche MSDS
- Lörincz, Szász et Kisfaludy 1976, p. 1907.
- Vinpocétine : tératogène. Rev Prescrire 2020 ; 40 (436) : 110.
Bibliographie
- (en) Lörincz C, Szász K, Kisfaludy L, « The synthesis of ethyl apovincaminate », Arzneimittel-Forschung, vol. 26, no 10a, , p. 1907 (PMID 1037211)
- (en) Sazal Patyar, Ajay Prakash, Manish Modi et Bikash Medhi, « Role of vinpocetine in cerebrovascular diseases. », Pharmacological reports, vol. 63, no 3, , p. 618-628 (PMID 21857073, lire en ligne)
- Portail de la chimie
- Portail de la médecine
- Portail de la pharmacie