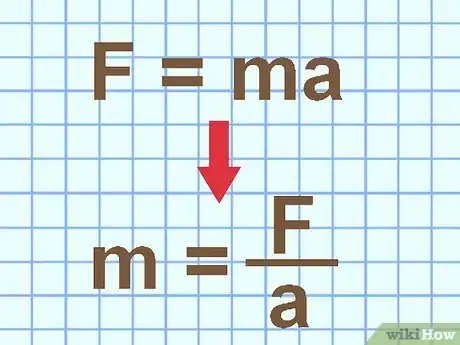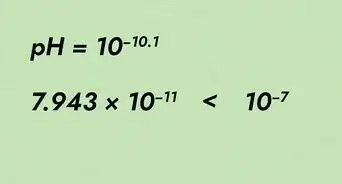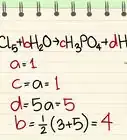wikiHow es un "wiki", lo que significa que muchos de nuestros artículos están escritos por varios autores. Para crear este artículo, 21 personas, algunas anónimas, han trabajado para editarlo y mejorarlo con el tiempo.
En este artículo, hay 10 referencias citadas, que se pueden ver en la parte inferior de la página.
Este artículo ha sido visto 1 067 353 veces.
La masa representa la cantidad de materia que se encuentra en algo. La materia es algo que puedes tocar físicamente. Generalmente, la masa se relaciona con el tamaño, aunque no siempre este es el caso. Por ejemplo, un globo podría ser más grande que algo más pero tener una menor mesa. En este artículo, verás algunas formas de medir la masa.
Pasos
Parte 1
Parte 1 de 3:Hallar la masa a partir de la densidad y el volumen
-
1Halla la densidad de un objeto. La densidad mide qué apretada que está la materia dentro un objeto. Cada material posee su propia densidad, la que puedes buscar en línea o en un libro de texto. La unidad científica de la densidad es el kilogramo por metro cúbico (kg/m3), pero también puedes utilizar el gramo por centímetro cúbico (g/cm3) para medir objetos más pequeños.
- Utiliza la siguiente fórmula para hacer la conversión entre estas unidades: 1000 kg/m3 = 1 g/cm3
- La densidad de los líquidos suele medirse en kilogramos por litro (kg/l) o gramos por mililitro (g/ml). Estas unidades son equivalentes: 1 kg/L = 1 g/ml.
- Ejemplo: el diamante tiene una densidad de 3,52 g/cm3.
-
2Mide el volumen del objeto. El volumen es la cantidad de espacio que ocupa el objeto. La unidad utilizada para medir el volumen de los sólidos es el metro cúbico (m3) el centímetro cúbico (cm3), mientas que para medir el volumen de los líquidos se emplea el litro (L) o el mililitro (ml). La fórmula para hallar el volumen dependerá de la forma que tiene el objeto. Consulta este artículo para conocer las formas comunes.
- Utiliza la misma unidad que aparece como parte de la medida de densidad.
- Ejemplo: como medimos la densidad del diamante en g/cm3, debemos medir su volumen en cm3. Supongamos que su volumen es 5000 cm3.
-
3Multiplica el volumen por la densidad. Multiplica ambos números y hallarás la masa del objeto.[1] Mientras lo haces, lleva un registro de las unidades y obtendrás una unidad de masa (kilogramos o gramos).
- Ejemplo: tenemos un diamante que tiene un volumen de 5000 cm3 y una densidad de 3,5 g/cm3. Para hallar su masa, multiplica 5000 cm3 x 3,5 g/cm3, lo que te dará como resultado 17,600 gramos.
Anuncio
Parte 2
Parte 2 de 3:Hallar la masa en otros problemas de ciencia
-
1Determina la masa utilizando la fuerza y la aceleración. La segunda ley del movimiento de Newton indica que una fuerza es igual a la masa por aceleración: F = ma. Si conoces la fuerza neta y aceleración del objeto, puedes reacomodar esta fórmula para hallar su masa: m = F / a.
- La fuerza se mide en N (newton), lo que también puedes escribir como (kg * m)/ s2. La aceleración se mide en m/s2. Cuando calculas F / a, las unidades se cancelan para darte una respuesta en kilogramos (kg).[2]
-
2Entiende la masa y el peso. La masa es la cantidad de materia en un objeto y no cambia a menos que cortes parte de este o agregues más material. El peso es una medida del efecto que tiene la gravedad sobre la masa. Si mueves el objeto hacia un área con una gravedad diferente (como por ejemplo de la Tierra a la Luna), su peso cambiará, pero no la masa.[3] [4]
- Bajo la misma gravedad, un objeto con mayor masa pesa más que uno con menos.
-
3Calcula la masa molar. Si estás haciendo una tarea de química, podrías toparte con el término “masa molar”. Este es un concepto relacionado, pero en lugar de medir un objeto, mides exactamente un mol de una sustancia. A continuación, verás cómo calcularla en la mayoría de los contextos:[5]
- En el caso de un elemento: halla la masa atómica del elemento o compuesto que mides. Para representarla, deberás utilizar “unidades de masa atómica”. Luego multiplica el resultado por la constante de masa molar, 1 g/mol, para expresarlo en unidades de masa molar estándares: g/mol.
- En el caso de un compuesto: suma las masas atómicas de cada átomo en el compuesto para hallar la unidad de masa atómica total de la molécula. Multiplica este resultado por 1 g/mol.
Anuncio
Parte 3
Parte 3 de 3:Medir la masa con una balanza
-
1Utiliza una balanza de triple barra. La balanza es un dispositivo que se emplea ampliamente para calcular la masa de un objeto. Esta balanza posee tres barras, las cuales llevan pesas.[6] Estas pesas te permiten mover las masas conocidas a lo largo de las barras.[7]
- La gravedad no afecta a este tipo de balanza. Por ende, con ella podrás obtener la medida de masa real. Su función es comparar una masa conocida con una desconocida.
- La barra central de la balanza se lee en incrementos de 100 g mientras que la más lejana se lee en incrementos de 10 g. Las pesas se ubican en una muesca; la delantera se puede leer de 0 a 10 g.
- Con esta balanza, podrás obtener una medida muy precisa de la masa. El nivel de error de esta balanza es de solo 0,06 g. Considera su funcionamiento como si se tratara de un subibaja.[8]
-
2Mueve los tres deslizadores hacia el extremo izquierdo. Hazlo mientras la bandeja está vacía para hacer que la balanza tenga una lectura de cero.
- Si el indicador ubicado en el extremo derecho no está alineado con la marca fija, deberás calibrar la balanza girando el tornillo ubicado a la izquierda, debajo de la bandeja.
- La razón de esto es para asegurarte de que la bandeja vacía brinde una lectura de 0,000 g de modo que su peso no afecte la lectura que obtengas de la masa. El peso del recipiente o la bandeja se conoce como tara.
- También puedes ajustar o aflojar la bandeja a cero al atornillar la perilla debajo de ella. Una vez más, la balanza debe dar una lectura de cero. A continuación, coloca el objeto que medirás sobre la bandeja. Ahora estarás listo para determinar la masa del objeto utilizando las barras deslizantes.
-
3Mueve una barra deslizante a la vez. En primer lugar, mueve la barra deslizante de 100 g hacia la derecha. Hazlo hasta que el indicador caiga por debajo de la marca fija. La posición que está a la izquierda de este punto indica la cantidad de cientos de gramos. Deberás deslizarla una muesca a la vez.
- Mueve la barra deslizante de 10 g hacia la derecha. Hazlo hasta que el indicador caiga por debajo de la marca fija. La posición dentada que se encuentra inmediatamente a la izquierda de este punto indica la cantidad de decenas de gramos.
- La barra delantera no tiene muescas. Puedes moverla a cualquier parte que quieras. Los números en negrita que tiene son medidas en gramos. Las marcas de graduación ubicadas entre los números en negrita indican las décimas de gramos.
-
4Calcula la masa. Ahora estás listo para hallar la masa del objeto que colocaste en la bandeja. Para hacerlo, debes sumar los números provenientes de las tres barras.
- Lee la escala delantera tal como lo harías con una regla. Puedes leerla en dirección hacia la marca de graduación más cercana.
- Por ejemplo, supongamos que quieres medir una lata de refresco. Si el peso posterior está en la muesca que da una medida de 70 g, si el peso promedio se encuentra en la muesca que da una lectura de 300 g y si el peso de la barra delantera es de 3,34 g, entonces la lata mide 373,34 g.
Anuncio
Consejos
Advertencias
- no utilices libras u onzas para medir la masa, pues estas son unidades de peso y no se utilizan en contextos científicos. Técnicamente, en los Estados Unidos, la medida de masa se conoce como “slug”.[11]
Referencias
- ↑ http://socratic.org/questions/how-do-you-calculate-mass-using-density-and-volume
- ↑ https://www.easycalculation.com/physics/classical-physics/force.php
- ↑ https://www.nyu.edu/pages/mathmol/textbook/weightvmass.html
- ↑ http://www.engineeringtoolbox.com/mass-weight-d_589.html
- ↑ https://www.boundless.com/chemistry/textbooks/boundless-chemistry-textbook/mass-relationships-and-chemical-equations-3/molar-mass-41/molar-mass-of-compounds-223-7524/
- ↑ http://genchem.rutgers.edu/balance3b.html
- ↑ http://www.edinformatics.com/math_science/mass.htm
- ↑ https://www.physics.smu.edu/~scalise/apparatus/triplebeam/
- ↑ http://www.calculatorsoup.com/calculators/physics/density.php