Este artículo fue coescrito por Bess Ruff, MA. Bess Ruff es estudiante de doctorado en Geografía en la niversidad de Florida State. Recibió su maestría en Ciencias y Gestión Ambiental en la Universidad de California, Santa Bárbara en 2016. Ha realizado trabajos de encuestas para proyectos de planificación de espacio marino en el Caribe y ha brindado apoyo de investigación como becaria de posgrado del Sustainable Fisheries Group.
Este artículo ha sido visto 821 426 veces.
El mol es la unidad estándar de medición en química y esta unidad toma en cuenta los diferentes elementos presentes en un compuesto químico. A menudo, la cantidad de compuestos se indica en gramos y debe ser convertida a moles. This conversion can help give you a clearer picture of the number of molecules you're working with rather than dealing with weight, which can change between molecules. Aunque la conversión es simple, existen un par de pasos muy importantes que debes seguir. Usando este método, aprenderás a convertir de gramos a moles.
Pasos
Parte 1
Parte 1 de 2:Calcular la masa molecular
-
1Reúne las herramientas necesarias para resolver un problema de química. Tener todo lo que necesitas al alcance de tu mano simplificará el proceso de resolver el problema asignado. Necesitas lo siguiente:
- Un lápiz y papel. Los cálculos son más fáciles de resolver cuando están escritos. Asegúrate de escribir todos los pasos para obtener una buena calificación.
- Una tabla periódica. Necesitas poder encontrar el peso atómico de los elementos usando la tabla periódica.
- Una calculadora. Las calculadoras son necesarias para simplificar los cálculos de números complejos.
-
2Identifica los elementos en el compuesto que necesitas convertir a moles. El primero paso para calcular la masa molecular es identificar cada elemento que forma el componente. Es muy fácil distinguir los elementos ya que las abreviaciones contienen solo una o dos letras.
- Si un compuesto está abreviado en dos letras, la primera estará en mayúscula y la segunda en minúscula. Por ejemplo, "Mg" es la abreviación de "magnesio".
- El compuesto NaHCO3 está formado por cuatro elementos: sodio (Na), hidrógeno (H), carbono (C) y oxígeno (O).
-
3Determina el número de átomos que cada elemento contribuye al compuesto. Debes saber cuántos átomos de cada elemento están presentes para calcular la masa molecular.[1] El número de los átomos de cada elemento están escritos de subíndice a lado de dicho elemento.
- Por ejemplo, H2O tiene dos átomos de hidrógeno y un átomo de oxígeno.
- Si un compuesto tiene un paréntesis seguido de un subíndice, cada elemento dentro de ese paréntesis se multiplica por el número en el subíndice. Por ejemplo, (NH4)2S tiene dos átomos de "N", ocho átomos de "H" y un átomo de "S".
-
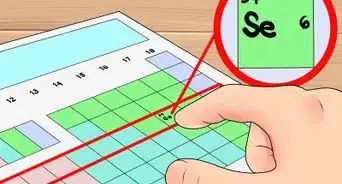
4Escribe el peso atómico de cada elemento. Una tabla periódica es la forma más sencilla de encontrar el peso atómico de un elemento. Una vez que ubiques el elemento en la tabla, el peso atómico generalmente se encontrará debajo del símbolo de ese elemento.
- El peso atómico, la masa o un elemento se brindarán en unidades de masa atómica (uma).[2]
- Por ejemplo, el peso molecular de oxígeno es 15,99.
-
5Calcula la masa molecular. La masa molecular de una sustancia se calcula como el número de átomos de cada elemento multiplicado por el peso atómico de ese elemento.[3] Saber la masa molecular es necesaria para convertir gramos a moles.
- Multiplica el número de átomos de cada elemento contribuye al compuesto por el peso atómico de ese elemento.
- Suma el peso total de cada elemento en el compuesto.
- Por ejemplo, (NH4)2S tiene un peso molecular de (2 x 14,01) + (8 x 1,01) + (1 x 32,07) = 68,17 g/mol.
- A la masa molecular también se le conoce como la masa molar.[4]
Anuncio
Parte 2
Parte 2 de 2:Convertir de gramos a moles
-
1Establece la fórmula de conversión. El número de moles tiene un compuesto que puede calcularse al dividir el número de gramos del compuesto por la masa molecular del compuesto.[5]
- La fórmula luce de la siguiente manera: moles = gramos del compuesto/masa molecular del compuesto.
-
2Introduce los números en la fórmula. Una vez que tengas la fórmula, el siguiente paso es escribir tus cálculos en la parte correcta de la fórmula. Una forma sencilla para revisar que todo esté en orden es por las unidades. Cancelar las unidades debe dejarte solamente con moles.
-
3Resuelve la ecuación. Usando una calculadora, divide el número de gramos por la masa molecular. El resultado es el número de moles en el elemento o en el compuesto.
- Por ejemplo, imagina que tienes 2 gramos de (NH4)2S y quieres convertirlos a moles. La masa molecular de (NH4)2S es 68,17g/mol. Divide 2 entre 68,17 y obtendrás 0,0293 moles de (NH4)2S.
Anuncio
Consejos
- Siempre incluye el nombre del elemento o del compuesto en tu respuesta.
- Si te piden mostrar tu trabajo en una tarea de química o en algún examen, asegúrate de identificar tu respuesta claramente encerrándola en un círculo o en un cuadrado.
Cosas que necesitarás
- tabla periódica
- lápiz
- papel
- calculadora
- problema de química