Este artículo fue coescrito por Bess Ruff, MA. Bess Ruff es estudiante de doctorado en Geografía en la niversidad de Florida State. Recibió su maestría en Ciencias y Gestión Ambiental en la Universidad de California, Santa Bárbara en 2016. Ha realizado trabajos de encuestas para proyectos de planificación de espacio marino en el Caribe y ha brindado apoyo de investigación como becaria de posgrado del Sustainable Fisheries Group.
Este artículo ha sido visto 473 037 veces.
A pesar de que todos los átomos del mismo elemento contienen el mismo número de protones, su número de neutrones puede variar. Conocer el número de neutrones en un átomo podrá ayudarte a determinar si es un átomo normal de dicho elemento o un isótopo, el cual tendrá neutrones adicionales o una menor cantidad de ellos.[1] Identificar el número de neutrones en un átomo es muy sencillo y ni siquiera requiere experimentación alguna. Para calcular la cantidad de neutrones en un átomo normal o un isótopo, todo lo que tendrás que hacer es seguir estas instrucciones con una tabla periódica a la mano.
Pasos
Método 1
Método 1 de 2:Encontrar el número de neutrones en un átomo normal
-
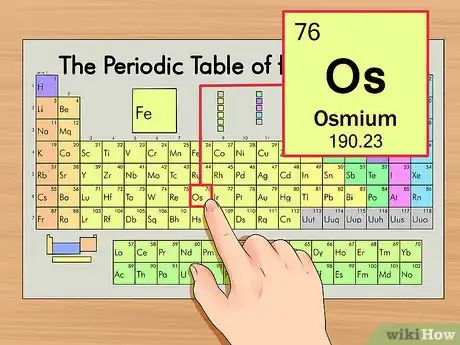
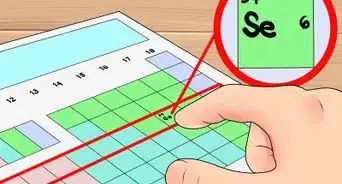
1Localiza el elemento en la tabla periódica. Para este ejemplo, se usará el osmio (Os), que está en la sexta fila de abajo.
-
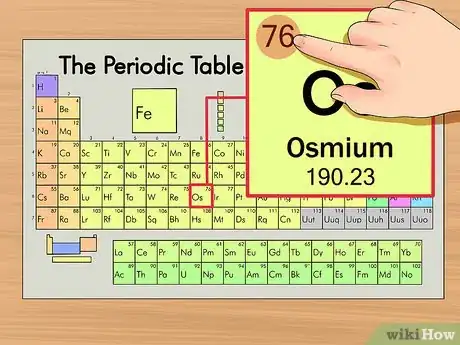
2Encuentra el número atómico del elemento. Tiende a ser el número más visible perteneciente a un elemento dado y suele encontrarse encima del símbolo del elemento. En la tabla de ejemplo, de hecho, no hay más números listados. El número atómico es el número de protones de un solo átomo de ese elemento. Os es el número 76, lo que significa que un átomo de osmio tiene 76 protones.
- El número de protones nunca cambia en un elemento; esto es básicamente lo que lo vuelve dicho elemento.[2]
-
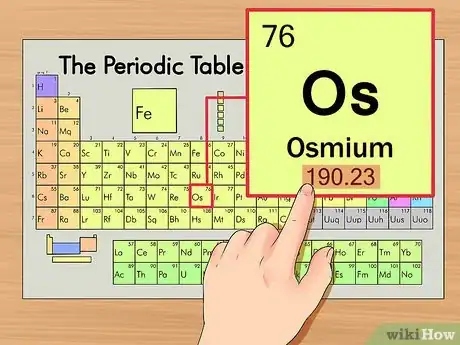
3Encuentra el peso atómico. Este número suele encontrarse debajo del símbolo atómico. Ten en cuenta que la gráfica de ejemplo se basa únicamente en el número atómico y que no muestra el peso atómico. Pero no será siempre el caso. El osmio tiene un peso atómico de 190,23.
-
4Redondea el peso atómico al número entero más próximo para encontrar la masa atómica. En este ejemplo, 190,23 se redondea a 190, lo que resulta un peso atómico de 190 para el osmio.
- El peso atómico es un promedio de los isótopos del elemento, por lo cual no suele ser un número entero.
-
5Resta el número atómico de la masa atómica. Ya que la gran mayoría de la masa atómica se encuentra en los protones y neutrones, restar el número de protones (por ejemplo el número atómico) de la masa atómica dará el valor calculado del número de neutrones en el átomo. Los números después de la coma decimal representan la normalmente muy pequeña masa de electrones en el átomo. En el ejemplo, esto es: 190 (peso atómico) – 76 (número de protones) = 114 (número de neutrones).
-
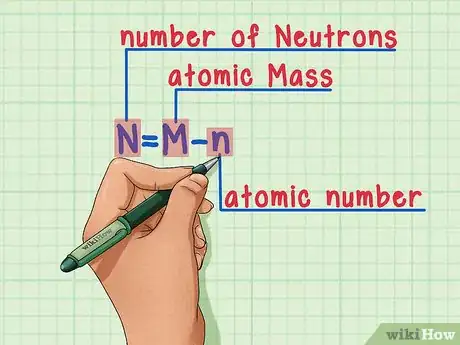
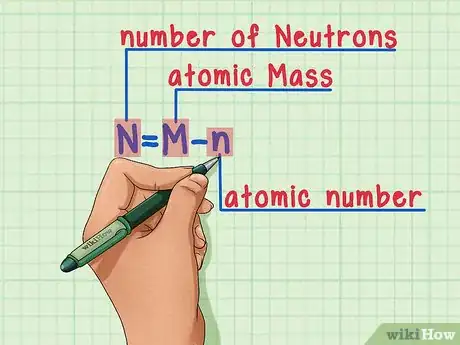
6Recuerda la fórmula. Para encontrar el número de neutrones en un futuro, simplemente usa esta fórmula:
-
N = M – n
- N = número de Neutrones
- M = Masa atómica
- n = número atómico
-
N = M – n
Método 2
Método 2 de 2:Encontrar el número de neutrones en un isótopo
-
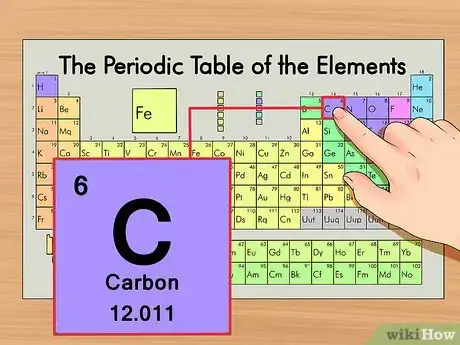
1Localiza el elemento en la tabla periódica. Como ejemplo, se tomará el isótopo del carbono-14. Ya que la forma no isotópica del carbono-14 es simplemente carbono (C), encontrarás el carbono en la tabla periódica en la segunda columna de abajo.
-
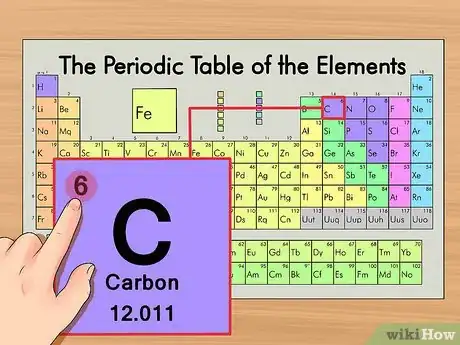
2Encuentra el número atómico del elemento. Suele ser el número más visible perteneciente a un elemento dado y suele encontrarse encima del símbolo del elemento. En la tabla de ejemplo, de hecho, no hay más números listados. El número atómico es el número de protones de un solo átomo de ese elemento. C es el número 6, lo que significa que un átomo de carbono tiene 6 protones.
-
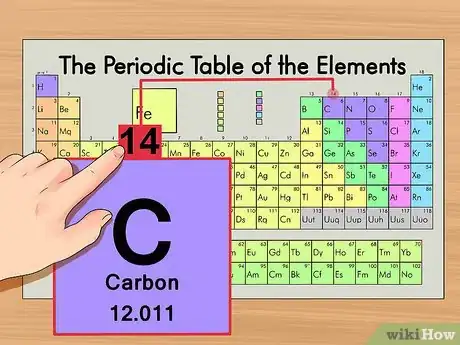
3Encuentra la masa atómica. Es realmente fácil con los isótopos, ya que se les da el nombre de acuerdo a su masa atómica. Por ejemplo, el carbono-14 tiene una masa atómica de 14. Una vez encuentras la masa atómica del isótopo, el proceso es el mismo que el seguido para encontrar los neutrones en un átomo normal.
-
4Resta el número atómico de la masa atómica. Ya que la gran mayoría de la mase atómica se encuentra en los protones y neutrones, restar el número de protones (por ejemplo el número atómico) de la masa atómica dará el valor calculado del número de neutrones en el átomo. En el ejemplo, esto es: 14 (peso atómico) – 6 (número de protones) = 8 (número de neutrones).
-
5Recuerda la fórmula. Para encontrar el número de neutrones en el futuro, simplemente utiliza esta fórmula:
-
N = M – n
- N = número de Neutrones
- M = Masa atómica
- n = número atómico
-
N = M – n
Consejos
- El nombre del osmio, un metal que es sólido a temperatura ambiente, deriva de la palabra griega para olor, "osme".
- Los protones y neutrones forman casi todo el peso de los elementos mientras que los electrones y otras partículas varias representan una parte casi nula de su masa (prácticamente cero masa). Ya que un protón tiene aproximadamente el mismo peso que un neutrón y el número atómico representa el número de protones, puede simplemente restarse el número de protones de la masa total.
- Si no estás seguro de qué número es cada uno en la tabla periódica, simplemente recuerda que la tabla está diseñada en base al número atómico (por ejemplo, el número de protones), empieza con el 1 (hidrógeno) y añade una unidad cada vez de izquierda a derecha, terminando con el 118 (ununoctio). Esto es porque el número de protones en un átomo determina qué es ese átomo, haciéndolo el rasgo elemental más fácil de organizar. Por ejemplo, un átomo con 2 protones siempre será helio, al igual que un átomo con 79 protones siempre será oro.