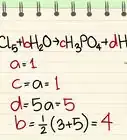Este artículo fue coescrito por Meredith Juncker, PhD. Meredith Juncker es candidata a un PhD en Bioquímica y Biología Molecular en el Centro de Ciencias de la Salud de la Universidad Estatal de Louisiana. Sus estudios se centran en proteínas y enfermedades neurodegenerativas.
Este artículo ha sido visto 131 297 veces.
La masa atómica promedio no es una medida directa de un solo átomo. Se trata de una masa promedio por átomo de una muestra típica de un elemento dado. Si pudieras medir la masa de miles de millones de átomos en forma individual, podrías calcular este valor de la misma forma en que calcularías cualquier promedio. Afortunadamente, existe una forma más práctica que utiliza la información registrada sobre la rareza de los distintos isótopos.
Pasos
Parte 1
Parte 1 de 2:Calcular la masa atómica promedio
-
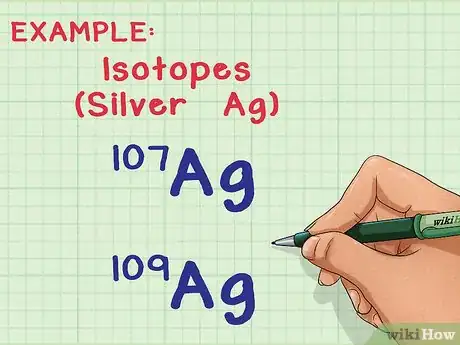
1Comprende qué son los isótopos y sus masas atómicas. La mayoría de los elementos se presentan en la naturaleza en distintas formas o "isótopos". El número de masa de cada isótopo es la suma de números de protones y neutrones del núcleo. Cada protón y cada neutrón pesa 1 unidad de masa atómica (uma).[1] La única diferencia entre dos isótopos de un mismo elemento es la cantidad de neutrones por átomo, lo cual afecta su masa atómica.[2] No obstante, un elemento siempre tiene la misma cantidad de protones.
- La masa atómica promedio del elemento toma en consideración las variaciones del número de neutrones y te indica la masa promedio por átomo en una muestra típica de ese elemento.
- Por ejemplo, el elemento "plata" (Ag) tiene dos isótopos que se presentan en la naturaleza: Ag-107 y Ag-109 (o 107Ag y 109Ag).[3] Los nombres de los isótopos guardan relación con el "número de masa" o la suma de protones y neutrones del átomo.[4] Esto significa que la Ag-109 tiene dos neutrones más por átomo que la Ag-107, los cuales le proporcionan más masa.
-
2Averigua la masa de cada isótopo. Necesitarás dos datos por cada isótopo, que puedes averiguarlos en un libro de química o en una página web, por ejemplo, webelements.com. El primero es la masa atómica o masa de un átomo de cada isótopo. Los isótopos con más neutrones tienen más masa.
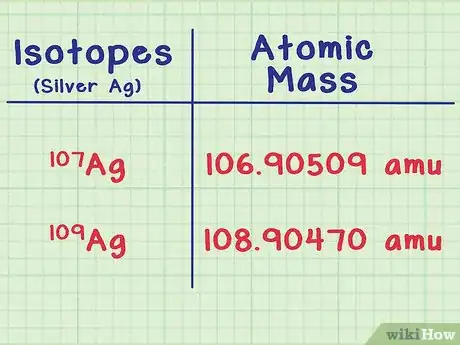
- Por ejemplo, el isótopo de plata Ag-107 tiene una masa atómica de 106,90509 uma (unidades de masa atómica). El isótopo Ag-109 es levemente más pesado, con una masa de 108,90470.
- Los últimos decimales pueden variar levemente según la fuente. No pongas ningún número entre paréntesis después de la masa.
-
3Toma nota de la abundancia de cada isótopo. La abundancia te indica qué tan común es un isótopo, expresada como porcentaje de todos los átomos del elemento. Cada isótopo contribuye en forma proporcional a su abundancia (mientras más abundante sea el isótopo, más contribuirá a la masa promedio). Este dato se puede obtener en la misma fuente donde encontraste la masa. La abundancia de todos los isótopos debe sumar alrededor de 100 % (aunque puede no ser exacta debido a errores de redondeo).
- El isótopo Ag-107 tiene una abundancia de 51,86 %. Ag-109 es un poco menos común, con una abundancia de 48,14 %. Esto significa que una muestra típica de plata está formada por un 51,86 % de Ag-107 y 48,14 % de Ag-109.
- Ignora todos los isótopos para los cuales no se indique la abundancia. Esos isótopos no se presentan en forma natural en la Tierra.
-
4Convierte los porcentajes de abundancia en decimales. Divide el porcentaje de abundancia por 100 para obtener el mismo valor pero en forma decimal.
- En el problema de ejemplo, las cifras de abundancia son 51,86 / 100 = 0,5186 y 48,14 / 100 = 0,4814.
-
5Averigua el promedio ponderado de masa atómica de los isótopos estables. La masa atómica promedio de un elemento con n isótopos es igual a (masaisótopo 1 * abundanciaisótopo 1) + (masaisótopo 2 * abundanciaisótopo 2) + ... + (masaisótopo n * abundanciaisótopo n.[5] . Este es un ejemplo de "promedio ponderado". Esto significa que las más comunes (más abundantes) tienen mayor incidencia en el resultado. A continuación verás cómo usar esta fórmula para la plata:
- Masa atómica promedio Ag = (masaAg-107 * abundanciaAg-107) + (masaAg-109 * abundanciaAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
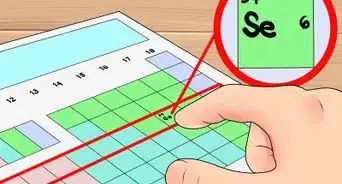
= 107,8677 uma. - Busca el elemento en la tabla periódica para revisar tu respuesta. La masa atómica promedio generalmente se escribe debajo del símbolo del elemento.[6]
Anuncio - Masa atómica promedio Ag = (masaAg-107 * abundanciaAg-107) + (masaAg-109 * abundanciaAg-109)
Parte 2
Parte 2 de 2:Utilizar el resultado
-
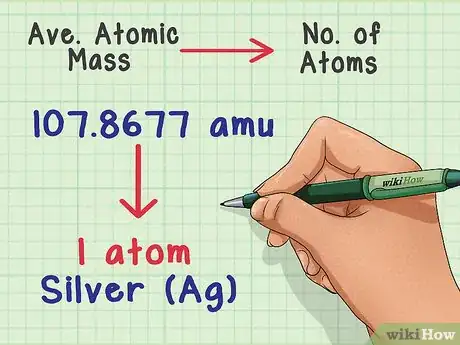
1Convierte la masa en cantidad de átomos. La masa atómica promedio te indica la relación entre la masa y la cantidad de átomos que hay en una muestra típica del elemento. Esto es útil en laboratorios químicos debido a que es casi imposible contar directamente la cantidad de átomos, pero medir masa es fácil. Por ejemplo, puedes pesar una muestra de plata y decir que 107,8677 uma de masa contiene un átomo de plata.
-
2Convierte a masa molar. Las unidades de masa atómica son muy pequeñas, por lo que los químicos normalmente pesan muestras en gramos. Afortunadamente, estos conceptos se encuentran bien definidos para que hacer conversiones sea lo más fácil posible. Simplemente multiplica el promedio de la masa atómica por 1 g/mol (constante de masa molar) para obtener una respuesta en g/mol. Por ejemplo, 107,8677 gramos de plata contienen en promedio un mol de átomos de plata.
-
3Busca el promedio de la masa molecular. Como una molécula es simplemente un conjunto de átomos, puedes obtener la masa de la molécula sumando las masas de los átomos. Si usas las masas atómicas promedio (en lugar de la masa de un isótopo específico), la respuesta será la masa promedio de la molécula de una muestra que se presenta en forma natural. Aquí tienes un ejemplo:
- La fórmula química de una molécula de agua H2O. Esto significa que tiene dos átomos de hidrógeno (H) y uno de oxígeno (O).
- El hidrógeno tiene una masa atómica promedio de 1,00794 uma. Los átomos de oxígeno tienen una masa promedio de 15,9994 uma.
- La masa promedio de una molécula de H2O es igual a (1,00794)(2) + 15,9994 = 18,01528 uma, lo que equivale a 18,01528 g/mol.
Anuncio
Consejos
- El término "masa atómica relativa" a menudo se usa como sinónimo de masa atómica promedio. Existe una pequeña diferencia entre estos conceptos, ya que la masa atómica relativa no tiene unidades. Es una medida de masa en relación al átomo de carbono 12. No obstante, siempre y cuando uses unidades de masa atómica en el cálculo de masa promedio, estos dos valores serán idénticos en términos numéricos.
- Salvo unas pocas excepciones, los elementos que aparecen después en la tabla periódica tienen una masa promedio más alto que los que aparecen antes. Este dato te permite verificar rápidamente si tu respuesta tiene sentido.
- 1 unidad de masa atómica se define como 1/12 masa de un átomo de carbono 12.
- Utiliza la masa atómica promedio para hacer cálculos de masa que involucren elementos y compuestos.[7]
- El número que va entre paréntesis después de la masa atómica indica la incertidumbre del último dígito.[8] Por ejemplo, si la masa atómica es 1,0173 (4) significa que las muestras típicas varían dentro de un intervalo de 1,0173 ± 0,0004. No es necesario tener esto en cuenta, a menos que el problema lo indique expresamente.
- La abundancia de un isótopo se basa en las muestras que se presentan en forma natural en la Tierra. Hay sustancias poco usuales como los meteoritos o muestras creadas en laboratorios que pueden tener distintas proporciones de isótopos y, por lo tanto, su masa atómica promedio puede variar.
Advertencias
- Las masas atómicas se escriben casi siempre en términos de unidades de masa atómica (uma o u), a veces también se conocen como dalton (Da). Nunca agregues otras unidades de masa (por ejemplo, kilogramos) después del número sin antes convertirlo.
Cosas que necesitarás
- lápiz
- papel
- calculadora
- información sobre la abundancia del isótopo
- información sobre la unidad de masa atómica
Referencias
- ↑ https://courses.lumenlearning.com/boundless-chemistry/chapter/atomic-mass/
- ↑ http://genesismission.jpl.nasa.gov/educate/scimodule/UnderElem/UnderElem_pdf/TeachText.pdf
- ↑ https://www.webelements.com/silver/
- ↑ http://hyperphysics.phy-astr.gsu.edu/hbase/Nuclear/nucnot.html
- ↑ https://www.youtube.com/watch?v=xirPkCI1sMA
- ↑ https://www.youtube.com/watch?v=xirPkCI1sMA
- ↑ https://courses.lumenlearning.com/boundless-chemistry/chapter/atomic-mass/
- ↑ http://www.chem.qmul.ac.uk/iupac/AtWt/