Nuestro equipo de editores e investigadores capacitados han sido autores de este artículo y lo han validado por su precisión y amplitud.
wikiHow's Content Management Team revisa cuidadosamente el trabajo de nuestro personal editorial para asegurar que cada artículo cumpla con nuestros altos estándares de calidad.
Este artículo ha sido visto 80 587 veces.
Aunque se puede hacer que cualquier masa de agua se eleve añadiéndole más masa a la misma (por ejemplo, más agua u otro material), existe un experimento común diseñado para hacer que el agua "suba" en un vaso. Cuando se habla de hacer subir el agua se suele hacer referencia a este experimento. Con solo unos pocos elementos, puedes utilizar los principios de la ley de Charles para impresionar e intrigar a una audiencia con este experimento.
Pasos
Método 1
Método 1 de 3:Preparar el experimento
-
1Llena una cacerola con agua. El recipiente debe tener 2,5 o 5 cm (1 o 2 pulgadas) de profundidad por lo menos. Necesitas un molde que pueda contener suficiente agua para que el vaso no la absorba por completo. Si el vaso absorbe toda el agua, entonces el aire podrá entrar. Debido a que el agua es más pesada que el aire, caerá fuera del vaso debido a la gravedad.[1]
-
2Añade colorantes al agua. Este es un paso opcional. El colorante de alimentos no afecta en absoluto la ciencia detrás del experimento. Hace que el agua sea más fácil de ver a medida que sube hacia el vaso. Esto es muy importante para una audiencia grande que no será capaz de acercarse al vaso.[2]
-
3Reúne todos los demás materiales. Asegúrate de tener un vaso, una vela y un encendedor o fósforo antes de comenzar. No importa qué tipo de fósforo o encendedor quieres utilizar. Debes usar un vaso de cristal y no uno de plástico. Usar una vela pequeña también evita que la llama toque el vaso. directamente.
- Si sustituyes un vaso de cristal por uno de plástico, se derretirá y el experimento fracasará.
- Las velas de mesa funcionan bien en este experimento.
Método 2
Método 2 de 3:Hacer que el agua suba hacia el vaso
-
1Coloca la vela en la cacerola de agua. Asegúrate de no mojar la mecha de la vela. Enciende la vela en el centro de la cacerola con agua.[3]
- Si utilizas una vela de mesa, se quedará parada en la cacerola sin apoyo alguno. Una vela alta y delgada podría volcarse. Para evitarlo, utiliza una base pequeña para estabilizarla.
-
2Coloca el vaso sobre la vela. Voltea el vaso boca abajo y ponlo sobre la vela. Asegúrate de que la abertura del vaso esté totalmente sumergida en el agua. Esto forma un sello que evita que el aire entre en el vaso y permite que el agua suba a través del él.[4]
- Si la vela choca con el vaso, puedes conseguir otra vela más corta o un vaso más alto. Esto te asegurará el éxito del experimento.
-
3Ten cuidado con las burbujas. A medida que la vela se quema, calentará el gas al interior del vaso. Esto hará que el gas se expanda, aumentando la presión al interior del vaso. Un poco de gas tendrá que escapar del vaso para aliviar la presión. La única manera en la que el gas podría escapar es a través del agua en la parte inferior del vaso. Una vez que la presión se haya elevado lo suficiente, el gas no tendrá otra opción que burbujear a través del agua.[5]
-
4Deja que la vela se consuma. La vela encendida convierte dos moléculas de oxígeno (2O2) y una molécula de cera de parafina (CH4) en una molécula de dióxido de carbono (CO2) y dos moléculas de agua (2H2O). Si no entra aire en el vaso, la vela quemará todo el oxígeno disponible. Cuando el oxígeno se agote, el fuego en la vela ya no podrá arder.[6]
- Aunque podría haber oxígeno restante en el vaso, la vela se apagará cuando se haya consumido el oxígeno suficiente para alimentar la llama.
-
5Mira cómo sube el agua hacia el vaso. Cuando la vela se consuma por completo, el gas restante se enfriará rápidamente. El gas frío se contrae (reduce su volumen) y crea un vacío en el vaso. La presión exterior forzará al agua a ir hacia el vaso para llenar el vacío. Esto será más fácil de ver si le agregaste colorante de alimentos al agua. Ten en cuenta que el agua solo llenará parte del vaso, puesto que todavía habrá un poco de gas atrapado en el agua.[7]
Método 3
Método 3 de 3:Entender por qué el agua sube hacia el vaso
-
1Aprende sobre la reacción química que ocurre. Existen muchas explicaciones incorrectas para este experimento. Para entender lo que realmente pasa, debes saber lo que está detrás del experimento. La reacción de combustión que se produce es la siguiente:[8]
- 2O2 + CH4 → CO2 + 2H2O
-
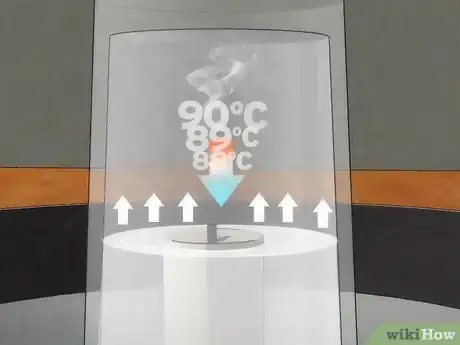
2Recuerda la ley de Charles. La ley de Charles es una ley de los gases que dice que el volumen de un gas cambiará proporcionalmente con la temperatura (y viceversa) cuando la presión exterior y la masa del gas permanezcan constantes. Debido a que las paredes del vaso no cambian la presión que ejercen sobre el gas en el interior, la presión en este experimento se mantendrá constante. El gas no puede entrar en el vaso porque está al revés en el agua, creando un sello.
- Técnicamente, debido a que la reacción de combustión convierte dos moléculas de O2 en una sola molécula de CO2 y dos de H2O, la cantidad de gas aumenta temporalmente. Sin embargo, la vela no mantendrá la temperatura al interior del vaso por encima de los 100 grados centígrados (212 grados Fahrenheit) y las dos moléculas de H2O se condensarán para formar agua líquida. Esto significa que la cantidad de gas en el vaso disminuye de manera efectiva mientras la vela se quema.[9]
- La ley de Charles se aplica en este caso solo debido a que la cantidad de gas en el vaso permanece constante desde el momento en que la vela consume. Sin la combustión, no se consumiría ni se produciría más gas. La fuente de calor desaparece al mismo tiempo, permitiendo que el gas se enfríe y reduzca su volumen.[10]
-
3Considera lo que sucede cuando el gas se enfría. Debido a que el volumen del gas es proporcional a la temperatura, se reduce a medida que el gas se enfría. Esta disminución en el volumen crea un vacío en el interior del vaso. La presión fuera del vaso sigue siendo la misma, por lo que esto crea una presión diferencial.[11]
-
4Entiende la presión diferencial. Dentro de cualquier sistema, los fluidos se mueven desde el extremo de alta presión hasta el extremo de baja presión. Con el aire sellado fuera del vaso, el agua se ve forzada a ir del extremo de alta presión del sistema (fuera del vaso) al extremo de baja presión del sistema (dentro del vaso) hasta que la presión en el interior del vaso iguale la presión fuera del vaso.[12]
- Esto es muy parecido a abrir un grifo. La presión fuera de la tubería de agua es menor que la presión dentro de la tubería, por lo que el agua se verá forzada a salir a través de la tubería y fuera de la llave de agua (incluso si tiene que ir en contra de la gravedad para hacerlo).
Consejos
- Prueba el experimento antes de llevarlo a cabo frente a una audiencia. Esto te permitirá corregir cualquier posible error en tu sistema sin que nadie lo note.
- Utiliza colorante de alimentos para que el agua sea más notoria.
Advertencias
- No uses vasos de plástico. La llama derretirá el vaso y el experimento fracasará.
Cosas que necesitarás
- sartén
- agua
- colorante de alimentos
- vaso
- vela
- fósforos o encendedor
Referencias
- ↑ https://www.questacon.edu.au/outreach/programs/science-circus/activities/thirsty-candle
- ↑ https://www.questacon.edu.au/outreach/programs/science-circus/activities/thirsty-candle
- ↑ https://www.questacon.edu.au/outreach/programs/science-circus/activities/thirsty-candle
- ↑ https://www.questacon.edu.au/outreach/programs/science-circus/activities/thirsty-candle
- ↑ http://www.stevespanglerscience.com/lab/experiments/why-does-the-water-rise/
- ↑ http://www.math.harvard.edu/~knill/pedagogy/waterexperiment/
- ↑ https://www.questacon.edu.au/outreach/programs/science-circus/activities/thirsty-candle
- ↑ http://www.math.harvard.edu/~knill/pedagogy/waterexperiment/
- ↑ http://www.math.harvard.edu/~knill/pedagogy/waterexperiment/












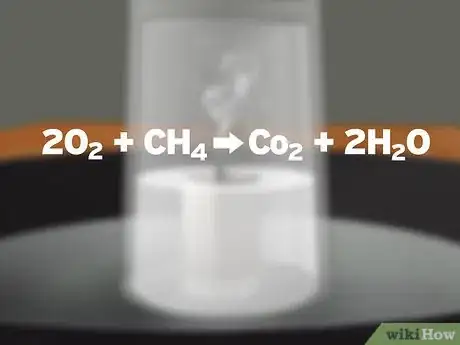











wikiHow's Content Management Team revisa cuidadosamente el trabajo de nuestro personal editorial para asegurar que cada artículo cumpla con nuestros altos estándares de calidad. Este artículo ha sido visto 80 587 veces.