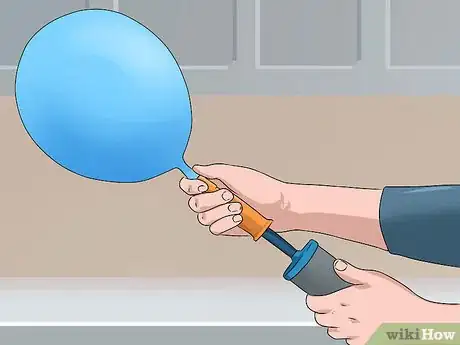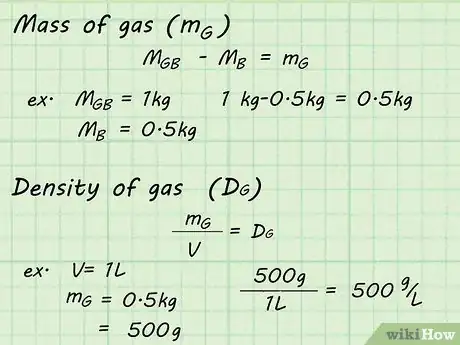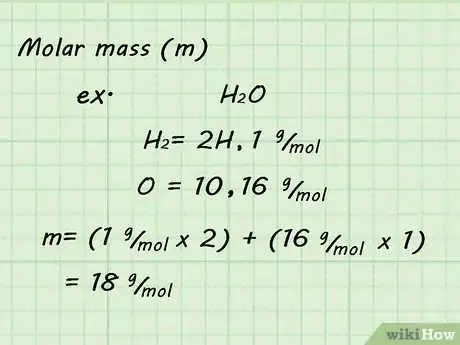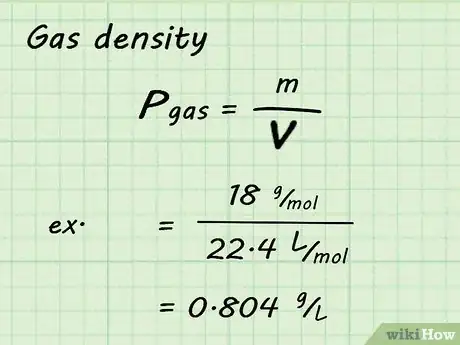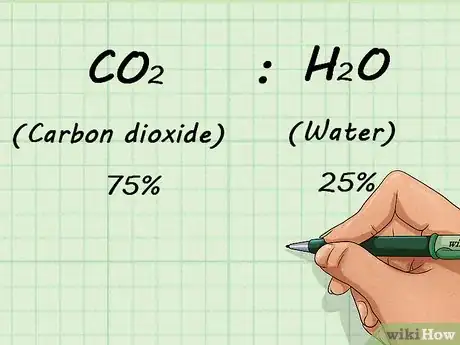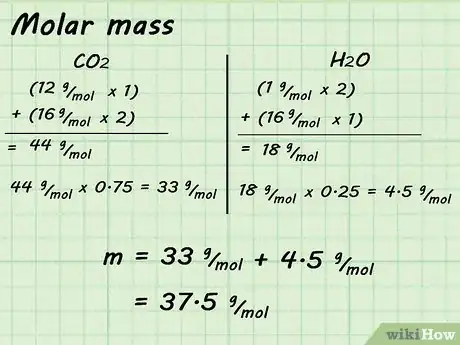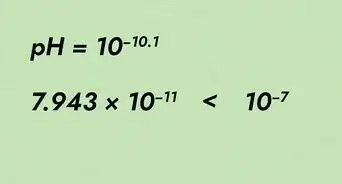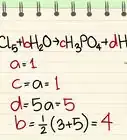Este artículo fue coescrito por Meredith Juncker, PhD. Meredith Juncker es candidata a un PhD en Bioquímica y Biología Molecular en el Centro de Ciencias de la Salud de la Universidad Estatal de Louisiana. Sus estudios se centran en proteínas y enfermedades neurodegenerativas.
Este artículo ha sido visto 3176 veces.
La densidad se define como la cantidad de masa presente en un volumen determinado. En el caso de los sólidos y líquidos, esta es una medición bastante sencilla. Sin embargo, los gases son extremadamente reactivos a la temperatura y la presión (más que los sólidos o líquidos), lo que puede hacer que sus densidades cambien bastante rápido. Te mostraremos cómo encontrar la densidad de un gas experimentalmente, teniendo en cuenta la temperatura y la sensibilidad a la presión. Luego, repasaremos la fórmula para calcular la densidad teórica de un gas, utilizando la Ley de los gases ideales para tener en cuenta todas las variables.
Pasos
Método 1
Método 1 de 3:Determinar la densidad del gas de forma experimental
-
1Llena un globo. Un globo está diseñado para inflarse con gas, lo que lo convierte en el recipiente perfecto para almacenar una cantidad fija de gas. Puedes llenarlo con aire usando una bomba o escoger otro tipo de gas, como helio o nitrógeno. Una vez que esté lleno, ata el extremo para que el gas no se escape.
-
2Sumerge el globo por completo en un recipiente transparente. Luego, sumerge el globo en un recipiente con agua. El globo hará que el nivel de agua suba. Marca la altura nueva del agua y quita el globo.
-
3Mide la cantidad de agua desplazada. Usa un instrumento de medición (por ejemplo, una taza o un vaso de precipitados) para medir la cantidad de agua necesaria para llenar el recipiente hasta la marca (sin el globo en el agua). Vierte lento. Si viertes demasiado, tendrás que comenzar de nuevo. El volumen del globo es igual al volumen del agua que agregues. Registra este valor para usarlo más tarde como V.
- Puedes ahorrar tiempo si sumerges el globo en un vaso de precipitados grande u otro recipiente previamente medido. Luego, omite la parte de agregar agua y simplemente resta el volumen del agua del volumen del agua y el globo.
-
4Pesa el globo lleno de gas. Puedes pesarlo usando una balanza de precisión. Las balanzas eléctricas suelen ser la mejor opción para esta situación. Registra el peso del globo lleno de gas para usar más tarde como mGB.
- Si llenas el globo con un gas más liviano que el aire, tendrás que hacer el pesaje antes y después de llenarlo para determinar la cantidad de gas usado.
-
5Determina la masa del globo vacío. Haz un agujero en el globo. Esto permitirá que el gas escape. Vuelve a pesarlo y registra el peso del globo vacío como mB.
-
6Haz los cálculos. Ahora que tienes los datos necesarios, podrás calcular la densidad del gas dentro del globo. Resta el peso del globo vacío, mB, del peso del globo lleno, mGB. Esto te proporcionará la masa del gas solo, mG. Divide la masa del gas, mG, entre el volumen, V, del gas para determinar la densidad del gas, DG.
- mGB - mB = mG
- Por ejemplo, si el globo lleno tiene una masa de 1 kg y el globo vacío tiene una masa de 0,5 kg, la masa del gas (mG) se determina al hacer el cálculo: 1 kg - 0,5 kg = 0,5 kg.
- mG / V = DG
- Por ejemplo, si el globo ha desplazado 1 litro de agua, la densidad se puede determinar al dividir la masa entre dicho volumen: 500 g/1 l = 500 g/l.
- mGB - mB = mG
Método 2
Método 2 de 3:Determinar la densidad teórica de un gas
-
1Comprende la ley de los gases ideales. Es importante mencionar que la ley de los gases iguales es una herramienta teórica que gobierna el comportamiento de los gases bajo condiciones específicas. Puedes resumirlo en la ecuación PV=nRT. Esto simplemente significa que la presión (P) multiplicada por el volumen (V) es igual al número de moles (n) multiplicado por la constante de gases ideales (R) multiplicado por la temperatura absoluta (T) de un gas ideal. [1]
- Un mol (n) equivale a 6,022*10^23 moléculas de gas.
- La constante de gas ideal (R) es igual a 0,0821 L·atm/mol·K.
- La temperatura absoluta se mide en kelvin (K).
-
2Deduce la temperatura y presión estándar. La temperatura y presión estándar (o TPE) se define como 273 K (32 °F) ( 0 °C) y 1 atmósfera estándar. Deducir la TPE permite calcular el volumen de 1 mol de cualquier gas como 22,414 litros. Conocer este volumen es fundamental para determinar la densidad del gas.[2]
-
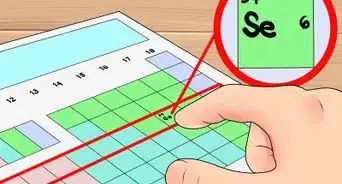
3Determina la masa molar del gas. Dado que usarás la TPE y deducirás un mol de gas, será sencillo determinar la masa molar. Suma la masa molar de todos los átomos individuales que conformen el gas para determinar la masa molar del gas. Las masas atómicas se pueden encontrar en la tabla periódica.[3]
- Por ejemplo, para determinar la masa molar del gas H2O, suma las masas de dos hidrógenos y un oxígeno. La masa molar resultante será 18 g/mol (1 g/mol + 1 g/mol + 16 g/mol).
-
4Calcula la densidad del gas. Si bien el volumen y los moles de gas son fijos en estos cálculos, la masa molar es distinta para cada gas. Esto significa que la densidad también será diferente para cada gas. Para determinar la densidad de cierto gas, divide la masa molar del gas entre el volumen molar (22,4 l/mol en este caso).[4]
- Por ejemplo, si quieres determinar la densidad del vapor de agua, divide 18 g/mol entre 22,4 l/mol, cuyo resultado es 0,804 g/l. El cálculo es 18 g/mol / 22,4 l/mol = 0,804 g/l.
Método 3
Método 3 de 3:Determinar la densidad teórica de una mezcla de gas
-
1Conoce el desglose fraccional de la mezcla de gas. Si has mezclado dos o más gases, necesitas saber cuánto de cada uno hay. Esto se realiza en forma de porcentaje. Esto permite conocer la proporción de la mezcla independientemente de cuánto gas haya en general.[5]
- Por ejemplo, si tienes una mezcla de 75 % de CO2 (dióxido de carbono) y 25 % de H2O (agua), esas proporciones no cambiarán, ya sea que tengas 1 litro o 1000 litros de gas.
-
2Determina la masa de un mol. Al conocer la proporción de los gases, podrás determinar la masa molar de la mezcla. Ahora, tendrás que determinar la masa molar de cada gas y multiplicar por su composición porcentual en la mezcla. Luego, suma todos los productos para determinar la masa molar de la mezcla de gas.[6]
- Por ejemplo, si quieres determinar la masa molar de CO2 (44 g/mol), multiplica por 0,75. Luego, determina la masa molar de H2O (18 g/mol) y multiplica por 0,25. Cuando sumes estos productos, 33 g/mol + 4,5 g/mol, te dará la masa molar de la mezcla. En este caso, la masa molar es 37,5 g/mol.
-
3Divide entre el volumen. Una vez que establezcas la masa molar de la mezcla, el cálculo de la densidad del gas es sencillo. Divide la masa molar entre el volumen estándar (22,4 l/mol). Recuerda que deduces la TPE y 1 mol de gas.[7]
- Por ejemplo, la densidad de una mezcla compuesta por un 75 % de dióxido de carbono y un 25 % de agua sería .
- Debes usar la fórmula de la ley de gases ideales para los cálculos si el gas no está en TPE (PV=nRT).
Consejos
- Verifica todos los cálculos antes de seguir con el próximo.
- Recuerda que los cálculos teóricos hacen deducciones estrictas acerca de las condiciones del gas.
- Memoriza una fórmula: PV=nRT. Puedes usar una variante de la misma fórmula para determinar otras propiedades. Por ejemplo, para determinar el volumen, usa V = nRT/P.
Advertencias
- Con el equipo básico, la medición de la densidad de los gases posiblemente tenga un error importante. Esto está bien para aplicaciones académicas, pero se debe tener en cuenta en aplicaciones que requieran resultados más precisos (por ejemplo, las industriales).
Referencias
- ↑ https://chem.libretexts.org/Textbook_Maps/General_Chemistry_Textbook_Maps/Map%3A_Chem1_(Lower)/06._Properties_of_Gases/6.3%3A_Dalton's_Law
- ↑ https://chem.libretexts.org/Textbook_Maps/General_Chemistry_Textbook_Maps/Map%3A_Chem1_(Lower)/06._Properties_of_Gases/6.3%3A_Dalton's_Law
- ↑ https://chem.libretexts.org/Textbook_Maps/General_Chemistry_Textbook_Maps/Map%3A_Chem1_(Lower)/06._Properties_of_Gases/6.3%3A_Dalton's_Law
- ↑ https://chem.libretexts.org/Textbook_Maps/General_Chemistry_Textbook_Maps/Map%3A_Chem1_(Lower)/06._Properties_of_Gases/6.3%3A_Dalton's_Law
- ↑ https://chem.libretexts.org/Textbook_Maps/General_Chemistry_Textbook_Maps/Map%3A_Chem1_(Lower)/06._Properties_of_Gases/6.3%3A_Dalton's_Law
- ↑ https://chem.libretexts.org/Textbook_Maps/General_Chemistry_Textbook_Maps/Map%3A_Chem1_(Lower)/06._Properties_of_Gases/6.3%3A_Dalton's_Law
- ↑ https://chem.libretexts.org/Textbook_Maps/General_Chemistry_Textbook_Maps/Map%3A_Chem1_(Lower)/06._Properties_of_Gases/6.3%3A_Dalton's_Law