wikiHow est un wiki, ce qui veut dire que de nombreux articles sont rédigés par plusieurs auteurs(es). Pour créer cet article, 10 personnes, certaines anonymes, ont participé à son édition et à son amélioration au fil du temps.
Il y a 13 références citées dans cet article, elles se trouvent au bas de la page.
Cet article a été consulté 109 552 fois.
La corrosion est le procédé qui entraine la dégradation d'un métal en présence d'agents oxydants dans l'environnement. La corrosion peut prendre de nombreuses formes et avoir de nombreuses causes. Un exemple connu est celui de la rouille, processus durant lequel des oxydes de fer se forment en présence d'humidité. La corrosion est un problème sérieux pour les fabricants d'immeubles, de bateaux, d'avions, de voitures et la plupart des autres objets métalliques. Ainsi, quand du métal est utilisé comme matériau pour un pont, l'intégrité structurelle de ce métal qui peut être altérée par la corrosion est cruciale pour la sécurité des utilisateurs de ce pont.
Étapes
Méthode 1
Méthode 1 sur 3:Comprendre les différents types de corrosion métallique
Du fait de l'utilisation d'un grand nombre de métaux différents de nos jours, les constructeurs et fabricants ont besoin de se protéger de nombreux types de corrosion. Chaque métal a ses propres propriétés électrochimiques, qui vont déterminer les types de corrosion, s'il y en a, auxquels le métal est vulnérable. La table suivante détaille une sélection de métaux communs et les types de corrosion auquel ils sont susceptibles.
| Métal | Vulnérabilités à la corrosion métallique | Techniques de prévention communes | Activité galvanique* |
|---|---|---|---|
| Acier inoxydable (passivé) | Attaque uniforme, galvanique, par piqûres, par crevasses (tout particulièrement dans de l'eau salée [1] ) | Nettoyage, couche protectrice ou lubrifiante | Faible (la corrosion initiale forme une couche résistante d'oxyde) |
| Fer | Attaque uniforme, galvanique, caverneuse | Nettoyage, couche protectrice ou lubrifiante, galvaniser, solution anti-rouille | Haute |
| Laiton | Attaque uniforme, dézingage, stress | Nettoyage, couche protectrice ou lubrifiante (souvent de l'huile ou une laque), ajouter de l'aluminium, de l'étain ou de l'arsenic à l'alliage [2] | Moyenne |
| Aluminium | Galvanique, piqûres, caverneuse [3] | Nettoyage, couche protectrice ou lubrifiante, galvaniser, anodiser, protection cathodique, isolation électrique [4] | Haute (la corrosion initiale forme une couche d'oxyde résistante) |
| Cuivre | Galvanique, par piqûres, esthétique terne | Nettoyage, couche protectrice ou lubrifiante, ajout de nickel à l'alliage. (particulièrement pour l'eau salée [5] ) | Faible (la corrosion initiale forme une patine résistante) |
- Veuillez noter que la colonne « activité galvanique » se réfère à l'activité chimique relative du métal telle que décrite par les tables de corrosion galvanique dans les sources référencées [6] . Ainsi, selon ces tables, la plus grande activité galvanique, le plus rapidement la corrosion galvanique se passera quand il y a contact avec un métal moins actif.
-
1Empêchez la corrosion uniforme en protégeant la surface du métal. La corrosion uniforme est une forme de corrosion qui se passe de manière uniforme sur la surface du métal exposée. Dans cette forme de corrosion, la surface entière du métal est attaquée par la corrosion et ainsi, le procédé de corrosion se déroule à une vitesse uniforme. Par exemple, dans le cas d'un toit non protégé en ferraille, exposé de manière homogène à la pluie, la surface entière du toit sera en contact avec la même quantité d'eau, ce qui provoquera une corrosion se développant de manière régulière. La meilleure façon de se protéger de la corrosion uniforme consiste en la pose d'une barrière protectrice entre le métal et les agents corrosifs [7] . De nombreuses solutions sont possibles, comme la peinture ou de l'huile de protection ou une solution électrochimique comme une couche de zinc galvanisé.
- Dans le cas d'applications souterraines ou submersibles, une protection cathodique est aussi un excellent choix [8] .
-
2Réprimez la corrosion galvanique en bloquant le flux d'ions d'un métal à l'autre. Une autre corrosion importante qui peut arriver, quelle que soit la solidité des métaux utilisés, est la corrosion galvanique. La corrosion galvanique se passe quand deux métaux avec différents potentiels d'électrodes sont en contact, en présence d'une solution électrolyte (comme l'eau salée) qui crée un passage pour le courant électrique entre les deux métaux. Lorsque la corrosion galvanique se déclenche, les ions métalliques affluent du métal le plus actif au métal le moins actif, ce qui provoque une corrosion accélérée du métal le plus actif et une corrosion lente du métal le moins actif. De manière pratique, cela se traduit par une corrosion qui va se développer sur le métal le plus actif à l'endroit du contact entre les deux métaux.
- Toute méthode de protection qui empêche la création d'un flux d'électrons peut potentiellement arrêter la corrosion galvanique. Couvrir les métaux avec une couche protectrice peut empêcher les électrolytes dans l'environnement de créer un chemin pour le courant électrique entre les deux métaux, aussi bien qu'un procédé de protection électrochimique tel que la galvanisation ou d'anodisation. Il est aussi possible de contrecarrer la corrosion galvanique en isolant électriquement les zones de contact entre les deux métaux.
- De plus, l'utilisation d'une protection cathodique ou d'une anode sacrificielle peut permettre de protéger les métaux importants de la corrosion galvanique. Voir ci-dessous pour plus d'informations.
-
3Stoppez la corrosion par piqures. Vous pouvez faire cela en protégeant la surface métallique, en évitant les sources environnementales de chlorure et en évitant toute entaille ou rayure. La corrosion par piqures est une forme de corrosion qui se passe au niveau microscopique, mais qui peut avoir de vastes conséquences. La corrosion par piqures est un grave problème pour les métaux qui possèdent une résistance à la corrosion grâce à un film mince de composants passifs sur leurs surfaces, car c'est une forme de corrosion qui entraine des défauts structurels dans des situations ou les couches protectrices devraient normalement les empêcher. La corrosion par piqure démarre lorsqu'une petite partie du métal perd sa couche protectrice. Lorsque cette petite partie de couche protectrice disparait, la corrosion galvanique apparait au stade microscopique, entrainant la formation de microtrous dans le métal. À l'intérieur de ce trou, l'environnement localisé devient acide, ce qui accélère le processus. On empêche généralement la corrosion galvanique en appliquant une couche protectrice ou en utilisant une protection cathodique [9] .
- L'exposition à un environnement à fort taux de chlorures (salin par exemple) est connue pour accélérer le processus de corrosion par piqures.
-
4Inhibez la corrosion par crevasses. Minimisez les espaces réduits dans le désign de l'objet. La corrosion caverneuse apparait dans les endroits d'un objet métallique ou l'accès au fluide environnant (air ou liquide) est faible, par exemple au niveau des boulons, sous les machines à laver, sous les bernacles ou entre les joints d'une charnière. La corrosion caverneuse apparait lorsque l'espace près de la surface métallique est suffisamment grand pour laisser passer le fluide, mais trop petit pour qu'il en sorte, devenant stagnant. L'environnement proche de ces petits espaces devient corrosif et le métal commence à se corroder par un procédé similaire à la corrosion par piqures. Empêcher la corrosion caverneuse est généralement un problème de désign. En minimisant les petits espaces dans la fabrication d'un objet métallique, en fermant ces espaces ou en permettant la circulation, il est possible de minimiser le risque de corrosion caverneuse.
- La corrosion caverneuse est particulièrement critique lorsque l'on travaille avec des métaux tels que l'aluminium qui ont une protection passive sous forme de couche extérieure, car le mécanisme de corrosion caverneuse contribue à supprimer cette couche.
-
5Empêchez la corrosion sous contrainte. Pour cela, utilisez des charges adaptées ou un traitement thermique. La corrosion sous contrainte (CSC) est une forme rare de défaillance structurelle liée à la corrosion, qui est un problème particulièrement pour les ingénieurs chargés de construire des structures destinées à supporter des charges conséquentes. Dans le cas de CSC, une structure métallique porteuse va former des fissures même sous une charge inférieure à sa charge maximale et dans certains cas seulement à une fraction de cette charge maximale. En présence d'ions corrosifs, de petites fissures, voire microscopiques, vont se former dans le métal du fait des contraintes en traction créées par une forte charge qui se propageront au fur et à mesure que les ions corrosifs atteindront l'extérieur de la fissure. Cela entrainera le développement de la fissure et pourrait causer une défaillance structurelle. La CSC est particulièrement dangereuse, car elle peut se développer même en présence de substances qui naturellement sont peu corrosives pour les métaux. Cela signifie qu'une corrosion dangereuse se passe alors que le reste de la surface du métal semble épargnée [10] .
- Éviter la CSC est partiellement un problème de désign. Par exemple, en choisissant un métal résistant à la CSC dans l'environnement dans lequel sera utilisé ce métal et s'assurer que le métal est bien testé sous contrainte devrait empêcher l'apparition de CSC. De plus, le procédé de traitement thermique d'un métal peut éliminer toute contrainte résiduelle provenant de la fabrication.
- La CSC est connue pour être exacerbée par de fortes températures et la présence de liquides contenant des chlorures dissouts [11] .
Publicité
Méthode 2
Méthode 2 sur 3:Prévenir la corrosion par des solutions maison
-
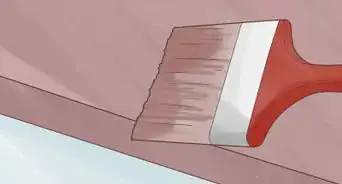
1Peingnez la surface métallique. Une des méthodes les plus utilisées, les moins chères, de protection du métal de la corrosion est tout simplement de le recouvrir d'une couche de peinture. Le processus de corrosion implique de l'humidité et un agent oxydant qui interagit avec la surface du métal. Donc, si le métal est recouvert d'une barrière protectrice, ni l'humidité ni les agents oxydants ne vont être en contact avec le métal et donc pas de corrosion.
- Cependant, la peinture est vulnérable à une dégradation éventuelle. Il faut donc réappliquer de la peinture dès que la surface devient ébréchée, usée ou endommagée. Si la peinture se dégrade au point de laisser le métal normalement protégé exposé, assurez-vous de bien inspecter d'éventuels dommages dus à la corrosion du métal.
- Il y a de nombreuses méthodes différentes pour appliquer de la peinture sur des surfaces métalliques. Les métallurgistes utilisent souvent un certain nombre de ces méthodes en combinaison pour s'assurer que l'ensemble du métal soit recouvert de façon homogène. Ci-dessous se trouve une liste des méthodes ainsi que des commentaires sur leur utilisation.
- Un pinceau est utilisé pour les surfaces difficiles à atteindre.
- Le rouleau est employé pour couvrir de vastes surfaces. Bon marché et pratique.
- Le pistolet à air comprimé permet de couvrir de vastes surfaces. Plus rapide, mais moins efficace que les rouleaux (la perte de peinture est grande).
- La pulvérisation sans air ou électrostatique est utilisée pour couvrir de vastes surfaces. Rapide, elle permet de varier l'épaisseur. Moins de pertes qu'un pistolet à air comprimé classique. Le matériel est cher.
-
2Utilisez de la peinture marine pour les métaux exposés à l'eau. Les objets métalliques en contact de temps en temps (ou en permanence) avec l'eau, comme sur les bateaux, ont besoin de peintures spéciales contre le risque augmenté de corrosion. Dans ces situations, la corrosion normale comme la rouille n'est pas le seul problème (même si c'est l'un des problèmes principaux), car des animaux aquatiques comme les balanes se développeront sur des métaux non protégés, ce qui pourrait devenir une autre source de problèmes d'usure et de corrosion. Pour protéger les objets métalliques comme les bateaux ou autres, assurez-vous d'utiliser de la peinture marine époxy de qualité. Non seulement ces peintures protègent la couche métallique de l'humidité, mais empêche aussi le développement de petites créatures aquatiques en surface.
-
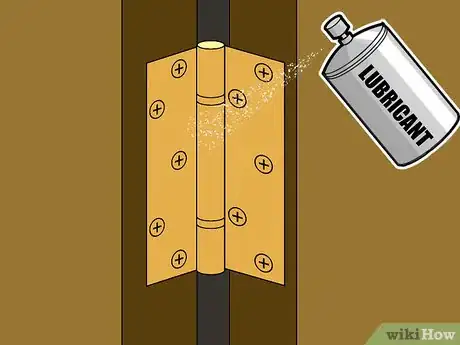
3Appliquez des lubrifiants protecteurs pour les parties métalliques en mouvement. Pour les surfaces métalliques plates et statiques, la peinture permet une excellente protection contre l'humidité et prévient la corrosion sans diminuer l'efficacité du métal. Toutefois, la peinture est en général inutilisable pour les parties métalliques en mouvement. Par exemple, si vous peignez une charnière de porte, quand la peinture sèchera, elle bloquera la charnière et empêchera tout mouvement. Si vous forcez sur la porte pour l'ouvrir, la peinture va se fissurer et laisser des trous qui permettront à l'humidité de pénétrer dans le métal. Un meilleur choix pour les parties métalliques comme les charnières, les joints, les roulements, etc. est un lubrifiant non soluble dans l'eau. Une couche suffisante de ce type de lubrifiant va permettre de repousser l'humidité naturelle tout en permettant un mouvement doux et facile de votre partie métallique.
- Parce que les lubrifiants ne sèchent pas comme les peintures, ils se dégradent au fil du temps et nécessitent de les réappliquer de temps en temps. Réappliquez des lubrifiants sur les parties métalliques pour s'assurer qu'ils restent efficaces comme protection.
-
4Nettoyez bien les surfaces métalliques avant de les peindre ou les lubrifier. Que vous utilisiez de la peinture standard, de la peinture marine ou un lubrifiant, un mastic protecteur, vous devriez vous assurer que votre métal est propre et sec avant de les appliquer. Assurez-vous que le métal est bien dénué de poussière, de graisse, de résidus de soudure ou de corrosion, car cela pourrait diminuer l'efficacité de votre protection contre la corrosion.
- La poussière, la crasse et autres peuvent interférer avec la peinture ou les lubrifiants en les empêchant d'adhérer directement à la surface métallique. Par exemple, si vous peignez sur une surface métallique avec quelques petits copeaux métalliques, votre peinture va se fixer sur ces copeaux en laissant des espaces non protégés sur cette surface métallique. Lorsque les copeaux tomberont, les endroits exposés deviendront vulnérables à la corrosion.
- Si vous voulez peindre ou lubrifier un métal ayant des traces de corrosion, votre but devrait être de rendre votre surface aussi régulière que possible pour permettre une adhérence optimale de la couche protectrice sur le métal. Utilisez une brosse métallique, du papier de verre ou un suppresseur de rouille chimique, pour enlever autant de parties corrodées que possible.
-
5Gardez les métaux non protégés à l'abri de l'humidité. Comme mentionné ci-dessus, la plupart des formes de corrosion sont exacerbées par l'humidité. Si vous n'arrivez pas à déposer sur votre métal une couche protectrice, vous devez vous assurer que ce dernier n'est pas exposé à l'humidité. S'efforcer de mettre à l'abri les métaux non protégés va améliorer leur utilité et augmenter leur durée de vie. Si vos objets métalliques sont exposés à l'eau ou l'humidité, assurez-vous de bien les nettoyer et les sécher immédiatement après utilisation pour empêcher un démarrage de la corrosion.
- En plus de surveiller l'exposition à l'humidité lors de l'utilisation, assurez-vous de bien stocker ces objets métalliques dans un endroit sec et propre. Pour des objets de dimension qui ne rentreraient pas dans une armoire, couvrez-les avec de la bâche ou des habits. Cela empêchera de garder une faible humidité et de limiter l'accumulation de poussière en surface.
-
6Conservez les surfaces métalliques aussi propres que possible. Après chaque utilisation d'un objet métallique, qu'il ait été peint ou non, assurez-vous de nettoyer sa surface utilisée, en enlevant poussières et crasse. L'accumulation de poussières et débris en surface contribue à l'usure et la fissuration du métal ou de sa couche protectrice, ce qui entrainera une formation de corrosion au fil du temps.Publicité
Méthode 3
Méthode 3 sur 3:Empêcher la corrosion avec des solutions électrochimiques avancées
-
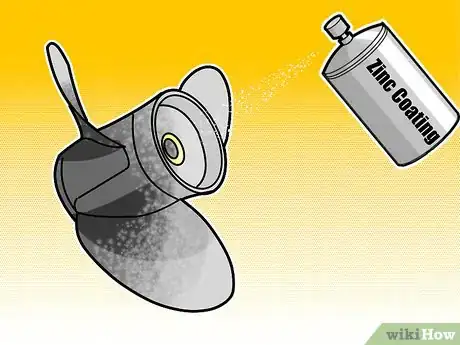
1Utilisez un procédé de galvanisation. Un métal galvanisé est un métal qui a été couvert d'une couche mince de zinc pour le protéger de la corrosion. Le Zinc est chimiquement plus actif que les métaux sous-jacents [12] , il s'oxyde donc une fois exposé à l'air. Une fois que le zinc s'oxyde, il forme une couche protectrice, en empêchant toute corrosion du métal qui est dessous. Le procédé le plus courant de galvanisation de nos jours est appelé galvanisation à chaud, par lequel les parties métalliques (le plus souvent en fer) sont immergées dans un bain chaud de zinc fondu pour permettre une couverture uniforme.
- Ce procédé nécessite d'utiliser des produits chimiques à usage industriel, donc certains sont dangereux à température ambiante, ainsi qu'en hautes températures et donc ne devrait être appliqué que par des professionnels formés. Ci-dessous, les étapes simplifiées de la galvanisation à chaud pour l'acier [13]
.
- L'acier est nettoyé avec une solution caustique pour enlever poussière, graisse, peinture, etc. puis rincé abondamment.
- L'acier est trempé dans de l'acide pour supprimer la calamine, puis rincé.
- Un matériau appellé le « flux » est appliqué à l'acier et laissé à sécher. Cela permet à la couche finale de zinc d'adhérer à l'acier.
- L'acier est plongé dans une cuve de zinc fondu et trempé jusqu'à atteindre la température du zinc.
- L'acier est ensuite refroidi dans un réservoir étanche rempli d'eau.
- Ce procédé nécessite d'utiliser des produits chimiques à usage industriel, donc certains sont dangereux à température ambiante, ainsi qu'en hautes températures et donc ne devrait être appliqué que par des professionnels formés. Ci-dessous, les étapes simplifiées de la galvanisation à chaud pour l'acier [13]
.
-
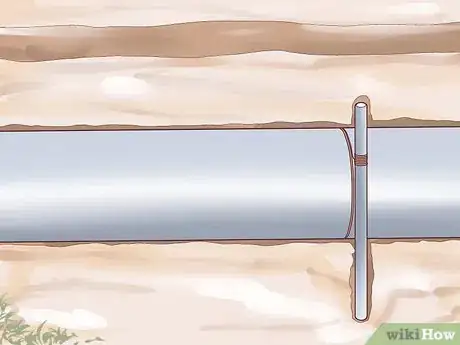
2Ayez recours à une anode sacrificielle. Une autre façon de protéger le métal de la corrosion est de le connecter électriquement avec une petite pièce réactive appelée « anode sacrificielle ». Du fait de la relation électrochimique entre l'objet métallique large et le petit objet réactif (expliqué brièvement ci-dessous), seule la petite pièce de métal va subir la corrosion, laissant la pièce métallique large intacte. Quand l'anode sacrificielle se sera complètement corrodée, elle doit alors être remplacée ou l'objet métallique va aussi commencer à se corroder. Cette méthode de protection contre la corrosion est souvent utilisée pour les structures enterrées comme les réservoirs de stockage ou les objets en contact constant avec l'eau comme les bateaux.
- Les anodes sacrificielles sont constituées d'un grand nombre de métaux réactifs différents. Le zinc, l'aluminium et le magnésium sont les trois métaux les plus utilisés pour cette application. Du fait des propriétés chimiques de ces matériaux, le zinc et l'aluminium sont souvent utilisés pour des objets métalliques en contact avec l'eau de mer, tandis que le magnésium est plus adapté à l'eau douce.
- L'utilité d'une anode sacrificielle est due à la chimie du procédé de corrosion. Quand l'objet métallique se corrode, des zones naturellement semblables à des anodes et des cathodes dans une cellule électrochimique se forment. Les électrons vont circuler de la partie anode de la surface métallique dans les électrolytes environnantes. Parce que les anodes sacrificielles sont très réactives en comparaison du métal de l'objet en corrosion, l'objet lui-même devient très cathodique en comparaison et ainsi les électrons circulent en dehors de l'anode sacrificielle, entrainant sa corrosion, mais en épargnant le reste du métal.
-
3Utilisez un courant imposé. Parce que le procédé chimique à l'origine de la corrosion métallique demande un courant électrique sous forme d'électrons circulant vers l'extérieur du métal, il est possible d'appliquer une source de courant pour maitriser le courant de corrosion et empêcher cette corrosion. Essentiellement, ce procédé (appelé « courant imposé ») confère une charge électrique négative continue au métal protégé. Cette charge va maitriser le courant dans le métal qui entraine les électrons vers l'extérieur et arrêter la corrosion. Ce type de protection est souvent utilisé dans les structures enterrées comme les réservoirs de stockage et les pipelines.
- Il est à noter que le type de courant utilisé pour des dispositifs de protection à courant imposé est le plus souvent un courant continu (DC).
- Typiquement, le courant anticorrosion ou courant imposé est généré en enterrant deux anodes métalliques dans le sol près de l'objet à protéger. Le courant est transmis par du fil isolé vers les anodes, puis circule par le sol vers l'objet métallique. Le courant passe à travers l'objet métallique et retourne à sa source (générateur, rectifieur, etc.) par du fil isolé.
-
4Procédez à une anodisation. L'anodisation est une forme spéciale de protection surfacique, utilisée pour protéger un métal de la corrosion et y appliquer une couche passive. Si vous avez déjà vu un mousqueton coloré, vous avez déjà vu une surface anodisée. Plutôt que d'appliquer physiquement une couche de protection, comme la peinture, l'anodisation utilise un courant électrique pour donner au métal une couche de protection empêchant toute forme de corrosion.
- Le procédé chimique derrière l'anodisation implique le fait que de nombreux métaux, comme l'aluminium, forment naturellement des produits appelés oxydes quand ils sont en contact avec l'oxygène de l'air. Cela entraine un métal possédant une mince couche d'oxyde en surface qui protège (à des degrés variés, dépendant du métal) contre une corrosion future. Le courant électrique fournit durant le procédé d'anodisation créée essentiellement une accumulation d'oxyde bien supérieure à celle qui se développe naturellement, ce qui amène une protection améliorée contre la corrosion.
- Il y a différentes façons d'anodiser des métaux. Ci-dessous sont détaillées les étapes d'un procédé d'anodisation [14]
. Consultez comment anodiser de l'aluminium pour plus d'informations.
- L'aluminium est nettoyé et dégraissé.
- Les impuretés de surface de l'aluminium sont enlevées avec une solution spéciale.
- L'aluminium est plongé dans un bain acide avec un courant et une température constante (par exemple, 1 ampère/m2 et 21 degrés C).
- L'aluminium est retiré et rincé.
- L'aluminium peut aussi être plongé dans un colorant à 38 - 60 degrés C.
- Le traitement de l'aluminium se termine en le plaçant dans de l'eau bouillante pour 20 à 30 minutes.
-
5Employez un métal qui développe une passivation. Comme précisé ci-dessus, certains métaux vont naturellement former une couche protectrice d'oxyde par l'exposition à l'air. Certains métaux vont former une telle couche de manière si efficace qu'ils seront naturellement rendus chimiquement inactifs. On dit que ces métaux sont passifs, référence au procédé de passivation qui les rend moins réactifs. Selon son utilisation, un objet métallique passif n'aura pas forcément besoin de protection additionnelle pour le rendre résistant à la corrosion.
- Un exemple bien connu d'un métal qui montre de propriétés de passivation est l'acier inoxydable. L'acier inoxydable est un alliage d'acier ordinaire et de chrome, ce qui le rend non sensible à la corrosion dans la plupart des conditions sans protection additionnelle. Pour la plupart des utilisations courantes, il n'est cependant pas nécessaire d'utiliser de l'acier inoxydable.
- Cependant, il faut noter que dans certains cas, l'acier inoxydable n'est pas 100 % protégé contre la corrosion, notamment dans l'eau salée. De manière similaire, certains métaux passifs deviennent non-passifs sous certaines conditions extrêmes et ne sont donc pas adaptés à tout type d'utilisation.
Publicité - Un exemple bien connu d'un métal qui montre de propriétés de passivation est l'acier inoxydable. L'acier inoxydable est un alliage d'acier ordinaire et de chrome, ce qui le rend non sensible à la corrosion dans la plupart des conditions sans protection additionnelle. Pour la plupart des utilisations courantes, il n'est cependant pas nécessaire d'utiliser de l'acier inoxydable.
Conseils
- Soyez prudent avec la corrosion intergranulaire. Celle-ci modifie les propriétés du métal à être manipulé ou formé et détériore sa résistance générale.
- Il est généralement recommandé de coller les bateaux. Par contre, les bateaux en aluminium et en acier ne doivent pas être collés pour empêcher tout risque de corrosion.
Avertissements
- Ne jamais laisser des parties métalliques corrodées sur un véhicule ou un bateau. Le niveau de corrosion peut varier, mais toute corrosion peut indiquer des défauts structurels sérieux. Pour plus de sécurité, remplacez ou enlevez bien tout signe de corrosion métallique.
- Quand vous utilisez des anodes sacrificielles, ne les peignez pas. En effet, les peindre entrainerait l'impossibilité pour les électrons de les traverser, entrainant la nullité de leur protection contre la corrosion.
Éléments nécessaires
- Une bâche ou un linge
- Des produits de nettoyage
- De la peinture
- Des anodes sacrificielles
- Des anodes métalliques pour courant imposé
- Du fil isolant
- Des lubrifiants
Références
- ↑ http://www.estainlesssteel.com/corrosion.shtml
- ↑ http://corrosion-doctors.org/MatSelect/corrbrass.htm
- ↑ http://www.aluminiumdesign.net/design-support/aluminium-corrosion-resistance/
- ↑ http://www.aluminiumdesign.net/design-support/aluminium-corrosion-resistance/
- ↑ http://www.copper.org/applications/marine/cuni/txt_properties.html#CorrosionResistance
- ↑ http://corrosion-doctors.org/Definitions/galvanic-series.htm
- ↑ http://corrosion.ksc.nasa.gov/unifcor.htm
- ↑ http://www.nace.org/General-Attack-Corrosion/
- ↑ http://corrosion.ksc.nasa.gov/pittcor.htm