أيض الحديد لدى الإنسان
أيض الحديد لدى الإنسان أو استقلاب الحديد لدى الإنسان أو التمثيل الغذائي للحديد لدى الإنسان هو عبارة عن مجموعة من التفاعلات الكيميائية التي تحافظ على توازن الحديد في جسم الإنسان. والحديد مادة ضرورية للجسم ولكنها قد تكون سامة في بعض الأحيان، لذا التحكم بها يعد جزءاً مهماً في العديد من نواحي الصحة والمرض التي تُعنى بجسم الإنسان. يركز أخصائيّو الدم على نظام التمثيل الغذائي للحديد لأنه يعد مكوّناً أساسياً لخلايا الدم الحمراء، حيث تحتوي خلايا الدم الحمراء على القدر الأكبر من الحديد الموجود في الجسم. ولهذا فإن فهم هذه العملية مهم جداً لمعرفة الأمراض المصاحبة لزيادة الحديد، مثل مرض ترسّب الأصبغة الدموية (hemochromatosis) وأمراض نقص الحديد كالأنيميا.
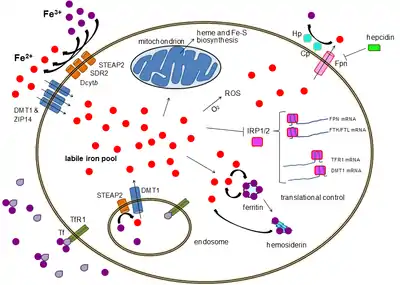
أهمية عملية تنظيم عنصر الحديد
يُعتبر الحديد عامل أساسي هام لمعظم أشكال الحياة بما في ذلك البشر ومعظم الأنواع البكتيرية، كما أن جميع النباتات والحيوانات تستخدم عنصر الحديد لذلك يمكن الحصول عليه من أنواع عدة من الغذاء. عنصر الحديد عامل أساسي للحياة وذلك بسبب مرونته الغير عادية حيث يمكن أن يعمل بمثابة مانح ومستقبل للإلكترونات على حدٍ سواء. كما يمكن أن يكون عنصر الحديد سامّاً في بعض الأحيان بسبب قدرته على منح واستقبال الإلكترونات بحيث إذا ما تواجد في الخلية بشكل حر فإنه يعمل على التفاعل مع فوق أكسيد الهيدروجين H2O2 وتحويله إلى سيالات أو جذور حرة، هذه السيالات أو الجذور الحرة قد تُلحق الضرر بالعديد من التركيبات الخلوية وقد تؤدي إلى قتل الخلية. ولمنع هذا النوع من الضرر تستخدم جميع أشكال الحياة خاصية ارتباط الحديد بالبروتينات والتي تساعد الخلية على الاستفادة من عنصر الحديد وفي نفس الوقت الحد من قدرته على إلحاق الضرر بالخلايا.[1][2] وأهم مجموعة من البروتينات المرتبطة بالحديد هي جزيئات الهيم (الحديد باللغة اللاتينية) والتي تحوي عنصر الحديد في مركزها. يستخدم الإنسان ومعظم الأجناس البكتيرية عدة متغيرات للقيام بتفاعلات الأكسدة والاختزال وعمليات نقل الإلكترونات، هذه التفاعلات مطلوبة في عملية الفسفرة المؤكسدة والتي تُعتبر المصدر الرئيسي للطاقة في الخلايا البشرية وبدونها فإن معظم الخلايا قد تموت. تُعتبر البروتيات الكبريتية - الحديدية مجموعة أخرى هامة من البروتينات المحتوية لعنصر الحديد، بعض هذه البروتينات تُعتبر أجزاءً أساسية من الفسفور المؤكسد. البشر أيضاً يستخدمون الحديد في خضاب الدم أو اليحمور (Hemoglobin) الموجود في خلايا الدم الحمراء من أجل نقل الأوكسجين من الرئتين إلى الأنسجة، ولإعادة ثاني أكسد الكربون إلى الرئتين مجددًا. والحديد يُعتبر أيضًا مكوّن ضروري للمايوجلوبين لتخزين ونشر الأوكسجين في خلايا العضلات، ويحتاج الجسم البشري للحديد من أجل نقل الأوكسجين، وهذا الأوكسجين مطلوب لإنتاج وإبقاء كل الخلايا بأجسامنا. والجسم البشري ينظّم امتصاص الحديد بإحكام وبتكرار مستمر، ولذا يُعتبر الحديد عنصرًا ضروريًا في حياة الإنسان، وفي الحقيقة لا توجد عند البشر آليّة فيسولوجية منظّمة تُفرز الحديد باستمرار، ومعظم البشر تمنعهم أجسادهم من الأحمال الحديدية الزائدة من قبل تنظيم جسمهم للامتصاص الحديدي، وأولئك الذين لا تستطيع أجسادهم تنظيم مستوى الحديد يُعانون من اضطرابات عديدة بسبب الحمل الحديدي الزائد، وفي هذه الأمراض، يبدأ تسمّم الحديد بسحق قدرة الجسم على تقييد وتخزين الحديد.[3]
الحماية من البكتيريا
عندما يُصاب الجسم بعدوى بكتيرية يبدأ الجهاز المناعي بعملية تُعرف باسم الحجب الحديدي (ironwithholding)، في هذه العملية يقوم الحديد الموجود في البلازما بالارتباط مع الترانسفيرين (transferrin) حتى يصعب على البكتيريا الحصول عليه وباستطاعة خلايا الجسم الحصول على الحديد من الترانسفيرين بسهولة.[4] لكي تعيش البكتيريا يجب عليها أن تحصل على الحديد من البيئة التي هي فيها. أنواع البكتيريا المختلفة المسببة للامراض تقوم بذلك بعدة طرق منها فكّ جزيئات الحديد المرتبط بجزيئات تدعى سيدروفورس (siderophores) ثم تقوم باعادة امتصاص الحديد، أو تقوم بأخذ الحديد من الهيموجلوبين أو الترانسفيرين. كلّما زادت صعوبة حصولها على الحديد يزيد عملها في للتمثيل الغذائي، وهذا يعني أنّ نقص الحديد يبطئ عملية التكاثر لدى البكتيريا، لذلك يُعدّ التحكم على الحديد في أجسامنا ذو أهمية في الدفاع عنها ضد البكتيريا. الأشخاص الذين يحملون كميات كبيرة من الحديد كالمصابين بمرض ترسب الأصبغة الدموية (hemochromatosis) أكثر عرضة للعدوى البكتيرية. بالرغم من أن آليّة الاستجابة رائعة للعدوى البكتيرية قصيرة الأجل، إلا أنها قد تسبّب مشاكل عند استمرار الالتهاب لفترة طويلة. ومنذ أن بدأت الكبد بإنتاج مادة الهبسدن رداً على السيتوكينات الالتهابية، فقد بدأ مستوى مادة الهبسدن بالازدياد كنتيجة لسبب وجود البكتيريا التي لم تأتِ من الالتهاب، مثل العدوى الفيروسية، والسرطان وأمراض المناعة الذاتية أو الأمراض المزمنة الأخرى. وعندما يحدث هذا، فإن حبس مادة الحديد سيصبح السبب الرئيسي لمتلازمة فقر الدم التي تعد من الأمراض المزمنة، وذلك يعني عدم توفر مقدار كافٍ من الحديد لإنتاج مقدار كافي من الهيموجلوبين وهو الذي يوجد في الخلايا الحمراء.[1]
تخزين الحديد في الجسم
غالبية الأشخاص ذوي التغذية الجيدة في المدن الصناعية أو المتقدمة تحتوي أجسادهم على عنصر الحديد بمقدار 4 إلى 5 جم أي ما يُعادل 2.5جم من هذا الحديد في أجسادهم يكون موجودا في الهيموجلوبين لحمل الاكسجين عبر الدم، أما الباقي من الحديد يكون حوالي 2 جم في الرجال البالغين وبنسبة أقل من ذلك لدى النساء في سن الإنجاب وهو يكون داخل الغريتين (ferritin) الذي يكون عبارة عن مركب بروتينيني داخل الخلية لتخزين الحديد ويوجد بنسبة أكبر في نخاع العظام والكبد والطحال. مخازن الكبد للفيرتين هي المصدر الفيسيولوجي للتخزين وتزويد الجسم بالحديد. وتميل نسبة الحديد المخزن في البالغين في الدول المتقدمة لتكون أقل عند النساء في سن الإنجاب والأطفال مقارنةً بالرجال وكبار السن. النساء اللّواتي يخسرن الحديد أكثر من غيرهن هنّ الحوامل والمرضعات كما يستخدمنَ هذا الاحتياطي في فترة الدورة الشهرية لتعويض النقص مما يؤثر على الهيموجلوبين الذي يحتوي على 500 ملغ أو أقل. يصل مستوى الحديد في الجسم ككل إلى 400 ملغ تقريباً، تُستخدم للبروتينات الخلوية التي تستفيد من الحديد لتنفيذ العمليات الخلوية الهامة مثل تخزين الاكسجين (الميوجلوبين)، أو تنتج طاقة لتفاعلات الأكسدة والاختزال (سيتوكرومز)، يذهب مقدار (3-4 ملغ) نسبياً إلى البلازما، الذي يرتبط مع الترانسفرين وهو نوع من أنوع الحديد.[5] نظراً لسميته، يبقى الحديد الذائب بتركيز منخفض في الجسم. يُهاجم نقص الحديد مستوى الحديد المخزن في الجسم أولاً، بالرغم من أن بعض الأعراض الغامضة غير المحددة قد ارتبطت بها. بما أن كميات كبيرة من الحديد تحتاج للهيموجلوبين، أنيميا نقص الحديد هي أول مظهر من المظاهر المرضية أو السريرية.
يُعاني الأشخاص المصابين بنقص الحديد من تلف الأعضاء أو الوفاة قبل نفاذه الحديد من الخلايا اللازم للعمليات الداخلية في الخلية مثل نقل الالكترونات. تُخزن بعمليات النظام الشبكي في الجسم الحديد من خلال تكسيره والهيموجلوبين من خلايا الدم الحمراء. ويتم تخزين الحديد أيضاً كصبغة تُدعى هيموسيديرين في الحالات المرضيّة، ويظهر الجزيء بشكل أساسي نتيجة لتلف الخلية. الذي غالبا مايكون مُبتلعاً من قبل البلعميات التي تجمع الفضلات من الأعضاء المتضرّرة. ويمكن أيضاً أن يوجد لدى بعض الأشخاص الذين يُعانون من تكدّس الحديد نظراً لتكرار تدمير خلايا الدم أو عمليات نقل الدم.
كيف يحصل الجسم على الحديد
يحتفظ الجسم بكمية كبيرة من الحديد الذي يعيد استخدامه بواسطة النظام الشبكي البطاني، التي تقضي على خلايا الدم الحمراء القديمة، وبينما يفقد الإنسان كمية بسيطة لكن ثابتة من خلال التعرق وتبديل خلايا الجلد وطبقات الغشاء المخاطي والجهاز الهضمي، والكمية اليومية الإجمالية التي يفقدها الشخص الطبيعي في الدول النامية بشكل تقريبي هي بمعدل 1 ملغ للرجال ومعدل يتراوج بين 2- 1.5 ملغ للنساء في اليوم خلال فترة الحيض المنتظمة، أما في الدول المتقدمة فإن الأشخاص الذين يعانون من التهابات طفيلية في الجهاز الهضمي يفقدون كمية أكبر مقارنة بالاشخاص العاديين،[2] يتوجب على الأشخاص الاستمرار في اكتساب الحديد طالما ظلت كمية الفقد ثابتة، ويتم اكتسابه بواسطة عملية منظمة تحت ظروف مضادة لزيادة الحديد.
امتصاص الحديد من الغذاء
تُعد عملية امتصاص عنصر الحديد من الغذاء عملية متغيرة وديناميكية، حيث نجد أنّ كمية الحديد المهضوم تفوق كمية الحديد الممتص وتتراوح نسبته مابين 5-35% تبعاً للظروف المتاحة ونوع الحديد، كما أن كفاءة عملية امتصاص الحديد تختلف حسب المصدر الغذائي، وبصفة عامة فإن الحديد ذو المصدر الحيواني يعتبر الأفضل من حيث كفاءة عملية الامتصاص، عملية امتصاص الحديد من الغذاء والذي يوجد على شكل أملاح الحديد كما هو الحال في المكملات الغذائية يختلف تبعاً لمدى احتياج الجسم للحديد ويشكل نسبة 10-20% من كمية الحديد، أما بالنسبة للحديد الممتص من المصادر الحيوانية وبعض المصادر النباتية يكون على شكل هيم الحديد وهو يتميز بأنه أكثر كفاءة مما يسمح بامتصاص 15-35% ، يوجد هيم الحديد في دم الحيوانات وهيم البروتينات الموجود في اللحوم والميتوكندريا، بينما يوجد في النباتات في ميتوكوندريا جميع الخلايا التي تستخدم عنصر الأكسجين من أجل عملية التنفس.
كما هو الحال في معظم معادن المواد الغذائية، يتم امتصاص أغلب كمية الحديد من الطعام المهضوم أو المكملات الغذائية في الاثنا عشر المعوية من خلال الخلايا المعوي المتواجدة في جدار الإثنا عشر، تمتاز هذه الخلايا بجزيئات خاصة تسمح بنقل الحديد في الجسم. يمكن امتصاص الحديد الغذائي كجزء من البروتين مثل بروتين الهيم أو يجب أن يكون في صيغة الفيروس.[6] يعمل انزيم الاختزال على الخلايا المعوية كالفرشاة على الحدود اختزال الفيرك إلى الفيروس. يوجد بروتين يسمى DMT 1 أي ناقل معدني ثنائي التكافؤ، ينقل جميع أنواع هذا البروتين في الجسم ثم ينقل الحديد من خلال الخلايا الغشائية للخلايا المعوية والخلية.
تستطيع هذه الخلايا المعوية أما تخزين الحديد على هيئة الفيريتين والتي يتم إنجازها بالفيريك وتتحد مع الابوفيريتين وهو بروتين يحمل الحديد في الدم (وفي هذه الحالة سوف يترك الحديد في الجسم في حالة موت الخلية أو انفصالها في البراز) أو يمكن أن تتحرك الخلية في الجسم باستخدام بروتين يسمى فيروبروتين،[7] ينظم الجسم مستويات الحديد عن طريق تنظيم هذه الخطوات، على سبيل المثال تنتج الخلايا سيتوكرومز معوية والناقل المعدني ثنائي التكافؤ والفيروبروتين للاستجابة لفقر دم نقص الحديد تعتمد نسبة امتصاص الحديد في جسم الإنسان على مجموعة متنوعة من العوامل المترابطة، ويتضمن كل مخازن الحديد، وهي مدى إنتاج نخاع العظم لكريات الدم الحمراء الجديدة، ومدى تركيز مادة الهيموجلووبين في الدم، ومدى احتواء الدم على الاكسجين. يمتص الجسم كمية أقل من الحديد أثناء فترة الالتهابات، توضح اكتشافات الآونة الأخيرة أن تحكم مادة الهيبسدن في مادة الفيروبرشن مسؤول عن متلازمة فقر الدم الذي هو يُعد من الأمراض المزمنة. بينما تُعد مادة الديستب الوحيدة في نقل الحديد عبر قناة الاثنى عشر، فإن مادة الفيروبروشن تتوزع على جميع الخلايا التي تقوم بتخزين الحديد في جميع أنحاء الجسم. ويُعد هذا التنظيم لمادة الفيروبورشن الطريقة الرئيسية لتنظيم كمية الحديد في الدورة الدموية. Fe3+ + إلى Fe2+ مادة الهيفيسن ومادة الفيرواكسيداس التي يمكن أن تؤكسد توجد في الأمعاء الدقيقة بشكل أساسي، تُساعد مادة الفيروبروشن في نقل الحديد عبر البسولترل حتى نهاية خلايا الامعاء، وما يعزز امتصاص الحديد من الغذاء هو وجود مادة فيتامين س ويقللها زيادة مادة الكالسيوم والزنك أو المغنيسيوم.[8][بحاجة لمصدر]
أسباب عوز الحديد
يمكن أن ينشأ عوز الحديد الوظيفي أو الفعلي لأسباب عديدة، وهي موضحة بالتفصيل في المقالة المخصصة لهذا الموضوع، يمكن تصنيف هذه الأسباب إلى مجموعات عديدة:
- زيادة حاجة الجسم للحديد، التي لا يمكن التعويض عنها من خلال اتباع حمية غذائية.
- خسارة الجسم لكميات كبيرة من الحديد (غالبا ما يكون ذلك من خلال فقدان الدم).
- سوء التغذية، الذي قد يحصل من خلال نقص كمية الغذاء الذي يحتوي على الحديد أو استهلاك الغذاء المثبط لامتصاص الحديد وتشمل الكالسيوم وبعض البقوليات التي تحتوي على حمض الفايتت والشاي الأسود والقهوة لاحتوائها على مادة التنن.
- عدم القدرة على امتصاص الحديد لفقدان الجدار المبطن للأمعاء، كالخضوع لجراحة إستئصال الإثنا عشر أو بسبب أمراض أخرى مثل مرض كرون أو مرض سيليك والتي تسبب نقصان السطح المهيأ لامتصاص الحديد.
- الالتهابات المؤدية لانقطاع إفراز الحديد إلى الدم بعد امتصاصها وتتسبب به مادة الهبسدين.
تراكم الحديد
تراكم الحديد أو فرط الحديد هو مصطلح طبي يعني زيادة امتصاص كميات كبيرة من الحديد في الغشاء المخاطي الذي ينتج عادة عن اختلال جيني مما يؤدي إلى امتصاص كميات كبيرة من الحديد في الجهاز الهضمي فتترسب في الكبد مما يؤدي إلى الإصابة بسرطان الكبد. وفي حالة زيادة الحديد المؤدي لتكسر أغشية جدرن الأمعاء نفسها كإفراط الأطفال في تناول كميات من أقراص الحديد المخصصة للبالغين، ويمكن أيضاً عبور كميات كبيرة من الحديد الدورة الدموية مما يتسبب في الإصابة بمتلازمة مرضية مميتة. وقد يصيب هذا التراكم للحديد في الدورة الدموية بعض الخلايا المهمة في الكبد والقلب والأعضاء الأخرى النشطة أيضاً. تنتج سمية الحديد عند تجاوز مستوى الحديد الذي يدور في الجسم مستوى الترانسفيرين المتوفر في الجسم واللازم للارتباط به وتنظيم نسبة امتصاصة، وبالتالي تحدث سمية الحديد بسبب ظروف استثنائية كالاستهلاك المفرط لأقراص الحديد[9] ولا تسببها التغييرات في نسب الحديد الموجودة في النظام الغذائي الذي يتبعه الشخص، تسبب سمية الحديد الحادة التي تنتج من ابتلاع الحديد تلف خطير في غشاء القناة الهضمية المخاطي وغيره من الأضرار الأخرى. تحدث سمية الحديد المزمنة عادة نتيجة لعدة متلازمات تحميل مفرط للحديد المزمنة والمرتبطة بالأمراض الوراثية أو نتيجة لعمليات نقل الدم المتكررة أو أسباب أخرى. وفي هذه الحالات فإن مخازن الحديد لدى الشخص البالغ تصل نسبة الحديد فيها إلى 50 غ (أي10 مرات أكثر من مستوى الحديد في الجسم الطبيعي) أو أكثر. تتضمن أمثلة تقليدية على التحميل المفرط للحديد الوراثي، داء ترسب الأصبغة الدموية الوراثية وهناك نوع آخر أشد خطورة هو داء ترسب الأصبغة الدموية اليفعي الذي تسببه طفرات أحد الجينين، RGMc الذي يسمى أيضاً هيميجوفلين أو جين HAMP في الجينات الثلاثة الموجهة الدافعة للمجموعة الجزيئية[10] ، أو جين HAMP (الذي يشفر الببتيد التنظيمي للحديد).
كيف تحصل الخلايا على الحديد من الجسم
كما تم مناقشته سابقا أن 60% أو أكثر من كمية الحديد في الجسم تتواجد في جزيئات الهيموجلوبين لخلايا الدم الحمراء وجزء كبير من الباقي في البروتين المخزن للحديد (ferritin storage) في الكبد وغيرها من الأماكن، مع العلم أن الكمية تتفاوت من شخص لآخر، عند نضوج خلايا الدم الحمراء تتحلل وتنغمس بواسطة by specialized scavenging macrophages كما تعرف بالخلايا الكانسة. هذه الخلايا تبطن الهيموجلوبين الذي يحتوي على الحديد وتحلله وتضع الحديد على جزيئات ترانسفيرين (transferrin molecules) ومن ثم تصدر مركب الحديد – الترانسفيرين العائد إلى الدم، معظم كمبات الحديد المستخدمة في إنتاج خلايا الدم ناتجة من دروة إعادة استخدام الهيموجلوبين، تُستخدم كل الخلايا بعضاً من الحديد والذي تحصل عليه أثناء الدورة الدموية، وبما أن الحديد وثيق الارتباط ببروتين الترانسفيرين فإن الخلايا في جميع أنحاء الجسم لديها مستقبلات لمركبات ترانسفيرين الحديد على سطحها، وهذه المستقبلات تمتص وتذيب كل من البروتين والحديد خلال عملية الالتقام الخلوي بواسطة المستقبلات ومن ثم تنقل الخلية الحديد إلى الفيرتين وهو جزيء من مخزون الحديد الداخلي المتواجد في كل الخلايا. وبهذا سيزداد إنتاج مستقبلات الترانسفيرين ويتناقص إنتاج الفريتين[11]
التنظيم حسب الموقع
تنظيم مستوى الحديد هي مهمَّة الجسم بكامله كما هي مهمة كل خلية مستقلة؛ فعندما يكون مستوى الحديد في الجسم منخفضاً ينخفض هرمون الهيبسيدن في النسيج الذي يبطن الإثني عشر وهذا يسمح للزيادة في نشاط هرمون الفيروبروتين ومحفزاً بذلك امتصاص الحديد في الجهاز الهضمي؛ وعندما يكون هناك حديد فائض فإنه يتم تحرير هرمون الهيبسيدن أكثر وبالتالي تعيق نشاط هرمون الفيروبرتين أكثر وتقلل بذلك من امتصاص الحديد. نقص الحديد في كل خلية أحادية يسبب في استجابة عنصر ترابط البروتين لاستجابة عناصر الحديد لناقل الحمض النووي الريبي مع ناقلات هرمون الترانزفيرين، مما يؤدي إلى زيادة إنتاج مستقبلات هرمون الترازنفيرين وهذه المستقبلات تزيد من ارتباط هرمون الترانزفيرين في الخلية، وبالتالي تحفيز امتصاص الحديد.
أمراض تنظيم الحديد
آلية حدوث معظم الأشكال المختلفة لمرض ترسب الأصبغة الدموية لدى البالغين والتي تشكّل معظم اضطرابات الحديد الجيني لاتزال بدون حل؛ بينما يحاول العلماء التعرف على الطفرات الوراثية المسببة لمختلف أنواع أمراض التصبغات الدموية لدى الأشخاص البالغين، وحالياً وجّهوا انتباههم إلى معرفة الوظائف الطبيعية لهذه الطفرات الوراثية.
المراجع
- Andrews NC (ديسمبر 1999)، "Disorders of iron metabolism"، N. Engl. J. Med.، 341 (26): 1986–95، doi:10.1056/NEJM199912233412607، PMID 10607817.
- Conrad ME, Umbreit JN (أبريل 2000)، "Disorders of iron metabolism"، N. Engl. J. Med.، 342 (17): 1293–4، doi:10.1056/NEJM200004273421716، PMID 10787338.
- Schrier SL, Bacon BR (07 نوفمبر 2011)، "Iron overload syndromes other than hereditary hemochromatosis"، UpToDate، مؤرشف من الأصل في 5 نوفمبر 2018، اطلع عليه بتاريخ 11 مارس 2012.
- Ganz T (أغسطس 2003)، "Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation"، Blood، 102 (3): 783–8، doi:10.1182/blood-2003-03-0672، PMID 12663437.
- Camaschella C, Schrier SL (07 نوفمبر 2011)، "Regulation of iron balance"، UpToDate، مؤرشف من الأصل في 5 نوفمبر 2018، اطلع عليه بتاريخ 11 مارس 2012.
- McKie AT, Barrow D, Latunde-Dada GO؛ وآخرون (مارس 2001)، "An iron-regulated ferric reductase associated with the absorption of dietary iron"، Science، 291 (5509): 1755–9، doi:10.1126/science.1057206، PMID 11230685.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Fleming RE, Bacon BR (أبريل 2005)، "Orchestration of iron homeostasis"، N. Engl. J. Med.، 352 (17): 1741–4، doi:10.1056/NEJMp048363، PMID 15858181.
- "Iron"، Ohio State University Extension Fact Sheet، Ohio State University، مؤرشف من الأصل في 2 نوفمبر 2015، اطلع عليه بتاريخ 25 يونيو 2012.
- Rudolph CD (2003)، Rudolph's pediatrics، New York: McGraw-Hill, Medical Pub. Division، ISBN 0-07-112457-8.
- Severyn CJ, Shinde U, Rotwein P (سبتمبر 2009)، "Molecular biology, genetics and biochemistry of the repulsive guidance molecule family"، Biochem. J.، 422 (3): 393–403، doi:10.1042/BJ20090978، PMID 19698085.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Stryer L, Berg JM, Tymoczko JL (2002)، Biochemistry، San Francisco: W.H. Freeman، ISBN 0-7167-4684-0، مؤرشف من الأصل في 09 ديسمبر 2019.
{{استشهاد بكتاب}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
- بوابة أيض
- بوابة طب
- بوابة علم وظائف الأعضاء
- بوابة الكيمياء الحيوية