إيلاستين
إيلاستين (بالإنجليزية: Elastin) هو بروتين يقع في الأنسجة الضامة التي هي مرنة أساسا، ويسمح للعديد من الأنسجة في الجسم باستعادة شكلها بعد تمتدها أو تلفها.[1] والإيلاستين يساعد الجلد على العودة إلى وضعه الأصلي عندما يتعرض لتلف أو تغير عرضي. ويعتبر الإيلاستين هو أيضا مهم في عمل الأنسجة الحاملة في أجسام الفقاريات ويتكون في الأعضاء التي تؤدي حركات مرنة مثل الرئتين والأوعية الدموية ويشترك في تشكيلها. في البشر، يرمز للإيلاستين بواسطة جين ELN.[2]
| Elastin | |||||||
|---|---|---|---|---|---|---|---|
| المعرفات | |||||||
| الأسماء المستعارة | tropoelastin, elastin, ELN | ||||||
| معرفات خارجية | |||||||
| أورثولوج | |||||||
| الأنواع | الإنسان | الفأر | |||||
| أنتريه | n/a | ||||||
| Ensembl | n/a | n/a | |||||
| يونيبروت |
|
| |||||
| RefSeq (مرسال ر.ن.ا.) |
|
| |||||
| RefSeq (بروتين) |
|
| |||||
| الموقع (UCSC | n/a | ||||||
| بحث ببمد | n/a | ||||||
| ويكي بيانات | |||||||
| |||||||
الوظيفة
يقوم جين ELN بتشفير بروتين هو أحد مكونين للألياف المرنة. البروتين المشفر غني بالأحماض الأمينية الكارهة للماء مثل الجلايسين والبرولين، والتي تشكل مناطق متحركة كارهة للماء تحدها روابط متقاطعة بين بقايا اللايسين.[3] تم العثور على نسخ متغيرة متعددة ترميزية للأشكال الإسوية المختلفة لهذا الجين. المركب الطليعي للإيلاستين القابل للذوبان هو تروبولاستين.[4] يتوافق توصيف الاضطراب مع آلية الارتداد المرن المدفوعة بالانتروبيا. يُستنتج أن الاضطراب التوافقي هو سمة من سمات بنية ووظيفة الإيلاستين.[5]
الأهمية السريرية
ترتبط عمليات الحذف (الخبن) والطفرات في هذا الجين بتضيق الصمام الأبهري (SVAS) وانحلال النسيج المرن المعمم السائد.[6] تشمل العيوب الأخرى المرتبطة بالإيلاستين متلازمة مارفان وانتفاخ الرئة الناجم عن نقص ألفا 1-أنتيتريبسين وتصلب الشرايين ومتلازمة بوشكي أوليندورف ومرض مينكيس والورم الأصفر الكاذب المرن ومتلازمة ويليامز.[7]
تنكس النسيج المرن
المُران هو تراكم الإيلاستين في الأنسجة، وهو شكل من أشكال الأمراض التنكسية. هناك العديد من الأسباب، ولكن السبب الأكثر شيوعًا هو تنكس النسيج المرن السفعي، المعروف أيضًا باسم تنكس النسيج المرن الشمسي، والذي ينتج عن التعرض الطويل والمفرط للشمس، وهي عملية تعرف باسم الشيخوخة الضوئية. تشمل الأسباب غير الشائعة للإصابة بالمران الجلدي: تنكس النسيج المرن الساعي الثاقب، والمرن التكلسي الثاقب والمرن البؤري الخطي.
| الحالة | السمات المميزة | التشريح المرضي |
|---|---|---|
| تنكس النسيج المرن السفعي | يحل الإيلاستين محل ألياف الكولاجين في الأدمة الحليمية والأدمة الشبكية | 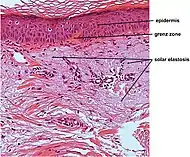 |
| تنكس النسيج المرن الساعي الثاقب | الألياف المرنة المتدهورة والقنوات المثقبة عبر الجلد (السهم في الصورة يشير إلى إحداها) | 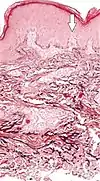 |
| تنكس النسيج المرن التكلسي الثاقب | تكتل الألياف المرنة القصيرة في الأدمة.[8] | 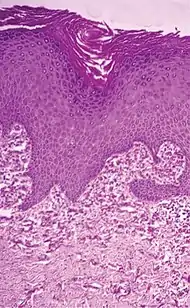 |
| تنكس النسيج المرن البؤري الخطي | تراكم المواد المرنة المجزأة داخل الأدمة الحليمية والقضاء عبر الجلد على الألياف المرنة.[8] | 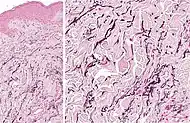 |
البنية

في الجسم، يرتبط الإيلاستين عادةً ببروتينات أخرى في الأنسجة الضامة. الألياف المرنة في الجسم عبارة عن مزيج من الإيلاستين غير المتبلور والفايبريلين الليفي. يتكون كلا المكونين بشكل أساسي من الأحماض الأمينية الأصغر مثل الجلايسين والفالين والألانين والبرولين.[7][9] يتراوح إجمالي الإيلاستين من 58 إلى 75٪ من وزن الشريان الجاف المنزوع الدهن في شرايين الكلاب الطبيعية.[10] تظهر المقارنة بين الأنسجة الطازجة والمهضومة أنه عند إجهاد 35٪ ،يحمل الإيلاستين ما لا يقل عن 48٪ من الحمل الشرياني ، ويعزى 43٪ على الأقل من التغير في تصلب الأنسجة الشريانية إلى تغير تصلب الإيلاستين.[11]
توزيع الأنسجة
يؤدي الإيلاستين وظيفة مهمة في الشرايين كوسيط لانتشار موجات الضغط للمساعدة في تدفق الدم وهو وفير بشكل خاص في الأوعية الدموية المرنة الكبيرة مثل الشريان الأورطي. الإيلاستين مهم أيضًا في الرئتين والأربطة المرنة والغضاريف المرنة والجلد والمثانة. وهو موجود في جميع الفقاريات فوق الأسماك عديمة الفك.[12]
المميزات
الإيلاستين هو بروتين طويل العمر، وعمره النصفي يزيد عن 78 عامًا في البشر.[13]
الأبحاث السريرية
تمت دراسة جدوى استخدام التروبولاستين البشري المؤتلف لتمكين إنتاج ألياف الإيلاستين لتحسين مرونة الجلد في الجروح والندبات.[14][15] بعد الحقن تحت الجلد لتروبولاستين بشري مؤتلف في جروح جديدة، لم يكن هناك تحسن في التندب أو مرونة التندب النهائي.[14][15]
التخليق الحيوي
المركبات الطليعية للتروبولاستين
يتكون الإيلاستين من خلال ربط العديد من جزيئات بروتين تروبولاستين الصغيرة القابلة للذوبان (50-70 كيلو دالتون)، لجعل المركب النهائي الضخم غير قابل للذوبان ومتين. لا تتوافر جزيئات التروبولاستين غير المرتبطة عادة في الخلية، لأنها تصبح متشابكة في ألياف الإيلاستين فور توليفها بواسطة الخلية وأثناء تصديرها إلى النسيج البيني خارج الخلية. يتكون كل تروبولاستين من سلسلة من 36 نطاق بروتيني صغير، يزن كل منها حوالي 2 كيلو دالتون في تشكيل ملف عشوائي. يتكون البروتين من نطاقات متناوبة كارهة للماء ومحبة للماء، والتي يتم ترميزها بواسطة إكسونات منفصلة، بحيث يعكس هيكل النطاق لتروبولاستين تنظيم إكسون للجين. تحتوي النطاقات المحبة للماء على أشكال (Lys-Ala (KA و (Lys-Pro (KP التي تشارك في التشابك أثناء تكوين الإيلاستين الناضج. في نطاقات KA، تظهر بقايا اللايسين على شكل أزواج أو ثلاثة توائم مفصولة بواحد أو ثلاثة من بقايا ألانين (مثل AAAKAAKAA) بينما في نطاقات KP، يتم فصل بقايا اللايسين بشكل أساسي عن طريق بقايا البرولين (مثل KPLKP).
التجميع
يتجمع التروبولاستين عند درجة الحرارة الفسيولوجية بسبب التفاعلات بين النطاقات الكارهة للماء في عملية تسمى الغروانية. هذه العملية قابلة للعكس ويتم التحكم فيها ديناميكيًا ولا تتطلب تحلل البروتين. تتشكل غرونيات غير قابلة للذوبان عن طريق التشابك الذي لا رجعة فيه.
التشابك
لصنع ألياف الإيلاستين الناضجة، يتم ربط جزيئات التروبولاستين عبر بقايا اللايسين مع جزيئات ديسموسين وإيزوديسموسين المترابطة. الإنزيم الذي يؤدي الربط المتشابك هو أوكسيديز ليسيل، باستخدام تفاعل تخليق تشيشيبابين للبيريدين في الجسم الحي.[16]
البيولوجيا الجزيئية
.png.webp)
في الثدييات، يحتوي الجينوم على جين واحد فقط من التروبولاستين، يسمى ELN. إن جين ELN البشري عبارة عن مقطع 45 كيلو بايت على الكروموسوم 7، وله 34 إكسونات تقطع بحوالي 700 إنترون، مع كون الإكسون الأول عبارة عن ببتيد إشعاري يحدد موقعه خارج النسيج البيني للخلية. يشير العدد الكبير من الإنترونات إلى أن إعادة التركيب الجيني قد تساهم في عدم استقرار الجين، مما يؤدي إلى أمراض مثل SVAS. غن مصطلح التروبولاستين mRNA ينظم بدرجة عالية تحت ثمانية مواقع مختلفة على الأقل لبدء النسخ.
يتم إنتاج المتغيرات الخاصة بالأنسجة من الإيلاستين عن طريق التضفير البديل لجين التروبولاستين. هناك ما لا يقل عن 11 من الأشكال الإسوية للتروبولاستين البشري المعروف. تخضع هذه الأشكال الإسوية للتنظيم النمائي، ولكن هناك اختلافات طفيفة بين الأنسجة في نفس المرحلة التنموية.[7]
المراجع
- Curran ME, Atkinson DL, Ewart AK, Morris CA, Leppert MF, Keating MT (1993)، "The elastin gene is disrupted by a translocation associated with supravalvular aortic stenosis"، Cell، 73 (1): 159–68، doi:10.1016/0092-8674(93)90168-P، PMID 8096434.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|شهر=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Curran, Mark E.؛ Atkinson, Donald L.؛ Ewart, Amanda K.؛ Morris, Colleen A.؛ Leppert, Mark F.؛ Keating, Mark T. (09 أبريل 1993)، "The elastin gene is disrupted by a translocation associated with supravalvular aortic stenosis"، Cell، 73 (1): 159–168، doi:10.1016/0092-8674(93)90168-P، PMID 8096434، S2CID 8274849.
- "Entrez Gene: elastin"، مؤرشف من الأصل في 23 ديسمبر 2020.
- "Elastin (ELN)"، مؤرشف من الأصل في 13 مارس 2017، اطلع عليه بتاريخ 31 أكتوبر 2011.
- "Structural disorder and dynamics of elastin"، Biochemistry and Cell Biology، 88 (2): 239–50، أبريل 2010، doi:10.1139/o09-161، PMID 20453927.
- "Entrez Gene: elastin"، مؤرشف من الأصل في 23 ديسمبر 2020.
- Vrhovski, Bernadette؛ Weiss, Anthony S. (15 نوفمبر 1998)، "Biochemistry of tropoelastin"، European Journal of Biochemistry، 258 (1): 1–18، doi:10.1046/j.1432-1327.1998.2580001.x، PMID 9851686.
- Hosen, Mohammad J.؛ Lamoen, Anouck؛ De Paepe, Anne؛ Vanakker, Olivier M. (2012)، "Histopathology of Pseudoxanthoma Elasticum and Related Disorders: Histological Hallmarks and Diagnostic Clues"، Scientifica، 2012: 1–15، doi:10.6064/2012/598262، ISSN 2090-908X، PMC 3820553، PMID 24278718.-Creative Commons Attribution 3.0 Unported license
- "Elastic fibres"، Journal of Cell Science، 115 (Pt 14): 2817–28، يوليو 2002، PMID 12082143.
- "Collagen and elastin content in canine arteries selected from functionally different vascular beds"، Circulation Research، 19 (2): 394–399، أغسطس 1966، doi:10.1161/01.res.19.2.394، PMID 5914851.
- "Changes in the structure-function relationship of elastin and its impact on the proximal pulmonary arterial mechanics of hypertensive calves"، American Journal of Physiology. Heart and Circulatory Physiology، 295 (4): H1451–9، أكتوبر 2008، doi:10.1152/ajpheart.00127.2008، PMC 2593497، PMID 18660454.
- "Evolution of elastin structure"، Elastin and Elastic Tissue، Advances in Experimental Medicine and Biology، ج. 79، 1977، ص. 291–312، doi:10.1007/978-1-4684-9093-0_27، ISBN 978-1-4684-9095-4، PMID 868643.
- Toyama, Brandon H.؛ Hetzer, Martin W. (يناير 2013)، "Protein homeostasis: live long, won't prosper"، Nature Reviews. Molecular Cell Biology، 14 (1): 55–61، doi:10.1038/nrm3496، ISSN 1471-0072، PMC 3570024، PMID 23258296.
- Souto, Maria C. (09 يناير 2020)، "New Nanotechnologies for the Treatment and Repair of Skin Burns Infections"، International Journal of Molecular Sciences، 21 (2): 393، doi:10.3390/ijms21020393، PMC 7013843، PMID 31936277، مؤرشف من الأصل في 24 ديسمبر 2020، اطلع عليه بتاريخ 20 أغسطس 2020.
- Xie, Hua (01 سبتمبر 2017)، "Treatment of Burn and Surgical Wounds With Recombinant Human Tropoelastin Produces New Elastin Fibers in Scars"، Journal of Burn Care & Research، 38 (5): e859–e867، doi:10.1097/BCR.0000000000000507، PMID 28221299، S2CID 39251937، مؤرشف من الأصل في 24 ديسمبر 2020، اطلع عليه بتاريخ 20 أغسطس 2020.
- "Two new elastin cross-links having pyridine skeleton. Implication of ammonia in elastin cross-linking in vivo"، The Journal of Biological Chemistry، 276 (16): 12579–12587، أبريل 2001، doi:10.1074/jbc.M009744200، PMID 11278561.
وصلات اضافية
- Elastin في المكتبة الوطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).
- صور نسيجية: 21402loa — نظام تعلم علم الأنسجة في جامعة بوسطن
- GeneReviews/NIH/NCBI/UW entry on Williams or Williams-Beuren Syndrome
- The Elastin Protein
- Microfibril
- بوابة الكيمياء الحيوية
- بوابة علم الأحياء الخلوي والجزيئي