جين
المُوَرِّثَة (الجمع: مورثات) أو الجينة[1] أو الجين[2] أو إرْثين[3] (الجمع: جينات) (بالإنجليزية: Gene) هي الوحدات الأساسية للوراثة في الكائنات الحية. وضمن هذه المورثات يتمُّ تشفير المعلومات المهمة لتكوين أعضاء الجنين والوظائف العضوية الحيويّة له. تتواجد المورثات عادة ضمن المادة الوراثيّة للمتعضية التي تمثلها الدنا (DNA) أو في بعض الحالات النادرة في الرنا (RNA).
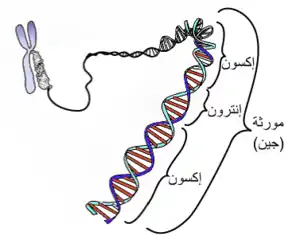

بالتالي فإن هذه المورثات هي التي تحدد تشكيل وتطور وسلوكيات الكائن الحي. والفوارق الجسدية وبعض الفوارق النفسية بين الأفراد تعود لفوارق في المورثات التي تحملها هذه الأفراد.
المورثة هي قطعة من إحدى سلسلتي الدنا تحتل موضعاً معيناً على هذه السلسلة. وتحدد المورثة بعدد النوكليوتيدات الدّاخلة في تركيبها ونوعها وترتيبها، وهي قابلة للتغير نتيجة الطفرات التي قد تحدث فيها.
تنتقل المادة الوراثيّة من جيل لآخر، خلال عملية التكاثر، بحيث يكتسب كل فرد جديد نصف مورثاته من أحد والديه والنصف الآخر من الوالد الآخر. في بعض الحالات يمكن للمادة الوراثيّة أن تنتقل بين أفراد غير أقرباء بعمليات مثل التعداء أو عن طريق الحمات (الفيروسات).
تتحكم الجينات في الوراثة من الوالدين إلى الأبناء، كما تتحكم أيضاً في تكاثر الخلايا وفي وظائفها اليومية المستمرة، وتحكم الجينات وظائف الخلية بتحديد المواد التي تركبها في داخل الخلية، من تحديد البنيات والإنزيمات والمواد الكيميائية التي ستتولد فيها بشكل أساسي.[4]
تحوي المورثات المعلومات الأساسية لبناء البروتينات والإنزيمات والمواد الحيوية اللازمة لبناء أعضاء الجسم، وإنتاج المواد (البروتينات والإنزيمات) في الأعضاء المختلفة لتقوم بوظائفها، كما أنها تحمل الساعة البيولوجية التي يتطور بها الكائن الحي من بويضة مخصبة إلى تكوين الأعضاء إلى مرحلة الطفولة ثم البلوغ والنضج والشيخوخة.
مورثات في النبات والحيوان
المورثات (جينات) هي حوامل صفات الآباء إلى الأبناء، وينطبق ذلك على جميع النباتات والحيوانات ووحيدات الخلايا، تحمل الصبغيات المورثات وبها يتحدد نوع الجيل التالي وصفاته، ويرجع اكتشاف انتقال الصفات من الآباء إلى الأبناء إلى الراهب النمساوي جريجور مندل الذي اهتم بدراسة نبات البازلاء خلال الأعوام 1860 - 1868، لكن مندل لم يعرف الصبغيات أو تفاصيل تكوينها، فقد اقتصرت تجاربه على حبوب اللقاح نفسها. 'تشترك النباتات والحيوانات في تكوينها الأصلي المكون من أربعة قواعد وهي:'
عدد المورثات وعدد الأزواج القاعدية
| كائن حي / نظام حيوي | عدد الجينات | عدد الأزواج القاعديةبالكامل |
|---|---|---|
| بقة الماء[5] | 30.907 | 2·108 |
| نبات | >25.000 | 108–1011 |
| إنسان[6] | ~22.500 | 3·109 |
| ذبابة | 12.000 | 1,6·108 |
| فطر | 6.000 | 1,3·107 |
| بكتيريا | 180–7.000 | 105−107 |
| إشريكية قولونية | ~5.000 | 4,65·106 |
| بكتيريا Carsonella ruddii | 182 | 160.000 |
| DNA-Virus | 10–300 | 5.000–200.000 |
| RNA-Virus | 1–25 | 1.000–23.000 |
| فيروس شكلي | 0 | 150–400 |
بالنسبة للإنسان فتحتوي نواة الخلية في الكرموسومات على الدنا الذي يتكون من 3 مليارات زوجا قاعدياً، في حين أن الجينات وهي المسؤولة عن تركيب الجسم وأعضائه والنمو والبلوغ وتكوين البروتينات المختلفة والإنزيمات ذات الوظائف المتعددة فيبلغ عددها 22.500 جين، وهي موزعة على 46 من الكروموسومات في الإنسان، ومجموعهم يشكل الدنا. إذا حدث خلل في تركيب أحد الجينات فإنه من الممكن أن تكون له عواقب وخيمة على سلامة وصحة الفرد.
يختلف طول الجينات إلى حدود كبيرة، فبعضها له طول يصل إلى مئات الأزواج القاعدية وأخرى قد يصل طولها إلى آلاف من الأزواج القاعدية، وهي تقوم بإنتاج أنواع مختلفة من البروتينات والإنزيمات اللازمة لتكوين الجسم والقيام بالوظائف الحيوية، بين الجينات على الدنا توجد آلاف من أزواج القواعد لا يزال البحث في دراستها جاريا، فهي تبدو حالياً كما لو لم يكن لها وظيفة.[7]
المخطط العام للتحكم الجيني
كل جين هو حمض نووي يسمى الحمض الريبي النووي منقوص الأكسجين (الدنا) DNA، يحكم أوتوماتيكياً تكوين حمض نووي آخر يسمى الحمض الريبي النووي (الرنا) RNA الذي ينتشر في الخلية ويتحكم في تكوين بروتين نوعي. وبما أنه يوجد حوالي 22.000 جين تقريباً في خلايا الإنسان فمن الممكن من الناحية النظرية تشكيل عدد كبير من البروتينات الخلوية المختلفة، وبعض هذه البروتينات هي بروتينات بنيوية structural proteins تكوِّن بالترافق مع مختلف الدهون والكربوهيدرات بنيات مختلف العُضيات organlles. ولكن أكثر البروتينات هي إنزيمات تحفز مختلف العمليات الكيميائية في الخلايا، مثل الإنزيمات التي تنشط كل العمليات التأكسدية التي تجهز الطاقة للخلية والتي تنشط تركيب مختلف المواد الحيوية كالدهون والجليكوجين والأدينوزين ثلاثي فوسفات ATP، وما شابه ذلك.[4]
و توجد الجينات بشكل تكون فيه ملتصقة ببعضها البعض عند نهاياتها بأعداد كبيرة مكونة جزيئات حلزونية طويلة جداً، ومزدوجة الخيوط، ومكونة من الحمض الريبي النووي منقوص الأكسجين DNA، وله وزن جزيئي يقاس بالبلايين، يبين الشكل قطعة صغيرة من هذا الجزيء الذي يتكون من مركبات عديدة بسيطة ومرتبة بنمط منظم كما يلي.
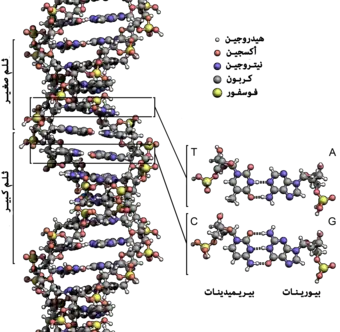
الكتل البنائية الأساسية للـ DNA
يبين الشكل المركبات الكيميائية الأساسية المشتركة في تركيب الـ DNA وهي تشمل:
- حمض الفوسفوريك
- سكر يسمى الريبوز منقوص الأكسجين deoxyribose
- أربع قواعد نيتروجينية؛ اثنان منها من البيورينات هما الأدينين (A) adenine والجوانين (G) guanine، والآخران من البيريميدينات وهما الثيمين (T) thymine والسيتوزين (C) cytosine .
و يكَوِن حمض الفسفوريك والريبوز المنقوص الأكسجين خيطين حلزونيين لجزيء الـ DNA، وتوجد بين الخيطين قواعد تربطهما ببعضهما.
النوويدات (النيكليوتيدات) nucleotides
إن المرحلة الأولى لتكوين الـ DNA هي اتحاد جزيء واحد من حمض الفسفوريك مع جزيء واحد من سكر الريبوز منقوص الأكسجين مع واحد من القواعد الأربعة لتكوين نوكليوتيد (نويد) واحد.[8] و بذلك يمكن أن تتكون أربعة أنواع مختلفة من النوويدات واحد لكل نوع من القواعد الأربع؛ وهي الحمض النووي أدينيليك منقوص الأكسجين والحمض النووي جوانيليك منقوص الأكسجين والحمض النووي سيتيدليك منقوص الأكسجين.
تنظيم النوويدات لتكوين خيطي DNA مرتبطين برابطة رخوة
ترتبط الأعداد المضاعفة من النوويدات مع بعضها البعض لتكوين الـ DNA بشكل يتناوب فيه حمض الفوسفوريك مع سكر الريبوز منقوص الأكسجين في الخيطين المنفصلين. ويرتبط هذان الخيطان مع بعضهما بروابط رخوة من قاعدتي البيورين والبيريميدين؛ ولكن من الملاحظ أن:
- القاعدة البيورينية (أدينين) ترتبط دائما مع القاعدة البيريمدينية (ثيمين).
- القاعدة البيورينية (جوانين) ترتبط دائما مع القاعدة البيريميدينة (سيتوزين).
فيكون سياق الأزواج المتتامة للقواعد هو: CG ، CG ، GC ، TA ، GC ، AT ، AT.[9] وترتبط هذه القواعد مع بعضها البعض بروابط هيدروجينية رخوة تمثلها الخطوط المتقطعة الشكل، وتتمكن هذه الخيوط بسبب رخاوة هذه الروابط من الانفصال عن بعضها بسهولة وهي تقوم بذلك مرات عديدة أثناء دورات عملها في الخلية. ولوضع الـ DNA في منظوره الفيزيائي المناسب يتم التقاط نهايتيه وفتلهما بشكل حلزوني؛ حيث توجد عشرة أزواج من النوويدات في كل دورة كاملة من الحلزون في جزيء الـ DNA.

الرمز الجيني genetic code
تنبع أهمية الـ DNA من قابليته على التحكم في تكوين المواد الأخرى في الخلية، ويقوم بذلك عن طريق مايسمى بالترميز الجيني genetic code. فعندما ينفصل خيطا جزيء الـ DNA عن بعضهما تنكشف قاعدتا البيورين والبيريميدين، وتبرز لجهتي كل من الخيطين، وتكوِّن هذه القواعد البارزة الترميز الجيني.[10]
وقد أوضحت دراسات بحثية في الأعوام الأخيرة بأن الترميز الجيني يتكون من سلسلة من ثلاثيات القواعد، أي أن كل ثلاث قواعد متعاقبة تكوِّن كلمة رمزية جينية واحدة تسمى كودون. وتتحكم الثلاثيات المتعاقبة (الكودونات) في تكوين الأحماض الأمينية في جزيء البروتين أثناء تكوينه في الخلية؛ حيث يكون كلاً من خيطي جزيء الـ DNA يحمل رمزه الجيني الخاص به. فمثلاً يحمل الخيط العلوي الرمز الجيني (الذي يقرأ من اليسار إلى اليمين) CTT ،AGA ،GGC، وتكون الثلاثيات مفصولة عن بعضها البعض بالأسهم، وهذه الثلاثيات الخاصة السابقة مسؤولة عن الأحماض الأمينية الثلاثة: حمض البرولين، وحمض السيرين، وحمض الجلوتاميك، في جزيء البروتين.
تركيب الـ RNA
ينفصل خيطا جزيء الـ DNA عن بعضهما مؤقتا أثناء تكوين الـ RNA، ويستعمل أحدهما بعدئذ كمرصاف لتركيب جزيئات الـ RNA، وتؤدي الثلاثيات الرمزية في الـ DNA إلى تكوين ثلاثيات رمزية code triplets تكميلية (تتميمة) تسمى روامز codons في الـ RNA، وتتحكم هذه الروامز بدورها في نسق الأحماض الأمينية في البروتين الذي سيركب بعد ذلك في سيتوبلازم الخلية. وعندما يستعمل أحد خيطي الـ DNA بهذه الطريقة لتكوين الـ RNA يبقى الخيط الآخر معطلاً، وخيط الـ DNA في الصبغي chromosome هو جزيء كبير جدا لدرجة أنه يحمل رموز لحوالي 4000 جين في المعدل.[11]
المجموعات البنائية الأساسية للـ RNA
إن المجموعات البنائية الأساسية للـ RNA هي تقريبا نفس تلك التي للـ DNA فيما عدا اختلافين اثنين، أولهما هو أن سكر الريبوز المنقوص الأكسجين لايستعمل في تكوين الـ RNA ويدخل بدلا منه سكر ثان ذو تركيب مختلف قليلا، والاختلاف الثاني هو حلول بريميدين آخر هو اليوراسيل uracil بدلا من الثيمين في تكوين الـ RNA.
تكوين نوويدات الـ RNA
تكون الكتل البنائية القاعدية للـ RNA أولا نوويدات شبيهة بالتي تم وصفها في تركيب الـ DNA.
[12] و هنا تستعمل أيضا أربعة نوويدات في تكوين الـ RNA وتحوي هذه النوويدات القواعد النووية الأدينين والجوانيين والسيتوزين واليوراسيل، ومن الملاحظ أنها هي نفس قواعد الـ DNA فيما عدا واحداً منها إذ استعمل اليوراسيل في تركيب الـ RNA عوضا عن الثيمين المستعمل في تكوين الـ DNA.
تنشيط النوويدات
إن الخطوة الثانية في تركيب الـ RNA هي تنشيط النوويدات، ويتم ذلك بإضافة جذرين فوسفاتيين لكل نوويد لتكوين ثلاثيات الفوسفات، ويتحد الفوسفاتان الأخيران مع النوويد بروابط فوسفاتية عالية الطاقة مشتقة من ATP الخلية، وتنتج عن عملية التنشيط هذه كميات كبيرة من الطاقة التي توفر لكل من النوويدات، وتستعمل هذه الطاقة في تحريض التفاعلات الكيميائية التي تؤدي إلى تكوين سلسلة الـ RNA.
تحول رمز الدنا إلى رمز الرنا في عملية الانتساخ
نظرا لأن الدنا كله تقريبا يوجد في نواة الخلية، ونظرا لأن معظم وظائف الخلية تجري في السيتوبلازم، فلابد من وجود وسائل لجينات النواة للتحكم في حدوث العمليات الكيميائية الخلوية في سيتوبلازم الخلية، ويتحقق ذلك بتوسط نوع آخر من الأحماض النووية وهو الحمض الريبي النووي (الرنا) الذي يتحكم الدنا في النواة بتكوينه.
و تتحول الرموز في هذه العملية التي تسمى الانتساخ transcription إلى رنا، ثم ينقل الرنا من النواة إلى منطقة السيتوبلازم حيث يتحكم في تركيب البروتين.[13]
و يتم تجميع جزيء الرنا من النوويدات المنشطة باستعمال أحد خيطي الدنا كمرصاف (قالب) خلال عملية الانتساخ؛ حيث تتم عملية تجميع جزيء الرنا بتأثير إنزيم بوليميراز الرنا؛ وهو إنزيم كبير جدا ذو خواص وظيفية ضرورية لتكوين جزيء الرنا، وهذه الخواص هي:
- يوجد في خيط الـ DNA وأمام الجين الأولي مباشرة نسق نوويدات يسمى المحَرِض promoter، ويوجد لبوليميراز الـ RNA بنية تكميلية مناسبة تعرف على هذا المحرض وتلتصق به، وهذه هي خطوة ضرورية لبدء تكوين جزيء الـ RNA.
- يتم التفاف حوالي لفتين من حلزون الـ DNA، وتنفصل الأجزاء غير الملتفة من الخيطين.
- يتحرك بعد ذلك البوليميراز على طول خيط الـ DNA، ويفك ويفصل خيطي الـ DNA مؤقتا في كل مرحلة من مراحل حركته، وعندما يتحرك متقدما يكوَّن جزيء الـ RNA حسب الخطوات التالية.
- يتم أولا توليد روابط هيدروجينية بين قواعد خيط الـ DNA ونوويدات الـ RNA المناسبة لها في داخل نواة الخلية.
- ومن ثم يقطع بوليميراز الـ RNA جذرين من جذور الفوسفاتية الثلاثة واحدا كل مرة بعيدا عن كل من هذه النوويدات محررا بذلك كميات كبيرة من الطاقة من الروابط الفوسفاتية عالية الطاقة المقطوعة.
و تستعمل هذه الطاقة لتوليد ارتباط تساهمي covalent linkage للفوسفات الباقية على النوويد مع سكر الريبوز على نهاية جزيء الـ RNA المتنامي.
- عندما يصل بوليمراز الـ RNA إلى نهاية جين الـ DNA فإنه يواجه نسقاً جديدا من نوويدات الـ DNA يسمى النسق المنهي للسلسلة chain - terminating sequence، فيسبب بذلك انقطاع البوليميراز بعيدا عن خيط الـ DNA، ومن ثم يتمكن البوليميراز من الالتصاق في محل آخر لاستعماله مرة بعد أخرى لتكوين جزيئات جديدة من الـ RNA.
- عندما يتم تكوين خيط جديد من الـ RNA تنقطع روابطه الهيدروجينية مع مرصاف template الـ DNA لأن لخيط الـ DNA التكميلي طاقة ربط أعلى، فترخي خيط الـ RNA الجديد وتعيد ربط خيطي الـ DNA. وبهذه الطريقة يطلق جزيء الـ RNA إلى داخل جبلة النواة.[14][15]
ومن الضروري معرفة أن هناك أربعة أنواع مختلفة من قواعد الـ DNA، كما أن هناك أربع قواعد نوويدية من الـ RNA، وعلاوة على ذلك تتحد هذه القواعد دائماً مع بعضها البعض باتحادات نوعية، ولذلك ينتقل الراموز الذي يوجد في خيطي الـ DNA بشكل تكاملي إلى جزي الـ RNA. تتحد قواعد نوويد سكر الريبوز دائما مع قواعد الريبوز منقوص الأكسجين بشكل الاتحادات التالية:
| قاعدة الـ DNA | قاعدة الـ RNA |
|---|---|
| جوانين | سيتوزين |
| سيتوزين | جوانين |
| أدينين | يوراسيل |
| ثيمين | أدينين |
لابد لجزيئات الـ RNA التي تطلق إلى جبلة النواة من أن تعامل ثانية قبل دخولها الهيولي، ويعود سبب ذلك إلى أن الـ RNA المنسوخ حديثا يحوي العديد من نسق جزيئات نوويد الـ RNA غير المرغوب فيها[16]، والتي يقع بعضها عند نهايتي خيط الـ RNA، ولكن البعض الآخر منها يقع في وسط خيط الـ RNA. وتكون هذه المواد غير المرغوب فيها أكثر من 90 بالمئة من مجموع خيط الـ RNA .
كما أن هناك سلسلة من الإنزيمات الموجودة ضمن جبلة النواة لها القدرة على قطع هذه النسق غير المرغوب فيها وتعيد بعد ذلك وصل خيط الـ RNA، وتسمى هذه العملية باسم وصل الـ RNA أو RNA splicing، ويصبح الـ RNA عند ذاك جاهزاً لتكوين البروتينات.
أنواع الـ RNA الثلاثة
هناك ثلاثة أنواع مختلفة من الـ RNA يقوم كل منها بدور مستقل ومختلف عن النوعين الآخرين في تكوين البروتين وهي:
- الـ RNA الرسول messenger RNA ؛ وهو الذي يحمل الرمز الجيني إلى سيتوبلازم الخلية للتحكم في تكوين البروتينات.[17]
- الـ RNA الناقل transfer RNA ؛ وهو الذي ينقل الأحماض الأمينية المنشطة إلى الريبوسومات لاستعمالها في تركيب جزيئات البروتين.
- الـ RNA الريبوسومي ribosomal RNA ؛ وهو الذي يكون مع حوالي 75 بروتيناً مختلفا الريبوسومات، وهي البنيات الفيزيائية والكيميائية التي تتجمع عليها جزيئات البروتين.
الـ RNA الرسول
تتكون جزيئات الـ RNA الرسول من خيوط طويلة معلقة في سيتوبلازم الخلية، وهي تتكون عادة من عدة مئات إلى عدة آلاف من النوويدات على هيئة خيوط غير مزدوجة، وتحتوي على رموز النوويدات في خيوط غير مزدوجة، وتحتوي على رموز codons تكميلية كاملة للثلاثيات الرمزية للجين.
ويبين الجدول التالي رموز الـ RNA للأحماض الأمينية العشرين المختلفة الشائعة التي توجد في جزيئات البروتين:
| الحمض الأميني | رموز الـ RNA |
|---|---|
| ألانين | GCU GCC GCA GCG |
| أرجنين | CGU CGC CGA CGG AGA AGG |
| أسبارجين | AAU AAC |
| سيستئين | UGU UGC |
| حمض الجلوتاميكك | GAA GAG |
| جلوتامين | CAA CAG |
| جليسين | GGU GGC GGA GGG |
| هستيدين | CAU CAC |
| أيزوليوسين | AUU AUC AUA |
| ليوسين | CUU CUC CUA GUA GUC UUA UUG |
| ليزين | AAA AAG |
| مثيونين | AUG |
| فينيل ألانين | UUU UUC |
| برولين | CCU CCC CCA CGG |
| سيرين | UGU UCC UCA UCG AGCAGU |
| ثريونين | ACU ACC ACA ACG |
| تربتوفان | UGG |
| تيروزين | UAU UAC |
| فالين | GUU GUC GUA GUG |
| قاعدة البدء (CI) | AUG |
| قاعدة الانتهاء (CT) | AUU UAG UGA |
ويلاحظ من الجدول السابق أن معظم الأحماض الأمينية ممثلة بأكثر من رمز codon واحد. كما أن رمز واحد يمثل الإشارة إبدأ تكوين جزيء البروتين، وتمثل ثلاث رموز الإشارة أوقف تكوين جزيء البروتين. ويمثل هذان النوعان من الرموز في الجدول السابق بالرمز CI (من chain - initiating)، وبالرمز CT (من chain - terminating) أي إنهاء السلسلة.[18]
الرنا الناقل
يسمى النوع الآخر من الرنا الذي يقوم بدور مهم في تركيب البروتين الرنا الناقل transfer RNA [19]، لأنه ينقل جزيئات الحمض الأميني إلى جزيئات البروتين عند تكوينها، وهناك أنواع عديدة مختلفة من الـ RNA الناقل ولكن كل نوع منه يتحد نوعياً بواحد فقط من الأحماض الأمينية العشرين التي تضمن في البروتينات، ثم يعمل الـ RNA الناقل كحامل carrier ينقل نوعه المعين من الحمض الأميني إلى الريبوسومات حيث يكوَن البروتين.[20] ويتعرف كل نوع خاص من الـ RNA الناقل في الريبوسومات على رمز خاص على الـ RNA الرسول؛ وبهذا يوصل الحمض الأميني المناسب إلى موضعه المناسب في سلسلة جزيء البروتين الذي يتكون حديثاً . و الـ RNA الناقل الذي يحوي تقريباً 80 نوويداً فقط هو مجرد جزيء صغير إذا ما قورن بالـ RNA الرسول . وهو سلسلة مطوية من النوويدات ذات مظهر شبيه بورقة البرسيم . ويوجد في إحدى نهايتي الجزيء دائماً الحمض النووي أدينيليك، وبهذا يتصل الحمض الأميني المنقول ويلتصق بمجموعة الهيدروكسيل في ريبوز حمض الأدينيليك . ويولد هذا الالتصاق إنزيماً نوعياً معيناً لكل نوع من أنواع الـ RNA الرسول . كما يعين هذا الإنزيم نوع الحمض الأميني الذي سيلتصق بكل نوع مناسب من أنواع الـ RNA الناقل.[21][22] و لما كانت وظيفة الـ RNA الناقل هي لصق حمض أميني معين بسلسلة بروتين في دور التكوين يصبح من الضروري أن يكون لكل نوع من أنواع الـ RNA الناقل نوعية خاصة برمز خاص في الـ RNA الرسول . والرمز النوعي في الـ RNA الناقل الذي يتمكن من التعرف على رمز معين هو أيضاً مكون من قواعد نووية ثلاثية تسمى مقابلة الرمز anticodon . وتقع هذه في وسط جزيء الـ RNA الناقل تقريباً . وتتحد أثناء تكوين جزيء البروتين قواعد مقابلات الرمز بصورة رخوة بواسطة رابطة الهيدروجين مع قواعد الـ RNA الرسول . وبهذه الطريقة تصطف الأحماض الأمينية المناسبة واحداً بعد الآخر على طول سلسلة الـ RNA الرسول مولدة بذلك نسقاً مناسباً من الأحماض الأمينية في جزيء البروتين .
الـ RNA الريبوسومي
النوع الثالث من RNA الخلية هو الـ RNA الريبوسومي ribosomal RNA الذي يكون حوالي 60% من ريبوسومات الخلية تقريبا، ويتكون القسم الباقي منها من البروتين الذي يحوي حوالي 75 نوعا مختلفا من البروتينات البنيوية والإنزيمية الضرورية لإنتاج جزيئات البروتين[21][22]، والريبوسومات هي البنيات الفيزيائية في سيتوبلازم الخلية، والتي تتولد عليها جزيئات البروتين ولكنها تعمل دائما بالترافق مع نوعي الـ RNA الآخرين، فينقل الـ RNA النقل الأحماض الأمينية إلى الريبوسومات لتضمينها ضمن جزيئات البروتين المولد بينما يوفر الـ RNA الرسول المعلومات الضرورية لترتيب نسق الأحماض الأمينية بترتيب مناسب لكل نوع معين من أنواع البروتينات المولدة، وتتكون ريبوسومات الخلايا المنواة من وحدتين ثانويتين، وهما الوحدة الثانوية الصغيرة وهي تحوي جزيء واحد من الـ RNA و 33 بروتيناً، والوحدة الثانوية الكبيرة وهي تحوي 3 جزيئات RNA وأكثر من 40 بروتيناً، وبالرغم من أن كيفية آلية صنع البروتين في الريبوسومات محدودة المعرفة، إلا أنه من المعروف أن الـ RNA الرسول والـ RNA الناقل يتحدان أولاً مع الوحدة الثانوية الصغيرة، وتجهز بعد ذلك الوحدة الثانوية الكبيرة معظم الإنزيمات التي تعزز الارتباط الببتيدي بين الأحماض الأمينية المتتالية؛ ولهذا فإن الريبوسوم يعمل كمصنع يتم فيه تصنيع جزيئات البروتين.
تكوين الريبوسومات في النوية
توجد جينات الـ DNA الخاصة بتكوين الـ RNA الريبوسومي في هيئة خمسة أزواج صبغية مختلفة في النواة. ويحتوي كل صبغي العديد من النسخ المضاعفة من هذه الجينات بسبب الحاجة الشديدة لكميات كبيرة من الـ RNA الريبوسومي التي تتطلبها الوظائف الخلوية.[23][24] ويتجمع الـ RNA الريبوسومي عند تكوينه في النُوية nucleolus، وهي بنية خاصة تقع بجوار الصبغيات chromosomes، وعندما يتم صنع كميات كبيرة من الـ RNA الريبوسومي، كما يحدث في الخلايا التي تولد كميات كبيرة من البروتين، فتصبح النوية كبيرة جدا. وعلى العكس من ذلك فإنها تكون صغيرة جدا بحيث لا ترى أبدا في الخلايا التي تصنع كميات صغيرة من البروتين، ويعامل الـ RNA الريبوسومي بصورة خاصة في النوية ويتحد مع البروتينات الريبوسومية ليكون نتاجات حبيبية مكثفة، وهي الوحدات الثانوية البدئية للريبوسومات، ثم تحرر هذه البنيات من النوية وتنقل خلال الثغور الكبيرة لغلاف النواة إلى كل أقسام السيتوبلازم تقريبا. وتجمع هذه الوحدات الثانوية لتكون ريبوسومات وظيفية ناضجة عندما تدخل السيتوبلازم فقط ولذلك لا تتولد البروتينات في النواة لأنها لا تحوي ريبوسومات ناضجة.
تكوين البروتينات على الريبوسومات في عملية الترجمة
عندما يلامس جزيء الـ RNA الرسول ريبوسوم ما فإنه يرتحل على طوله ابتداء من نهاية مسبقة التعيين على جزيء الـ RNA ومعينة حسب نسق مناسب من قواعد الـ RNA، ويتكون جزيء بروتينى أثناء ترحيل الـ RNA الرسول على طول الريبوسوم؛ وتسمى هذه العملية باسم عملية الترجمة translation. وبهذه الطريقة يقرأ الريبوسوم روامز الـ RNA الرسول بنفس الطريقة التي يقرأ بها الشريط عندما يمر خلال رأس جهاز التسجيل، وعندما يمر رمز الإيقاف stop codon (أو رمز إنهاء السلسلة chain - terminating codon) عبر الريبوسوم، تؤشر نهاية جزيء البروتين ويحرر كل الجزيء إلى سيتوبلازم الخلية.
عديدات الريبوسومات
يتمكن جزيء الـ RNA الرسول الواحد من تكوين عدة جزيئات بروتين في عدة ريبوسومات مختلفة وفي وقت واحد [25]، وذلك بمرور خيط الـ RNA على طول ريبوسوم متعاقب مع آخر بعد ترك الريبوسوم الأولي. كما أن جزيئات البروتين تكون في مراحل تطورية مختلفة في كل ريبوسوم؛ وكنتيجة لذلك غالبا ماتتولد عناقيد من الريبوسومات فتلتصق 3 إلى 10 ريبوسومات ببعضها البعض بواسطة RNA رسول واحد في كل مجموعة منها، وتسمى هذه العناقيد عديدات الريبوسومات polyribosomes. ويتمكن الـ RNA الرسول من تكوين جزيء بروتين في أي ريبوسوم، وليست هناك أية نوعية خاصة لريبوسومات معينة لنوع معين من البروتينات، فالريبوسوم هو ببساطة بنية تتم فيها العمليات الكيميائية.
التصاق عديد الريبوسومات بالشبكة الإندوبلازمية الباطنة
هناك العديد من الريبوسومات التي تلتصق بالشبكة الإندوبلازمية الباطنة، ولايحدث ذلك إلا حينما تبدأ الريبوسومات في تكوين جزيئات البروتين، ومع ذلك فإن هناك بعض النهايات البدئية لبعض أنواع الجزيئات البروتينية تلصق نفسها مباشرة بمواقع على مستقبلات نوعية على الشبكة الإندوبلازمية الباطنة مما يؤدي إلى اختراق هذه الجزيئات للجدار الشبكي ودخولها إلى مطرس الشبكة الإندوبلازمية الباطنة، ويحدث هذا طالما أن الريبوسوم لازال يعمل في توليد جزيء البروتين الذي يسحب الريبوسوم إلى الشبكة الإندوبلازمية الباطنة مما يعطيها مظهرها الحبيبي.[25] و يتحدد ذلك عن طريق العلاقة الوظيفية للـ RNA الرسول مع الريبوسومات والطريقة التي تلتصق بها الريبوسومات بغلاف الشبكة الإندوبلازمية الباطنة، ومن الملاحظ أن عملية الترجمة هذه تتم في عدة ريبوسومات في نفس الوقت استجابة لنفس خيط RNA الرسول، كما يلاحظ مرور سلاسل عديد الببتيد حديثة التكوين خلال الشبكة الإندوبلازمية الباطنة إلى مطرس الهيولي الداخلي، ومع ذلك يجب الإشارة إلى أنه ماعدا ما يحدث في الخلايا الغدية التي تكون كميات كبيرة من حويصلات إفرازية حاوية للبروتين فإن معظم البروتينات التي تكونها الريبوسومات تحرر مباشرة إلى العصارة الخلوية وهذه هي الإنزيمات وبروتينات البنيات الداخلية للخلية.
تصنيع المواد في الخلية
تتحكم عدة آلاف من إنزيمات البروتين في كل التفاعلات الكيميائية الأخرى التي تتم في الخلية، وتحفز هذه الإنزيمات تصنيع الدهون والجليكوجين والبيورينات والبيريميدينات والمئات من المواد الأخرى، وتتم بهذه العمليات التصنيعية المختلفة العديد من وظائف الخلية.
التحكم في الوظائف الجينية والأنشطة الكيميائية الحيوية في الخلايا
لكي تتحكم الجينات في أنشطة الخلية فلابد من التحكم في تنشيط الجينات نفسها، وإلا فقد يحدث نمو مفرط في أحد أقسام الخلية أو قد يطغى نشاط بعض هذه التفاعلات الكيميائية إلى أن يؤدي إلى موت الخلية. كما يوجد لكل خلية تلقيم راجع (تغذية راجعة) داخلي قوي يتحكم في الآليات التي تحافظ على كل العمليات الوظيفية المختلفة للخلية متناسقة مع بعضها البعض.[26] وتوجد لكل جين أو لكل مجموعة صغيرة من الجينات (الذي يبلغ مجموعها 100000 جين) آلية تلقيم راجع واحدة على الأقل.
و لقد ساهمت أصغر الفيروسات بشكل كبير في فهم الوظائف الخلوية لأن هذه الكائنات بسيطة جدا تمكن البيولوجيين من دراسة أدق وأكمل التفصيلات تقريبا لكل جزيء فيها وبمستوى أعلى قليلا، ساهمت الجراثيم في تقديم المعلومات القيمة في هذا المجال وخصوصا الإشريكية القولونية Eschcrichia coli التي توجد بكثرة في الأمعاء والغائط، ولكن الخلايا المنواة معقد التركيب جدا عن هذه الأحياء الدنيا فلم يتمكن العلماء إلا حديثا من معرفة بعض آليات التحكم فيها والتي ابتكرتها هذه الأشكال المتطورة من الحياة، ولتوضيح تعقيد الخلايا المنواة (والتي تسمى حقيقيات النواة eukaryotes) فإن هذه الخلايا تحوي مايبلغ 1000 ضعف من الـ DNA أكثر مما يحويه جرثوم الإشريكية القولونية. وهناك أساسًا طريقتان مختلفتان للتحكم في الأنشطة الكيميائية الحيوية في الخلية، وتسمى إحدى هاتين الطريقتين التنظيم الجيني genetic regulation ؛ حيث يتم التحكم في فعاليات الجينات نفسها، وتسمى الثانية التنظيم الإنزيمي حيث يتم التحكم في أنشطة الإنزيمات داخل الخلية.
التنظيم الجيني
تتحكم النواة في التصنيع الكيميائي الحيوي كوظيفة لها تسمى المحرض الإنزيمي . ويحتاج تصنيع النتاج الكيميائي الحيوي للخلية في العادة إلى سلسلة من التفاعلات، ويحفز كل واحد منها إنزيم بروتيني خاص.[27] ويتحكم في إنتاج كل الإنزيمات التي تحتاجها العمليات التصنيعية نسق من الجينات التي توجد في سلاسل الجينات المتتالية على نفس خط الـ DNA الصبغي . وتسمى هذه المنطقة من خيط الـ DNA باسم المَشغَل operator . وتسمى الجينات المسؤولة عن الإنزيمات الخاصة الجينات البنيوية structural genes . فتقوم الجينات خاصة في المشغل بالتحكم في تكوين ثلاثة إنزيمات خاصة تستعمل في عملية تصنيع نتاج معين داخل الخلايا . كما يوجد قطعة على خيط الـ DNA المحرَض promoter . وهذه هي سلسلة من النوويدات لتي لها ألفة خاصة لبوليميراز الـ RNA . وعلى البوليميراز أن يرتبط مع هذا المشغل قبل أن يتمكن من بدء حلقة على طول خيط الـ DNA ليخلق الـ RNA ؛ ولهذا فإن المحرض هو عامل ضروري في تنشيط المشغل .
تحكم البروتين الكاظم في المَشغَل
يوجد شريط إضافي للنوويدات موجود في وسط المحرض ؛ وتسمى هذه المنطقة باسم العامل الكاظم repressor operator لأنها تعمل كبروتين تحكمي يمكنه الارتباط هنا فيمنع التصاق بوليميراز الـ RNA بالمحرض مانعاً بذلك حدوث انتساخ الجينات . ويسمى مثل هذا النظام البروتيني باسم[28] البروتين الكاظم repressor protien . وبصورة عامة توجد كل البروتينات المنظمة الكاظمة بشكلين تجسيميين متباينين، يتمكن أحدهما من الارتباط بالعامل operator ويكظم الانتساخ، أما الثاني فإنه لا يرتبط به . وهذا يعني أن أحد الشكلين يتمكن من أن يكَوِن جزيء بروتين مستقيم ويكون الشكل الثاني نفس الجزيء ولكنه محني بزاوية عند وسطه . ويتمكن أحد هذين النوعين فقط من كبت العامل . وبالإضافة إلى ذلك تتمكن مختلف المواد غير البروتينية في الخلية - مثل بعض النتاجات الاستقلابية metabolites الموجودة فيها - من الارتباط مع البروتين الكاظم لتغيير حالة شكلة التجسيمي allosteric state . وتسمى المادة التي تغيره وتؤدي إلى اتحاده مع العامل وتوقَف الانتساخ باسم المادة الكاظمة repressor substance أو مادة مثبطة inhibitor substance . ومن الناحية الأخرى تسمى المادة التي تغير البروتين الكاظم وتحفزه على قطع ارتباطه بالعامل باسم مادة منشطة activator substance أو مادة محرضة inducer substance لأنها تنشط أو تحرض عملية الانتساخ بإزالة البروتين الكاظم . و كمثال يوضح تحكم البروتين الكاظم بانتساخ الجين ؛ ففي العادة لا يتوفر سكر اللاكتوز كمادة غذائية لخلايا الإشريكية القولونية، ولذلك لا تصنع هذه الجراثيم في العادة الإنزيمات التي يحتاجها التحلل الاستقلابي للاكتوز.[29] ولكن عند توفر اللاكتوز فإنه يولد تغييراً شكلياً مغايراً allosteric في البروتين الكاظم مؤدياً إلى انفصاله عن العامل الكاظم على المشغل الذي ينتسخ الإنزيمات الاستقلابية الضرورية . ولذلك يصبح المشغل مزال الكاظم وتتولد الإنزيمات المناسبة خلال بضعة دقائق في الجرثوم لتحلل اللاكتوز . ومن ثم عندما يبدأ اللاكتوز بالاختفاء من داخل الخلية تقل سرعة تصنيع الإنزيمات أيضاً لتعود إلى المستوى الذي يتطلبه وجود كمية اللاكتوز المتوفر فقط . ويتضح من ذلك منطق وجود مثل هذه الأجهزة التنظيمة في الخلية .
تحكم البروتين المنشط بالمُشغل
يوجد عامل آخر يسمى العامل المُنشط activator operator الذي يقع بجوار المحرض ولكن إلى الأمام منه . فعندما يرتبط بروتين منظم بهذا العامل فإنه يساعد في جذب بوليميرلز الـ RNA إلى المحرض وينشط بذلك المشغل . ولذلك يسمى البروتين المنظم من هذا النوع بروتيناً منشطاً activator protein . ومن الممكن تنشيط المشغل أو تثبيطه بواسطة العامل المنشط بطرق معاكسة تماماً لتحكم العامل الكاظم .
تحكم التلقيم الراجع السلبي بالمشغل
يوجد كمية حرجة من نتاج مُصنَع في الخلية يمكنه من أن يسبب تثبيطاً بتلقيم راجع سلبي للمشغل المسؤول عن تصنيعه . وهو يتمكن من القيام بذلك إما بجعل البروتين المنظم الكاظم يرتبط بالعامل الكاظم أو بجعل البروتين المنظم النشط يقطع ارتباطه مع العامل المنشط . وفي الحالتين يتم تثبيط المشغل.[30] ولهذا فمتى توفرت كميات كبيرة كافية من المركب المصنع يخمد المشغل . وعلى العكس من ذلك فمتى ما تضاءلت كمية النتاج المصنع في الخلية وهبط تركيزه فيها ينشط المشغل ثانية . وبهذه الطريقة يتم التحكم في تركيز الناتج أتوماتيكياً .
آليات أخرى للتحكم في الاستنساخ بواسطة المشغل
لقد اكتشفت خلال السنوات الماضية اختلافات في الآلية الأساسية للتحكم بالمشغل. وفيما يلي بعض هذه الاختلافات:
- غالباً ما يتحكم بالمشغل جين منظم regulatory gene يقع في محل آخر في المعقد الجيني للنواة . ويقوم الجين المنظم هذا بتكوين بروتين منظم يقوم بدوره إما كمادة منشطة أو كمادة كاظمة تتحكم بالمشغل .
- توجد أحياناً عدة مشاغل مختلفة تتحكم في وقت واحد ببروتين منظم واحد . ويعمل في بعض الأحيان نفس البروتين المنظم منشطاً لأحد المشاغل وكاظماً لمشغل آخر . وعندما تحكم عدة مشاغل في وقت واحد بهذه الطريقة تسمى كل هذه المشاغل التي تعمل سوية الناظمة regulon .
- لا تُحكم بعض المشاغل عند نقطة ابتداء الاستنساخ على خيط الـ DNA بل إنها تُحكم عوضاً عن ذلك بعيداً عنها على طول الخيط نفسه . ولا يكون التحكم أحياناً على خيط الـ DNA نفسه ولكنه عوضاً عن ذلك يكون في النواة أثناء صنع جزيئات الـ RNA فيها وقبل إطلاقه إلى الهيولى . ونادراً ما يتم التحكم بمستوى ترجمة الـ RNA بواسطة الريبوسومات.
- يتكتل DNA النواة في حقيقيات النواة بوحدات بنائية خاصة تسمى الصبغيات chromosomes . ويلتف الـ DNA في كل صبغي حول بروتينات صغيرة تسمى الهستونات histones التي تتكتل بدورها بإحكام بواسطة بروتينات أخرى.[31] وما دام الـ DNA في هذه الحالة المتكتلة فإنه لا يتمكن من العمل على توليد الـ RNA .
و لكن بدأ الآن اكتشاف العديد من آليات التحكم التي تتمكن من توليد باحات منتقاة تتفكك في الصبغيات إلى أقسام متتالية قسماً واجداً في كل مرة بحيث يمكن أن يتم انتساخ الـ RNA . وتستعمل بذلك أنظمة أعلى مرتبة في حقيقيات النواة لتنظيم وظائف الخلايا فيها . وبالإضافة لذلك تتمكن بعض الإشارات من خارج الخلية - مثل بعض الهرمونات - من تنشيط بعض مناطق الصبغيات فتوفر بذلك آليات كيميائية لبعض الوظائف الخاصة . و نظراً لوجود ما يصل إلى 100000 جين مختلف في كل خلية بشرية، فليس من المستغرب وجود طرق عديدة ومختلفة للتحكم في الفعاليات الجينية . كما أن هذه الأنظمة التحكمية الجينية مهمة بصورة خاصة في التحكم في تراكيز الأحماض الأمينية ومشتقاتها وفي العديد إن لم يكن في معظم الركائز الوسطية لاستقلاب السكريات والشحوم والبروتينات في داخل الخلية .
تحكم التنظيم الإنزيمي في الوظائف داخل الخلايا
بالإضافة للتحكم في وظائف الخلية بواسطة التنظيم الجيني، من الممكن التحكم مباشرة في بعض الإنزيمات داخل الخلايا نفسها بالمثبطات أو بالمنشطات داخل الخلايا. وهذا التنظيم الإنزيمي يمثل صنفاً ثانياً من الآليات التي يمكن أن تُحكم بها الوظائف الخلوية الكيميائية الحيوية.[32]
تثبيط الإنزيمات
تمتلك بعض المواد الكيميائية التي تتولد في الخلية تأثيراً تلقيمياً راجعاً مباشراً في تثبيط الأنظمة الإنزيمية الخاصة التي تكونها الخلية . ويعمل النتاج المصنع دائماً تقريباً على الإنزيم الأول في النسق بدلاً من تأثيره على الإنزيمات التالية له . وعادة ما يرتبط هذا النتاج بالإنزيم مباشرة ويولد تغييراً شكلياً مغايراً فيه . ومن الممكن التعرف على أهمية تثبيط الإنزيم الأول فهو يمنع تكوين نتاجات وسيطة من دون أن تستعمل في الخلية . و عملية تثبيط الإنزيم هذه هي مثل آخر على التحكم بالتلقيم الراجع السلبي ؛ فهي مسؤولة عن التحكم في تراكيز بعض الأحماض الأمينية في داخل الخلية كالبيورينات والبيريميدنات والفيتامينات وبعض المواد الأخرى .
تنشيط الإنزيمات
يمكن في الغالب تنشيط الإنزيمات غير الفعالة أو تلك التي أخمد نشاطها ببعض المواد المثبطة . وأحد الأمثلة على ذلك هو عمل أحادي فوسفات الأدينوزين الحلقي cAMP عند شطر جزيء الجليكوجين وإطلاق جزيئات الجلوكوز منه لتكوين الـ ATP المركب عالي الطاقة . فعندما ينفد معظم ثلاثي فوسفات الأدينوزين من الخلية يبدأ تكون كميات كبيرة من cAMP كنتاج تحليلي لـ ATP . ويدل وجود cAMP على هبوط الاحتياطات الخلوية من الـ ATP إلى مستوى قليل جداً . ومع ذلك فإن cAMP ينشط مباشرة إنزيم شطر الجليكوجين الفسفوريلاز محرراً جزيئات جلوكوز سرعان ما تستعمل لسد نقص مخزونات ATP . وهكذا يعمل الـ cAMP كمنشط إنزيمي لإنزيم الفسفوريلاز، ويساعد بذلك في التحكم بتركيز ATP داخل الخلية.[33][34] و تخحدث حالة مهمة أخرى لتثبيط الإنزيم وتنشيطه عند تكوين البيورينات والبيريمدينات، حيث تحتاج الخلية الحية المنواة لهذه المواد بكميات متساوية تقريباً لتكوين الـ DNA والـ RNA فعندما تولَد البيورينات تثبط الإنزيمات الضرورية لتكوين كميات إضافية منها، ولكن تنشط الإنزيمات اللزمة لتكوين البيريمدينات . وعلى العكس من ذلك فإن البيريمدينات تثبط إنزيماتها ولكنها تنشط إنزيمات البيورين . وبهذه الطريقة يوجد تلقيم راجع عابر ومستمر بين أنظمة التصنيع لهاتين المادتين يؤدي إلى الحفاظ على كميات متساوية نقريباً منهما في كل الأوقات .
الخلاصة : و باختصار توجد طريقتان رئيسيتان تتحكم الخلايا الحية بهما في الحفاظ على نسب وكميات متناسبة لمختلف المكونات الخلوية ؛ وهما :
- آلية التنظيم الجيني
- آلية التنظيم الإنزيمي
فمن الممكن تنشيط الجينات أو تثبيطها وكذلك من الممكن تنشيط الإنزيمات أو تثبيطها ؛ وغالباً ما تعمل هذه الآليات التنظيمية كأنظمة تحكم بالتلقيم الراجع الذي يراقب باستمرار مكونات تركيب الخلية الكيميائي الحيوي ويصلحه عند الحاجة إلى ذلك . ولكن تقوم أحياناً بعض المواد من خارج الخلية - وخاصة بعض الهرمونات - بالتحكم في التفاعلات الكيميائية الحيوية في داخل الخلية بتنشيط واحد أو أكثر من أنظمة التحكم داخل الخلايا الحية.[35][36]
العلاج بالجينات
يتسبب أي خلل في المورثات أحيانا في إصابة الإنسان بأحد الإعاقات أو الأمراض. فقد يؤدي خطأ واحد في جين من بين 3 مليارات مورثة (وهي الحصيلة الكلية من مورثات الإنسان) قد يتسبب هذا الخطأ الواحد في الإصابة بالعمى أو بضعف في مناعة الإنسان أو في عدم استطاعة كرات الدم الحمراء تخزين كمية كافية من الأكسجين.
هنا قد يساعد العلاج بالمورثات في التغلب على أسباب المعاناة. يستخلص الأخصائيون مورثة سليمة من أحد الفيروسات ويزرعونها مكان المورثة البشرية الغير سليمة. وقد بينت الفحوص الأولية التي أجريت خلال التسعينيات من القرن الماضي نجاحات في هذا السبيل، إلا أن تلك النجاحات كانت مقترنة أيضا ببعض الأعراض الجانبية الجسيمة. فقد أصيب بعض المعالجين بهذه الطريقة بمرض السرطان الخبيث.
وتتابعت حاليا نجاحات في الآونة الأخيرة (2014). فقد تمكن الباحثون في الولايات المتحدة من معالجة حالة العمى لدى مريض وتحسنت حالته. وتمكن فريق من الأطباء الفرنسيين من معالجة توأمين وأوقفوا مرضا عصبيا فيهم كان سيؤدي بحياتهم خلال فترة قصيرة. كما استطاع أخصائيون في ألمانيا معاجة طفل من حالة ضعف شديد في مناعته.[37]
يستخدم الباحثون ما يسمى ناقل من المورثات (أجزاء من المورثات) ويستقطعونها من فيروس «أليف» غير ضار ويدخلونها في مورثات المريض في عدة من خلاياه. وتحتوي نواقل المورثات على عناصر تعمل على تنشيط المورثات البشرية بحيث تقوم الخلايا بإنتاج البروتينات الصحيحة بالكمية المطلوبة للشفاء. ويعكف الباحثون على دراسة نواقل المورثات المستخلصة من الفيروسات بحيث لا يكون لها أعراضا جانبية على الإنسان، حيث اتضح أن ما يتم من تجارب على الحيوان بنجاح لا ينجح دائما عند تطبيقه على الإنسان. يلجأ الباحثون في هذا المضمار على اختيار أجزاء من الفيروس التي تصلح الخطأ في المورثات البشرية من دون أن تتسبب في نفس الوقت في أعراض جانبية غير مرغوبة.
تجرى في كثير من مختبرات المورثات بالتعاون مع المستشفيات في دول كثيرة في أنحاء العالم بغرض تجميع معلومات كافية عن صلاحية بعض الجينات وللابتعاد عن تلك الجينات التي لم تحقق نتائج إيجابية. ويأمل الباحثون عن طريق زيادة معلوماتهم في هذا الإطار التوصل إلى مساعدة المرضى من دون تعريضهم إلى أعراض جانبية. ومن معضلات ذلك أيضا تعلم كيفية إصلاح الخلل في عدد كبير من خلايا الإنسان بحيث تكفي لعلاجه. ويسعى العلاج بالمورثات إلى معالجة مسببات الأمراض الناتجة عن خلل في الجينات وتطوير استراجيات علاجية لعلاج ليس فقط اختلال في المورثات بل أيضا في مكافحة أمرض السرطان وأمراض الجهاز العصبي.
المورثة FOXP2
اهتم عدد من العلماء في الفترة الأخيرة بالمورثة FOXP2 حيث يبدو أنها الخاصة بالقدرة على الكلام عند الإنسان . وقد بدأت قصة هذا الجين حيث وجدت في إنجلترا عائلة واحدة لها صعوبة في الكلام عبر ثلاث أجيال متعاقبة . فكان من الصعب عليهم تكوين جمل وتحريك ألسنتهم . وقام العلماء بتحليل جيناتهم ووجدوا حرفا واحدا مختلفا في أحد الجينات وهو FOXP2 على الكروموسوم 17 . وقد تفقد العلماء الجين FOXP2 في عدد كبير من الثدييات ووجدوا انه مستقر ولا يتغير ، إلا انهم وجدوه في حالة الإنسان وفيه تغييرين اثنين مما جعل العلماء يعتقدون أن هذا الجين له علاقة بقدرة الإنسان على الكلام .
التليف الكيسي
التليف الكيسي هو مرض وراثي، أي يتسبب فيه خلل في الجينات الموروثة عن الأم والأب. يصيب الرئة والبنكرياس وأعضاء أخرى. كان الأطفال المصابين به لا يعمرون أكثر من عشرة سنوات. وخلال السبعينيات من القرن الماضي تحسنت طرق العلاج بالعقارات المختلفة وأصبح في مقدور المريض منهم العيش حتى دخول المدرسة وانهاء تعليمه الجامعي، بل والزواج . إلا أن العلماء كانوا يعرفون أن سبب المرض وراثي ولكن لم تكن في استطاعتهم العثور على المواقع الجينية التي تحدث هذا المرض.
كل ما كان العلماء يعرفونه عن هذا المرض الوراثي أن خللا في أحد الجينات يأتي من الأم وخلل بنفس الطريقة يأتي من الأب ، ولا يحدث المرض إلى إذا اجتمع جين الأم المختل مع الجين المختل من الأب . فإذا كان جين الأم مختلا مثلا واجتمع مع جين من الأب سليما فلا يظهر المرض.
ويقص عالم المورثات الكبير فرانسيس كولينز - الذي أشرف على مشروع الجينوم البشري - كيف توصل العلماء في الثمانينيات من القرن الماضي إلى العثور على التغيرات في الكروموسوم رقم 7 المتسببة لمرض التليف الكيسي .
في البدء كان العلماء يعرفون أن مسبب مرض التليف الكيسي هو تغير حرف واحد على الأقل في منظومة من نحو 3 مليارات من حروف الدنا. فكانت العملية مضنية للبحث عنه. وكان كل ما يعرفه العلماء عن هذا المرض أنه يظهر على الأطفال الذي يجتمع فيهم الجين المختل من الأب مع الجين المختل من الأم . ولا يظهر على الأطفال التي يجتمع فيهم جين مختل من الأب مع جين طبيعي من الأم . وبناء على ذلك بدأ العلماء في البحث عن توائم من الأطفال ، تظهر في أحد التوأمين أعراض المرض ولا تظهر في التوأم الآخر . وبمقارنة تتابع الأزواج القاعدية في الدنا للتوأمين يمكن التعرف على الحرف أو الحروف التي تغيرت وتسبب المرض.
واشتركت معامل بحثية كثيرة في الولايات المتحدة خلال الثمانينيات من القرن الماضي في قراءة كروموسومات هؤلاء التوائم . فكانوا يبحثون عن خطأ واحد أو عدة أخطاء في حروف الدنا المكونة من أكثر من 3 مليارات زوج قاعدي. وفي عام 1985 عرف العلماء أن موقع أو مواقع معينة على الكروموسوم رقم 7 هي التي تسبب المرض. ولكن أين يقع هذا الخطأ وما نوعه فكان عليهم مواصلة البحث.
واستخدم العلماء طريقة القفز على الكروموسوم7 في تتبع الأزواج القاعدية على الكروموسوم 7 لاختصار الوقت بدلا من أن يفحصوه حرفا حرفا . وفي عام 1989 منيت مجهوداتهم في البحث والتنقيب بالنجاح الابتدائي ، إذ وجدوا ثلاثة حروف مفقودة في الدنا - وهي بالتحديد الحروف CCT على أحد الجينات التي تنتج بروتين.
ويقول فرانسيس كولينز في كتابه "The Language of God" أن العمل كان مضنيا وكلف نحو 50 مليون دولار أمريكي ولكنهم توصلوا إلى معرفة أسباب أمراض متعلقة بمرض التليف الكيسي ، وواصلوا البحث للتوصل إلى طرق في معالجتها عن طريق إصلاح الجينات - وتصحيح الخلل.
قص الجينات
بعدما تمت عمليات بنجاح في قص الجينات في الصين والولايات المتحدة قام باحثون من بريطانيا بقص مورثات بأجنة بشرية بواسطة «مقص الجينات» كريسبر/ كاس9 وغيروا بعضها . أراد الباحثون من معهد فرانسيس كريك في لندن بهذه الطريقة استكشاف التطور المبدئي الذي يحدث في الأجنة وفهمها بطريقة أفضل ؛ بحيث يتوصلون إلى نسبة نجاح أفضل عند القيام بالتخصيب الاصطناعي . يعتبر هذا تدخل من الإنسان في تغيير الخلق ، ولهذا فإن العلماء لم يزرعوا خلاياهم التي قاموا بتغييرات فيها في أرحمام نساء ، وإنما أهلكوها. هناك مناقشات كثيرة تجري بين الأطباء والباحثين والسياسيين والقانونيين والمفكرين في شأن بحوث مثل تلك على الإنسان ؛ في ألمانيا تلك الأبحاث ممنوعة.
الوراثة
ترث الكائنات الحية جيناتها من أبويها، فتحصل اللاجنسية منها ببساطة على نسخة كاملة من جينوم الكائن الأصل الواحد، بينما تمتلك الكائنات الحية الجنسية نسختين من كل صبغي لأنها ترث مجموعة مكتملة واحدة من كل من الأبوين.[36]:1
الوراثة المندلية
حسب الوراثة المندلية، تعود اختلافات الأنماط الظاهرية للكائنات الحية (أي الصفات الجسدية والسلوكية المُشاهدة) جزئياً لاختلاف أنماطها الجينية (مجموعة معينة من الجينات)، إذ يميّز كل جين صفة معينة بتتالٍ مختلف من الألائل، ما يؤدي لنشوء أنماط ظاهرية مختلفة، وتمتلك معظم الكائنات الحية حقيقية النوى (مثل نبات البازلاء الذي عمل عليه مندل) أليلين لكل صفة، يورث كل واحد منهما من أحد الأبوين.[36]:20
وقد تكون الألائل في موقع جيني ما راجحة أو متنحية، فتؤدي الأولى لنشوء أنماط ظاهرية موافقة لها عندما تقترن مع أي أليل آخر للصفة ذاتها، بينما لا يُعبّر الأليل المتنحي عن نمطه الظاهري الموافق إلّا عندما يقترن بنسخة أخرى من ذاته، وبمعرفة الأنماط الجينية للكائنات الحية، يمكن تحديد أي من الألائل يكون راجحاً أو متنحياً، فعلى سبيل المثال، إذا كان الأليل المحدد للساق الطويلة لدى نبات البازلاء راجحاً على أليل الساق القصيرة، ستمتلك نباتات البازلاء التي ترث أليلاً طويلاً من أحد الأبوين وقصيراً من الآخر سوقاً طويلة أيضاً.
فوضّحت أبحاث مندل أن الألائل تُفرز بشكل مستقل أثناء إنتاج الأعراس، أو الخلايا الجنسية، ما يضمن التنوّع في الجيل التالي، ورغم أن الوراثة المندلية لا تزال نموذجاً جيداً للعديد من الصفات التي تحددها جينات مفردة (بما يتضمن عدداً من الاضطرابات الوراثية المشهورة)، فإنها لا تشمل العمليات الفيزيائية لتضاعف الـ (DNA) وانقسام الخلية.[38][39]
تضاعف الـ (DNA) وانقسام الخلية
يعتمد كل من نمو الكائنات الحية، وتطورها وتكاثرها على الانقسام الخلوي، وهي العملية التي تنقسم فيها الخلية لخليتين بنتين متطابقتين عادة، ويتطلب ذلك اصطناع نسخة مضاعفة من كل جين في الجينوم أولاً، من خلال عملية تُدعى بتضاعف الـ (DNA)،[36]:5.2 وذلك بواسطة إنزيمات متخصصة تُعرف بإنزيمات بوليميراز الـ (DNA)، والتي (تقرأ) أحد طاقي الـ (DNA) الحلزوني المزدوج، ويُعرف بالطاق المرصاف، ومن ثم تصطنع طاقاً جديداً مكملاً له.
ونظراً لأن البنية الحلزونية المزدوجة للـ (DNA) تتماسك بفضل ازدواج الأسس الآزوتية، يُحدد تتالي أحد الطاقين تتالي مكمله بشكل كلّي، وبالتالي يكفي أن يقرأ الإنزيم أحدهما فقط ليُنتج نسخة موثوقة، وتكون عملية تضاعف الـ (DNA) نصف محافظة، ما يعني أن نسحة الجينوم التي ترثها كل من الخليتين البنتين تحتوي على طاق (DNA) أصلي واحد وآخر مُصنع حديثاً.[36]:5.2
قيس معدل تضاعف الـ (DNA) في الخلايا الحية لأول مرة كمعدل استطالة (DNA) الفيروس العاثي T4 لدى إشريكية قولونية معديّة به، ولوحظ أنه سريع بشكل مبهر،[57] فخلال مدة التزايد الأسي للـ (DNA) عند درجة حرارة 37°م بلغ معدل الاستطالة 749 نيكلويتيداً في الثانية.
بعد اكتمال تضاعف الـ (DNA)، يتوجب على الخلية ان تفصل نسختي الجينوم فيزيائياً عن بعضهما وتنقسم لخليتين مستقلتين مرتبطتين بالغشاء،[40] ويحدث ذلك لدى بدائيات النوى (الجراثيم والعتائق) عادةً من خلال عملية بسيطة نسبياً تُدعى بالانشطار الثنائي، والتي يلتصق فيها كل جينوم حلقي بغشاء الخلية وتنقسم الخلية الأم لخليتين بنتين بينما ينغلف الغشاء ليقسم السيتوبلازما لقسمين ملتصقين من خلاله، ويكون الانشطار الثنائي سريعاً للغاية مقارنة مع معدلات انقسام الخلايا لدى حقيقيات النوى.
ينطوي الانقسام الخلوي لدى حقيقيات النوى على عملية أكثر تعقيداً تُعرف بالدورة الخلوية، حيث يطرأ تضاعف الـ (DNA) خلال طور من هذه الدورة يُسمى بطور التركيب (S)، بينما تحدث عملية فصل الصبغيات وانقسام السيتوبلازما خلال طور الانقسام الفتيلي (M).[36]:18.1
الوراثة الجزيئية
يُعتبر تضاعف المادة الوراثية ونقلها من جيل خلوي لآخر أساس الوراثة الجزيئية، والرابط بين المفاهيم التقليدية والجزيئية للجينات، فترث الكائنات الخية خصائص أبويها لأن خلايا النسل تحتوي نسخاً عن جيانتهما.
في بعض الأحيان يمكن أن يطرأ أثناء الانقسام المنصّف، والذي يُنتج خلايا فردانية تُدعى بالأعراس وتحتوي على نسخة واحدة من كل جين،[36]:20.2 حدث يُدعى بالتأشيب الجيني أو العبور، وفيه يتم تبادل قطعة من الـ (DNA) بين شقين صبغيين متوافقين ومتطابقين لكن غير أخوين، وهو ما قد يؤدي لإعادة تفارز الأليلات المرتبطة.[36]:20
ويشير مبدأ مندل للتفارز المستقل إلى أن كلاً من جينَي أحد الأبوين الخاصّين بكل صفة سيُفرز بشكل مستقل ضمن الأعراس، فلا يتعلق الأليل الذي سيرثه الكائن الحي لصفة ما بالأليل الذي سيرثه لصفة أخرى.
ولكن ذلك يصحّ حقيقة فقط في حالة الجينات التي لا تقع على الصبغي ذاته، أو التي توجد على ذات الصبغي لكنها تبعد عن بعضها كثيراً، فكلما اقتربت جينتان من بعضهما أكثر على الصبغي ذاته، ستترافقان أكثر في الأعراس وتظهران معاً بتكرار أكبر (وهو ما يعرف بالارتباط الجيني)، علماً أن الجينات القريبة من بعضها لا تنفصل مطلقاً، لأنه من غير المرجح أبداً أن تحدث نقطة عبور بينها.[36]:5.5
التطور الجزيئي
الطفرات
يكون تضاعف الـ (DNA) مضبوطاً للغاية في معظم الأحيان، ومع ذلك يمكن أن تحدث أخطاء (طفرات)،[36]:7.6 علماً أن معدل الخطأ لدى حقيقيات النوى قد يكون بقلة 10-8 خطأ لكل نيكليوتيد في كل عملية تضاعف،[41][42] بينما قد يصل لدى بعض فيروسات الـ (RNA) لـ10-3،[43] وهو ما يعني أنه في كل جيل، يراكم الجينوم البشري طفرة إلى طفرتين جديدتين.[43]
ويمكن أن تنتج طفرات صغيرة عن تضاعف الـ (DNA) وآثار تضرره، وتتضمن الطفرات النقطية التي يتغير فيها أساس واحد، وطفرات انزياح الإطار التي يُضاف فيها أساس جديد أو يُحذف، ويمكن لكلا الشكلين أن يغير الجين بطفرة مغلوطة (تتغير فيها رامزة ما فترمّز لحمض أميني مختلف)، أو هرائية (تنتج رامزة توقف مبكرة).[44] ويمكن أن تنتج طفرات أكبر عن أخطاء في التأشيب، فتسبب شذوذات صبغية تشمل ترفيل (تكرار)، وحذف، وإعادة ترتيب وانقلاب أجزاء كبيرة من صبغي ما، علاوة على ذلك، قد تُنتج آليات إصلاح الـ (DNA) أخطاء أثناء إصلاح الضرر الفيزيائي المُلحق بهذه الجزيئة، ويكون هذا الإصلاح، حتى مع وجود طفرة فيه، أكثر أهمية للبقيا من استعادة نسخة مطابقة للجزيئة، كما في حالة إصلاح التكسرات مضاعفة الطاق.[36]:5.4
عندما تتواجد ألائل متعددة مختلفة لجين ما في جمهرة النوع، فإنه يُدعى متعدد الأشكال، وتكون معظم الألائل المختلفة متكافئة وظيفياً، ومع ذلك قد تُعطي بعضها صفات ظاهرية مختلفة.
يُسمى الأليل الأكثر شيوعاً لجين ما بالنمط البري، بينما تُسمى الألائل النادرة بالطافرة، ويعود التنوع الوراثي في التواترات النسبية لألائل مختلفة في جمهرة ما لكل من الاصطفاء الطبيعي والانحراف الوراثي،[45] وليس من الضرورة أن يكون أليل النمط البري سلف الألائل الأقل شيوعاً، وقد لا يكون أكثر لياقة منها. تكون معظم الطفرات ضمن الجينات حيادية، فلا تمتلك أي تأثير على النمط الظاهري للكائن الحي (طفرات صامتة)، وقد لا تغير بعض الطفرات من تتالي الحمض الأميني نظراً لترميز رواميز متعددة للحمض الأميني ذاته (طفرات مرادفة)، كما قد تكون طفرات أخرى محايدةً إذا أدّت لتغيرات في تتالي الحمض الأميني، لكن استمر البروتين بأداء وظائفه بشكل طبيعي حتى مع الحمض الأميني الجديد (طفرات محافظة).
ولكن العديد من الطفرات تكون ضارة أو حتى مميتة، وتُزال من الجمهرات بالاصطفاء الطبيعي، وتُعتبر الاضطرابات الوراثية نتيجة لطفرات ضارة، وقد تنشأ لدى الفرد المصاب إما بشكل عفوي أو بالوراثة، وأخيراً تُعتبر نسبة صغيرة من الطفرات مفيدة تحسّن من لياقة الكائن الحي، وتكون مهمة للغاية للتطور نظراً لأن اصطفاءها الموجّه سيؤدي لتطور تكيفي.[36]:7.6
انظر أيضًا
مواضيع متعلقة
- متلازمة لانجر-جيديون
- مورثة كاذبة
- وراثة
- قائمة معلمات Y-STR
- علم الجينوم
- حمض نووي ريبوزي منقوص الأكسجين
- حمض نووي ريبوزي
- نوكليوتيد
- بروتين
- تعبير جيني
- علاج جيني
- عائلة جينية
- خوارزميات جينية
- علبة تماثلية
- مشروع الجينوم البشري
- مشروع جينوم الشمبانزي
- توصيل جين
- تحليل الجينات
- تقنية إنتاج حيوانات مهندسة جينيا
- FOXM1
المراجع
- قاموس المورد، البعلبكي، بيروت، لبنان.
- المعجم الطبي الموحد. نسخة محفوظة 10 سبتمبر 2017 على موقع واي باك مشين.
- إدوار غالب، الموسوعة في العلوم الطبيعية (ط. الثانية)، دار المشرق، بيروت، ج. الأول، ص.49، يُقابله gene
- Mignone, Flavio؛ Gissi؛ Liuni؛ Pesole (28 فبراير 2002)، "Untranslated regions of mRNAs"، Genome Biology، 3 (3): reviews0004، doi:10.1186/gb-2002-3-3-reviews0004، ISSN 1465-6906، PMID 11897027، مؤرشف من الأصل في 29 سبتمبر 2015.
- John K. Colbourne et al. (4 Februar 2011), "The Ecoresponsive Genome of Daphnia pulex" (in German), Science Vol. 331 (6017): pp. 555–561, doi:10.1126/science.1197761
- Mihaela Pertea and Steven L Salzberg (2010): Between a chicken and a grape: estimating the number of human genes. Genome Biology 11:206
- "Introns in UTRs: why we should stop ignoring them."، BioEssays، 34 (12): 1025–34، ديسمبر 2012، doi:10.1002/bies.201200073، PMID 23108796.
- Pennacchio؛ Bickmore؛ Dean؛ Nobrega؛ Bejerano (2013)، "Enhancers: Five essential questions"، Nature Reviews Genetics، 14 (4): 288–95، doi:10.1038/nrg3458، PMID 23503198.
- "Mapping and quantifying mammalian transcriptomes by RNA-Seq"، Nature Methods، 5 (7): 621–8، يوليو 2008، doi:10.1038/nmeth.1226، PMID 18516045.
- International Human Genome Sequencing Consortium (أكتوبر 2004)، "Finishing the euchromatic sequence of the human genome"، Nature، 431 (7011): 931–45، Bibcode:2004Natur.431..931H، doi:10.1038/nature03001، PMID 15496913، مؤرشف من الأصل في 22 يوليو 2017.
- Bennett (مارس 2008)، "Plasmid encoded antibiotic resistance: acquisition and transfer of antibiotic resistance genes in bacteria."، British Journal of Pharmacology، 153 Suppl 1: S347–57، doi:10.1038/sj.bjp.0707607، PMC 2268074، PMID 18193080.
- "Oncogene-induced senescence: putting the brakes on tumor development"، Cancer Research، 66 (6): 2881–4، مارس 2006، doi:10.1158/0008-5472.CAN-05-4006، PMID 16540631.
- Bolzer؛ Kreth؛ Solovei؛ Koehler؛ Saracoglu؛ Fauth؛ Müller؛ Eils؛ Cremer؛ Speicher, Michael R.؛ Cremer, Thomas (2005)، "Three-Dimensional Maps of All Chromosomes in Human Male Fibroblast Nuclei and Prometaphase Rosettes"، PLoS Biology، 3 (5): e157، doi:10.1371/journal.pbio.0030157، PMC 1084335، PMID 15839726.

- Dawkins (1977)، The selfish gene (ط. Repr. (with corr.))، London: Oxford Univ. Press، ISBN 0-19-857519-X.
- Dawkins (1989)، The extended phenotype. (ط. Pbk.)، Oxford: Oxford University Press، ISBN 0-19-286088-7، مؤرشف من الأصل في 7 أبريل 2022.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=/|تاريخ=mismatch (مساعدة) - Williams (2001)، Adaptation and Natural Selection a Critique of Some Current Evolutionary Thought. (ط. [Online-Ausg.].)، Princeton: Princeton University Press، ISBN 9781400820108.
- Huxley (1942)، Evolution: the modern synthesis (ط. Definitive)، Cambridge, Mass.: MIT Press، ISBN 978-0262513661.
- Adams (2008)، "DNA Sequencing Technologies"، Nature Education Knowledge، SciTable، Nature Publishing Group، 1 (1): 193، مؤرشف من الأصل في 30 أكتوبر 2019.
- Sanger؛ Nicklen؛ Coulson (1977)، "DNA sequencing with chain-terminating inhibitors"، Proceedings of the National Academy of Sciences of the United States of America، 74 (12): 5463–7، Bibcode:1977PNAS...74.5463S، doi:10.1073/pnas.74.12.5463، PMC 431765، PMID 271968.
- "Nucleotide sequence of the gene coding for the bacteriophage MS2 coat protein"، Nature، 237 (5350): 82–8، مايو 1972، Bibcode:1972Natur.237...82J، doi:10.1038/237082a0، PMID 4555447.
- "FINE STRUCTURE OF A GENETIC REGION IN BACTERIOPHAGE"، Proc. Natl. Acad. Sci. U.S.A.، 41 (6): 344–54، 1955، PMC 528093، PMID 16589677.
- "ON THE TOPOLOGY OF THE GENETIC FINE STRUCTURE"، Proc. Natl. Acad. Sci. U.S.A.، 45 (11): 1607–20، 1959، PMC 222769، PMID 16590553.
- Judson, Horace (1979)، The Eighth Day of Creation: Makers of the Revolution in Biology، Cold Spring Harbor Laboratory Press، ص. 51–169، ISBN 0-87969-477-7.
- Watson؛ Crick (1953)، "Molecular Structure of Nucleic Acids: A Structure for Deoxyribose Nucleic Acid" (PDF)، Nature، 171 (4356): 737–8، Bibcode:1953Natur.171..737W، doi:10.1038/171737a0، PMID 13054692، مؤرشف من الأصل (PDF) في 24 أكتوبر 2017.
- Hershey؛ Chase (1952)، "Independent functions of viral protein and nucleic acid in growth of bacteriophage"، The Journal of General Physiology، 36 (1): 39–56، doi:10.1085/jgp.36.1.39، PMC 2147348، PMID 12981234.
- Avery؛ MacLeod؛ McCarty (1944)، "Studies on the Chemical Nature of the Substance Inducing Transformation of Pneumococcal Types: Induction of Transformation by a Desoxyribonucleic Acid Fraction Isolated from Pneumococcus Type III"، The Journal of Experimental Medicine، 79 (2): 137–58، doi:10.1084/jem.79.2.137، PMC 2135445، PMID 19871359. Reprint: Avery؛ MacLeod؛ McCarty (1979)، "Studies on the chemical nature of the substance inducing transformation of pneumococcal types. Inductions of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III"، The Journal of Experimental Medicine، 149 (2): 297–326، doi:10.1084/jem.149.2.297، PMC 2184805، PMID 33226.
- "The Human Genome Project Timeline"، مؤرشف من الأصل في 15 فبراير 2019، اطلع عليه بتاريخ 13 سبتمبر 2006.
- تشارلز ستيوارت جيجر, Translator's preface to Intracellular Pangenesis, page viii. نسخة محفوظة 08 نوفمبر 2017 على موقع واي باك مشين.
- هوغو دي فريس, Intracellulare Pangenese, Verlag von Gustav Fischer, ينا, 1889. Translated in 1908 from German to English by تشارلز ستيوارت جيجر as Intracellular Pangenesis, Open Court Publishing Co., Chicago, 1910 نسخة محفوظة 08 نوفمبر 2017 على موقع واي باك مشين.
- Henig, Robin Marantz (2000)، The Monk in the Garden: The Lost and Found Genius of Gregor Mendel, the Father of Genetics، Boston: Houghton Mifflin، ص. 1–9، ISBN 978-0395-97765-1، مؤرشف من الأصل في 7 يناير 2020.
- Magner, Lois N. (2002)، A History of the Life Sciences (ط. Third)، Marcel Dekker، سي آر سي بريس، ص. 371، ISBN 978-0-203-91100-6، مؤرشف من الأصل في 14 مارس 2020.
- "Genes and causation"، Philosophical Transactions. Series A, Mathematical, Physical, and Engineering Sciences، 366 (1878): 3001–3015، سبتمبر 2008، Bibcode:2008RSPTA.366.3001N، doi:10.1098/rsta.2008.0086، PMID 18559318، مؤرشف من الأصل (Free full text) في 27 مارس 2020.
- "Genetics: what is a gene?"، Nature، 441 (7092): 398–401، مايو 2006، Bibcode:2006Natur.441..398P، doi:10.1038/441398a، PMID 16724031.
- "Genomics. DNA study forces rethink of what it means to be a gene"، Science، 316 (5831): 1556–1557، يونيو 2007، doi:10.1126/science.316.5831.1556، PMID 17569836.
- Slack, J.M.W. Genes-A Very Short Introduction. Oxford University Press 2014
- Alberts؛ Johnson؛ Lewis؛ Raff؛ Roberts؛ Walter (2002)، Molecular Biology of the Cell (ط. Fourth)، New York: Garland Science، ISBN 978-0-8153-3218-3، مؤرشف من الأصل في 19 سبتمبر 2019.
- J. Gene Med. Gene Therapy Clinical Trials Database. http://www.wiley.com/legacy/wileychi/genmed/clinical/ نسخة محفوظة 2019-11-19 على موقع واي باك مشين.
- Miko (2008)، "Gregor Mendel and the Principles of Inheritance"، Nature Education Knowledge، SciTable، Nature Publishing Group، 1 (1): 134، مؤرشف من الأصل في 19 يوليو 2019.
- Chial (2008)، "Mendelian Genetics: Patterns of Inheritance and Single-Gene Disorders"، Nature Education Knowledge، SciTable، Nature Publishing Group، 1 (1): 63، مؤرشف من الأصل في 31 مارس 2019.
- "DNA elongation rates and growing point distributions of wild-type phage T4 and a DNA-delay amber mutant"، J. Mol. Biol.، 106 (4): 963–981، 1976، doi:10.1016/0022-2836(76)90346-6، PMID 789903.
- "Estimate of the mutation rate per nucleotide in humans"، Genetics، 156 (1): 297–304، سبتمبر 2000، PMC 1461236، PMID 10978293، مؤرشف من الأصل في 8 أبريل 2011.
- "Analysis of genetic inheritance in a family quartet by whole-genome sequencing"، Science، 328 (5978): 636–639، أبريل 2010، Bibcode:2010Sci...328..636R، doi:10.1126/science.1186802، PMC 3037280، PMID 20220176، مؤرشف من الأصل في 1 مايو 2010.
- "Rates of spontaneous mutation"، Genetics، 148 (4): 1667–1686، أبريل 1998، PMC 1460098، PMID 9560386، مؤرشف من الأصل في 21 أغسطس 2010.
- "What kinds of gene mutations are possible?"، Genetics Home Reference، United States National Library of Medicine، 11 مايو 2015، مؤرشف من الأصل في 15 مارس 2016، اطلع عليه بتاريخ 19 مايو 2015.
- Andrews (2010)، "Natural Selection, Genetic Drift, and Gene Flow Do Not Act in Isolation in Natural Populations"، Nature Education Knowledge، SciTable، Nature Publishing Group، 3 (10): 5، مؤرشف من الأصل في 31 مارس 2019.
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة الكيمياء الحيوية
