ببسين
بِبْسين[2] أو هَضْمين[2] (بالإنجليزية: Pepsin) هو إنزيم هضمي يقوم بهضم البروتينات في المعدة. الدرجة المثلى لعمل هذا الإنزيم هي 1.5 أس هيدروجيني وهو وسط شديد الحموضة.[3] يتم إطلاق مولدالببسين، وهو إنزيم ببسينوجين، بواسطة الخلايا الرئيسية في جدار المعدة، وعند الاختلاط مع حمض الهيدروكلوريك في عصير المعدة، ينشط بيبسينوجين ليصبح ببسين ويقوم بوظيفته في تفكيك بروتينات الغذاء إلى جزيئات بسيطة من الأحماض الأمينية. أصل الكلمة يعود إلى الكلمة الإغريقية بيبسس πέψης وتعني هضم.
| pepsin A | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
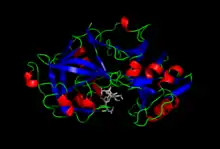 الببسين يكون معقدا مع الببستاتين.[1] | |||||||||||
| أرقام التعريف | |||||||||||
| رقم التصنيف الإنزيمي | 3.4.23.1 | ||||||||||
| رقم التسجيل CAS | 9001-75-6 | ||||||||||
| قواعد البيانات | |||||||||||
| قاعدة بيانات الإنزيم | راجع IntEnz | ||||||||||
| قاعدة بيانات براونشفايغ | راجع BRENDA | ||||||||||
| إكسباسي | راجع NiceZyme | ||||||||||
| موسوعة كيوتو | راجع KEGG | ||||||||||
| ميتاسيك | المسار الأيضي | ||||||||||
| بريام | ملف التعريف | ||||||||||
| تركيب بنك بيانات البروتين | RCSB PDB PDBe PDBsum | ||||||||||
| الأونتولوجيا الجينية | AmiGO / EGO | ||||||||||
| |||||||||||
| pepsin C (gastricsin) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| أرقام التعريف | |||||||||||
| رقم التصنيف الإنزيمي | 3.4.23.3 | ||||||||||
| رقم التسجيل CAS | 9012-71-9 | ||||||||||
| قواعد البيانات | |||||||||||
| قاعدة بيانات الإنزيم | راجع IntEnz | ||||||||||
| قاعدة بيانات براونشفايغ | راجع BRENDA | ||||||||||
| إكسباسي | راجع NiceZyme | ||||||||||
| موسوعة كيوتو | راجع KEGG | ||||||||||
| ميتاسيك | المسار الأيضي | ||||||||||
| بريام | ملف التعريف | ||||||||||
| تركيب بنك بيانات البروتين | RCSB PDB PDBe PDBsum | ||||||||||
| |||||||||||
تم اكتشاف الببسين على يد العالم تيودور شوان عام 1836م حيث كان الببسين أول إنزيم حيواني يتم اكتشافه.
التاريخ
كان الببسين من أوائل الإنزيمات التي تم اكتشافها، تم اكتشافه في عام 1836 من قبل تيودور شوان صاغ شوان اسمه من الكلمة اليونانية πέψις، بمعنى «الهضم» (من ept peptein «إلى الهضم»). في أوائل القرن التاسع عشر.[4][5][6][7] بدأ العلماء في هذا الوقت باكتشاف مركبات كيميائية حيوية عديدة والتي تلعب دوراً هاماً في العمليات البيولوجية والببسين كان واحداً منها. وكانت المادة الحمضية التي كانت قادره علي تحويل الاطعمة القائمة علي النيتروجين إلى مواد قابله للذوبان في الماء لتكون بيبسين.[8]
في عام 1928، أصبح أحد الإنزيمات الأولى التي تم تبلورها عندما قام جون إتش نورثروب ببلورته باستخدام غسيل الكلى والترشيح والتبريد.[9]
مراجع
- ببب: 1PSO; Fujinaga M, Chernaia MM, Tarasova NI, Mosimann SC, James MN (1995)، "Crystal structure of human pepsin and its complex with pepstatin"، Protein Sci.، 4 (5): 960–72، doi:10.1002/pro.5560040516، PMC 2143119، PMID 7663352.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|شهر=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - إدوار غالب، الموسوعة في العلوم الطبيعية (ط. الثانية)، دار المشرق، بيروت، ج. الأول، ص.167، يُقابله Pepsine
- "Enzyme entry 3.4.23.1"، إكسباسي Bioinformatics Resource Portal، SIB، مؤرشف من الأصل في 9 ديسمبر 2019، اطلع عليه بتاريخ 14 ديسمبر 2008.
- Florkin M (مارس 1957)، "[Discovery of pepsin by Theodor Schwann]"، Revue Medicale de Liege (باللغة الفرنسية)، 12 (5): 139–44، PMID 13432398.
- Asimov, Isaac (1980)، A short history of biology، Westport, Conn: Greenwood Press، ص. 95، ISBN 9780313225833.
- Harper, D، "Pepsin"، قاموس علم اشتقاق الألفاظ، مؤرشف من الأصل في 1 مايو 2019.
- πέψις, πέπτειν. هنري جورج ليدل; روبرت سكوت; A Greek–English Lexicon في مشروع بيرسيوس.
- Fruton JS (يونيو 2002)، "A history of pepsin and related enzymes"، The Quarterly Review of Biology، 77 (2): 127–47، doi:10.1086/340729، JSTOR 3071644، PMID 12089768.
- Northrop JH (مايو 1929)، "Crystalline pepsin"، Science، 69 (1796): 580، Bibcode:1929Sci....69..580N، doi:10.1126/science.69.1796.580، PMID 17758437.
اقرأ أيضا
- بوابة علم الأحياء
- بوابة الكيمياء
- بوابة الكيمياء الحيوية
- بوابة طب
- بوابة علم الأحياء الخلوي والجزيئي